2024-11-30 東京大学
発表のポイント
- タンパク質と合成蛍光分子を適切に組み合わせることで、カリウムイオンに対する高性能な蛍光センサーを開発しました。
- 有機合成化学とタンパク質工学を融合した設計戦略により、従来よりも明るくて使いやすい性質を持つセンサーが開発できました。
- 細胞内のさまざまな場所で適用可能であり、医薬品候補化合物の評価などに応用が期待されます。
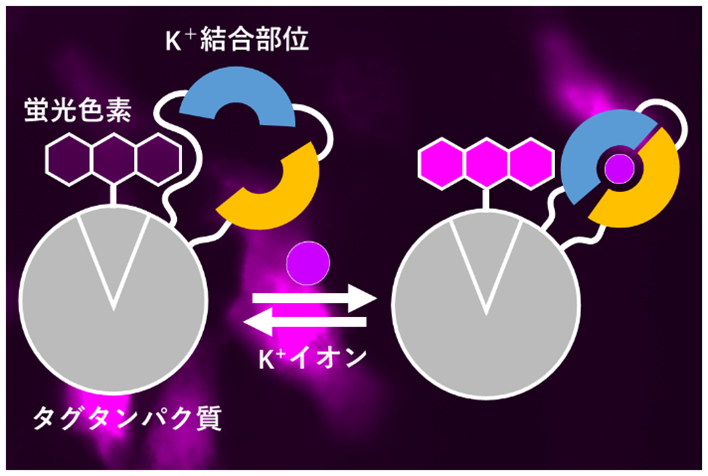
開発した蛍光センサーの概念図
発表概要
東京大学大学院理学系研究科のロバート・E・キャンベル教授、寺井琢也准教授、程大洲大学院生らによる研究グループは、生体内で重要な役割を担うカリウムイオン(K⁺)に対する高性能な蛍光センサー(注1)を開発しました。
K⁺は細胞内で最も豊富に存在する金属イオンで、生物の中で不可欠な役割を果たしています。その役割を探るため、これまでいくつかの蛍光センサーが作られてきましたが、細胞や組織中での局在化が可能で、イオン選択性が高く、長波長領域で高い蛍光応答を示すセンサーは報告がありませんでした。本研究では、HaloTagタンパク質(注2)と細菌由来のK⁺結合タンパク質(Kbp)、低分子色素を組み合わせた化学遺伝学(注3)K⁺センサー「HaloKbp1シリーズ」を開発しました。このセンサーは、赤色から遠赤色領域での明るさ、大きな蛍光強度変化、およびK+生体内濃度に対応したさまざまな親和性を特徴としています。研究チームはまた、これらのセンサーが細胞内でのK⁺濃度変化を可視化できることを実証しました。
本成果はJournal of the American Chemical SocietyのSupplementary Cover にも選出されました。
発表内容
カリウムイオン(K+)は細胞内で最も豊富に存在する金属イオンであり、神経細胞の活動や筋肉の収縮などさまざまな生理現象に深く関係しているほか、その関連タンパク質は医薬品開発においても注目されています。K+のようなイオンや代謝産物が、生きた細胞や生物個体の中で、どのように分布、移動し、相互作用しているかを可視化できる有用な研究ツールが蛍光センサーです。その開発にあたっては近年、蛍光分子とタンパク質を併用する化学遺伝学的アプローチが注目されていますが、この手法は現在のところ、カルシウムイオンなど限られた標的にしか適用されていません。K+については、細胞や組織中での局在化が可能で、イオン選択性が高く、長波長領域で高い蛍光応答を示すセンサーは報告がなく、これらの条件を満たした新たなセンサー開発が求められていました。
そこで本研究では、HaloTagタンパク質を基本骨格とする化学遺伝学K+センサーの開発によって上記の課題を解決することに取り組みました(図1)。
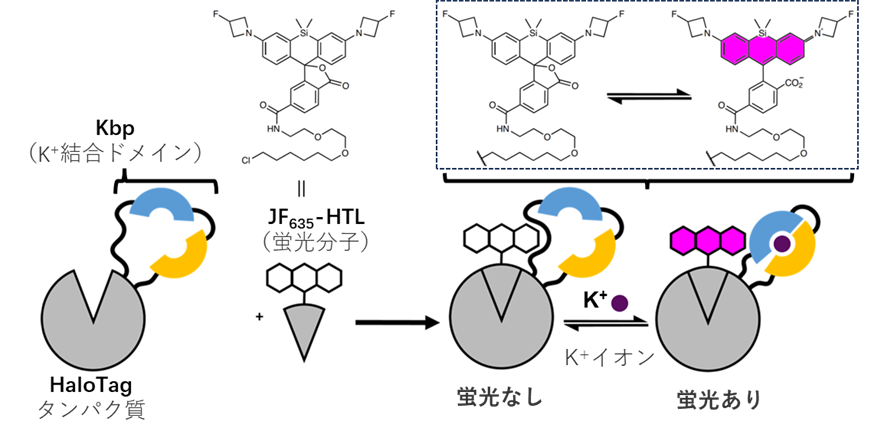
図1:本研究で開発したセンサーの模式図
K+結合ドメインであるKbpへ金属イオンが結合することで、遠赤色蛍光分子JF635-HTLの蛍光強度が変化する。
まず、K+の結合ドメインとして知られる細菌由来のK⁺結合タンパク質(Kbp)をHaloTagタンパク質中の32箇所に挿入しました。そして、これらのタンパク質に対して、HaloTagと選択的に結合できる遠赤色蛍光分子JF635-HTL(注4)を結合させ、K+依存的な蛍光変化を測定しました。その結果、K+添加によって蛍光強度が88%増加する変異体が同定されました。続いて、タンパク質への変異導入と性能評価を繰り返すことで(=指向性進化注5)、K+による蛍光増加をさらに大きくしました。最終的に得られた3つのセンサー(HaloKbp1シリーズ)はK+添加によって最大約30倍の選択的な蛍光増加を示しました。これら3つの変異体はK+に対して異なる親和性を持つため、状況に応じて使い分けができます。また、タンパク質の結晶構造解析も行いました(図2)。K+が結合している場合、Kbp中の1本のαヘリックス(水色)の双極子が、K⁺と蛍光分子とを結ぶ「橋」として機能し、センサーの機能に重要である可能性が推測されます。
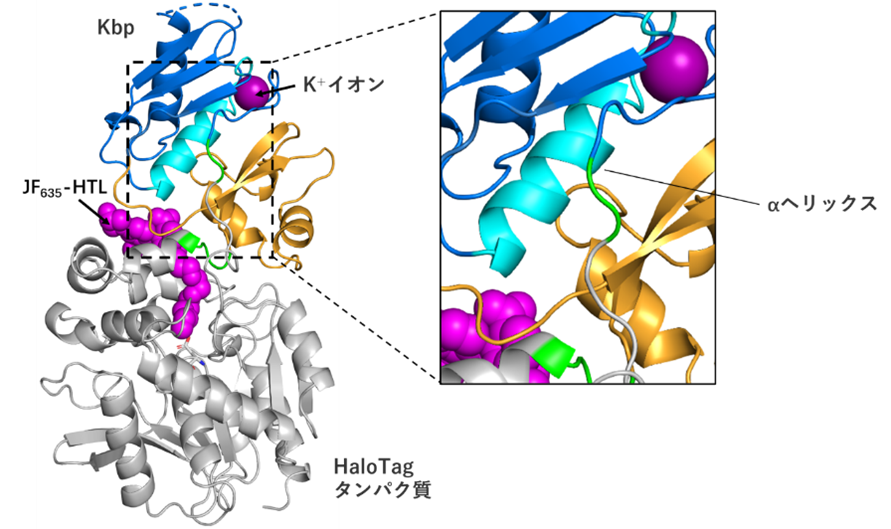
図2:HaloKbp1のX線結晶構造解析
センサー機能に重要な可能性がある、K+とJF635-HTL を結ぶαヘリックスを拡大して示した。
続いて、HaloKbp1シリーズをHeLa細胞(注6)に発現させてK⁺イメージングを行いました。K+の添加によってHaloKbp1シリーズの蛍光は大きく上昇し、細胞内でもK+センサーとして機能することが確認されました(図3上)。さらに、本センサーが遠赤色であることを活かし、既存の緑色K⁺センサーと組み合わせた多重イメージング(注7)も実現しました(図3下)。
本研究で確立したセンサー開発の方法論は、今後さまざまな標的に対して化学遺伝学センサーを開発するうえで役に立ちます。またHaloKbp1シリーズは、明るさや蛍光応答の大きさ、波長特性などの点で従来のセンサーより優れており、細胞内のさまざまな場所で適用可能です。今後は、本センサーの生物学・医学研究、医薬品候補化合物の評価などへの応用が期待されます。
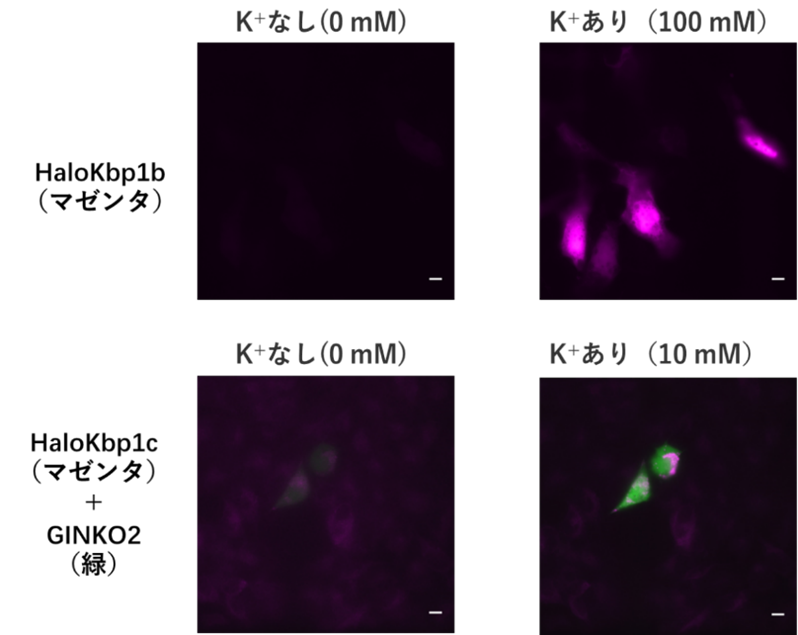
図3:HaloKbpによるHeLa細胞イメージング
上:HaloKbp1bを導入したHeLa細胞の蛍光画像。K+の有無で大きな蛍光強度変化が確認された。下:ミトコンドリアに局在するHaloKbp1cと細胞質に局在する既存の緑色センサーGINKO2の多重イメージング。K+溶液を加えた後(右)では、2色の蛍光が共に強くなっている。スケールバーは10 μm。
〇関連情報:
「プレスリリース 二刀流センサーで細胞を光らせろ!」(2022/09/23)
論文情報
- 雑誌名
Journal of the American Chemical Society論文タイトル
High-Performance Chemigenetic Potassium Ion Indicator著者
Dazhou Cheng, Zhenlin Ouyang, Xiaoyu He, Yusuke Nasu, Yurong Wen, Takuya Terai* & Robert E. Campbell*(*責任著者)DOI番号
10.1021/jacs.4c10917
研究助成
本研究は、科研費「化学遺伝学蛍光センサーシリーズの開発による多色・多標的細胞イメージング(課題番号:23K26794)」、「Massive Expansion of the Palette of Fluorescent Protein-based Sensors for Multiplexed Imaging of Signaling and Metabolism(課題番号:24H00489)」、「生成的デザインと指向性進化による近赤外蛍光バイオセンサーの開発(課題番号:24H02267)」等の支援により実施されました。
用語解説
注1 蛍光センサー
標的となる物質と結合する事で、その蛍光特性が変化する機能性分子。生命現象や病気の原因を明らかにするために、これまで合成低分子や蛍光タンパク質を基本骨格とするさまざまな蛍光センサーが開発、応用されている。
注2 HaloTagタンパク質
特定の低分子(クロロアルカン)と選択的に結合するよう改変された人工タンパク質。化学遺伝学センサーの基本骨格として頻繁に使われている。
注3 化学遺伝学
合成低分子とタンパク質が選択的に結合した複合体を使うことで、それぞれ単独では難しかった機能を実現しようとする戦略のこと。英語ではchemigeneticと書かれる。
注4 JF635-HTL
HaloTagタンパク質を蛍光標識するために設計された有機合成低分子。最大発光波長が660 nmに達する遠赤色蛍光を持ち、またタンパク質に結合したときのみ強い蛍光を発するため、化学遺伝学的センサーでの使用に適している。
注5 指向性進化
自然界の進化の過程を実験室内で模倣し、変異導入によるライブラリー作製、所望の性質を持つ変異体の選択、選択された遺伝子の増幅、のサイクルを繰り返すことで生体高分子の性能を向上させる方法。英語ではdirected evolutionと呼ばれる。
注6 HeLa細胞
1951年にヒトの子宮頸がんから分離された細胞であり、増殖能が非常に高いことから、世界中で培養され数多くの研究で用いられている。
注7 多重イメージング
複数の蛍光色素(センサー)を同時に観察するイメージング。2つの現象の関連性などについて、単独の観察よりも多くの知見が得られる。