2024-12-23 京都大学iPS細胞研究所
ポイント
COVID-19 mRNAワクチンのブースター接種後の免疫記憶応答を解析し、以下の点を明らかにしました。
- 高齢者でも成人と同等のSタンパク質に対する抗体が産生された。
- 高齢者でも記憶T細胞応答は起きたが、成人より低かった。
- 記憶B細胞は高齢者でも効果的に活性化され、高齢者と成人で同等の応答が起こった。
1. 要旨
米谷耕平助教、濵﨑洋子教授(CiRA未来生命科学開拓部門)らの研究グループは、京都大学医学部附属病院(クリニカルバイオリソースセンター、次世代医療・iPS細胞治療研究センターなど)、米国ラホヤ研究所らとの共同で、新型コロナウイルス感染症(COVID-19)に対するmRNAワクチン注1)の3回目接種による免疫応答を調べました。その結果、高齢者(65歳以上)でも免疫応答注2)は活性化されるものの、成人(65歳未満)と比較すると細胞性免疫に関わる記憶T細胞注3)の活性化が低いこと、一方で抗体応答を担う記憶B細胞注3)の応答は効率よく誘導され、成人と同等の抗体を産生できることを明らかにしました。
3回目以降のワクチン反復接種の効果は、初回(1,2回目)の接種で誘導されて体内に残った記憶T細胞と記憶B細胞が主に担うと考えられ、一般に記憶応答は最初の応答より早く強い応答がおこることが知られています。しかし、この記憶応答に年齢による違いがあるかについては、これまで詳細に調べられていませんでした。
そこで今回、3回目のCOVID-19mRNAワクチンを接種された方を対象として、免疫記憶応答の年齢差を調査しました。その結果、65歳以上の高齢者では、スパイク(S)タンパク質に結合する抗体、および感染防御に働きうる中和抗体注4)が、65歳未満の成人と同等に産生されていました。意外なことに、抗体産生を助ける、Sタンパク質に特異的なヘルパーT細胞は、成人と比較すると高齢者では少ない数にとどまりました。また、ウイルス感染細胞を殺傷する細胞傷害性T細胞注2)も、3回目のワクチン接種で増加するものの、成人と比べると高齢者は少ない値となりました。一方、抗体をつくるB細胞応答については、初回接種後高齢者は成人と比べて弱いものの、3回目接種を受けることで大幅に改善され、成人と同程度のレベルになりました。
以上のことから、高齢者においてCOVID-19に対するmRNAワクチンのブースター接種は、抗体を介した液性免疫を改善する効果がありますが、細胞性免疫に関しては成人ほど効果的ではない可能性が示唆されました。この研究は、高齢者により効果的なワクチンの開発や、ワクチン戦略・スケジュールの立案に役立つことが期待されます。
この研究成果は2024年12月9日「Frontiers in Immunology」で公開されました。
2. 研究の背景
高齢になると免疫応答能の低下をはじめとした様々な要因により、COVID-19を含む感染症にかかりやすく、また重症化しやすくなります。したがって、高齢者には特にワクチン接種が推奨されていますが、免疫の能力そのものが低下しているため、若い人と比べるとワクチンの利益と有効性も限定的とされています。
新型コロナウイルスパンデミックにより新たに開発されたCOVID-19 mRNAワクチンは、当初高齢者でも重症化や感染を効果的に予防しましたが、2回接種後の抗体価と中和活性のピークの値は成人と比べて低く、また早く低下することから、高齢者はワクチン接種後早期に感染しやすくなるとされています。研究グループは以前に、高齢者のT細胞応答が、成人と比較して低下していることを示し、高齢者のワクチンの効果が低い理由を説明しています(参考:CiRAニュース 2023年1月13日)。
これまでにも、高齢者の抗体価と中和活性は、3回目の接種後に若い成人と同程度になることが知られていました。これは、最初の免疫応答の後、記憶T細胞と記憶B細胞が体内に残り、同じ抗原に暴露された際に迅速かつ強力な反応を誘導する「免疫記憶」注3)の効果によるものと考えられます。しかしながら、高齢者における記憶T細胞や記憶B細胞の応答特性や、3回目以降のブースター接種により高齢者で抗体応答が増強する詳細なメカニズムは明らかにされていませんでした。
COVID-19 mRNAワクチンは今後、インフルエンザワクチンのように定期的に接種される可能性があります。また、mRNAワクチンはCOVID-19だけでなく、様々な感染症やがんの重要なワクチンモダリティ(ワクチンを開発する手段)と期待されています。したがって、高齢者におけるブースター接種後の記憶応答の特性を理解することは重要です。
以上の背景のもとこの研究では、成人(65歳未満)と高齢者(65歳以上)の方にご協力いただき(参考:CiRAニュース 2021年4月30日)、COVID-19 mRNAワクチン接種における初回(1,2回目)接種後およびブースター(3回目)接種後のSタンパク質特異的なヘルパーT細胞および細胞傷害性T細胞、B細胞の応答について、長期的な動態を比較することで高齢者の記憶応答特性を評価しました。
3. 研究結果
1. 3回目のワクチン接種により高齢者の抗体価と中和活性は成人と同程度になった
抗体応答を調べるために、ウイルスの受容体結合ドメイン(RBD)に対するIgG抗体の抗体価を、ワクチン接種前から3回目接種後6か月まで経時的に調べました。その結果、初回(1,2回目)接種後のピーク値は高齢者で低く、この差が維持されたまま6か月後には両群でピーク時の約1/20程度に低下していました。これに対し、3回目の接種により、高齢者でも成人群と同等まで上昇しました。(Fig. 1)。また、接種後6か月経過しても、高齢者・成人ともに、初回接種後6か月後と比較して、高い濃度が維持されていました。
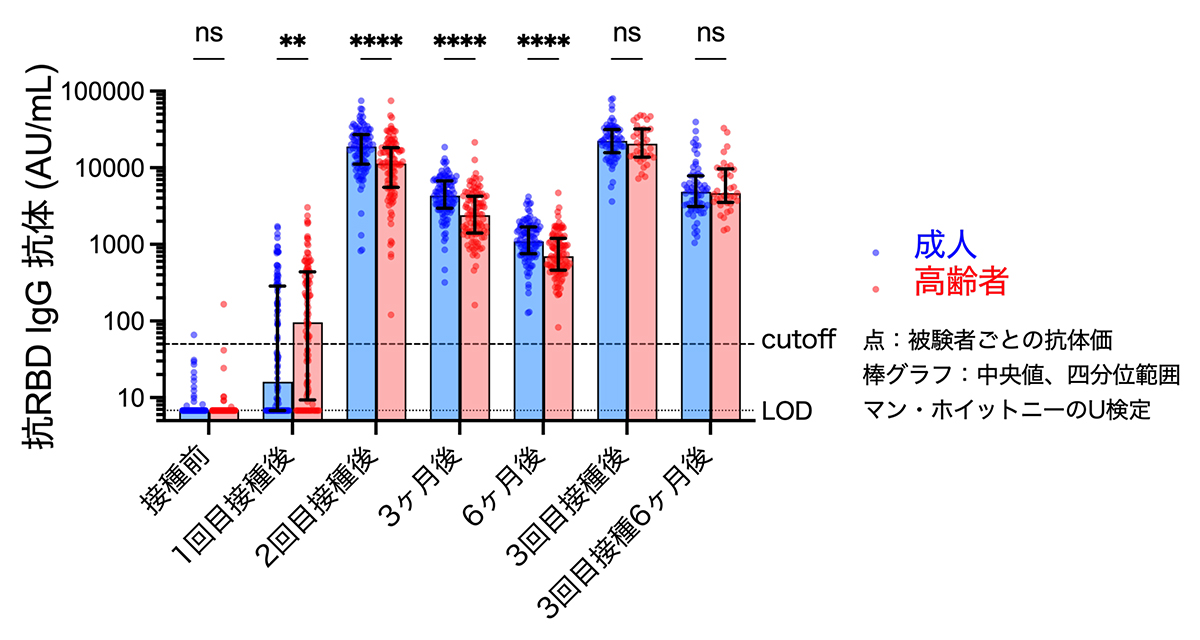
Fig. 1 RBDに対する抗体価の年齢差
*印は統計的に有意差があったことを、nsは有意差が無かったことを示す
2. 3回の接種で高齢者血清の中和活性は成人と同程度になった
次に、もともとの新型コロナウイルス株(祖先株)と変異株(オミクロン株)に対する中和抗体の活性を測定しました。2回目接種後では両群とも変異株に対する中和能力はほとんどありませんでしたが、3回目接種後は中和活性が上昇し、高齢者と成人とで差は見られませんでした。
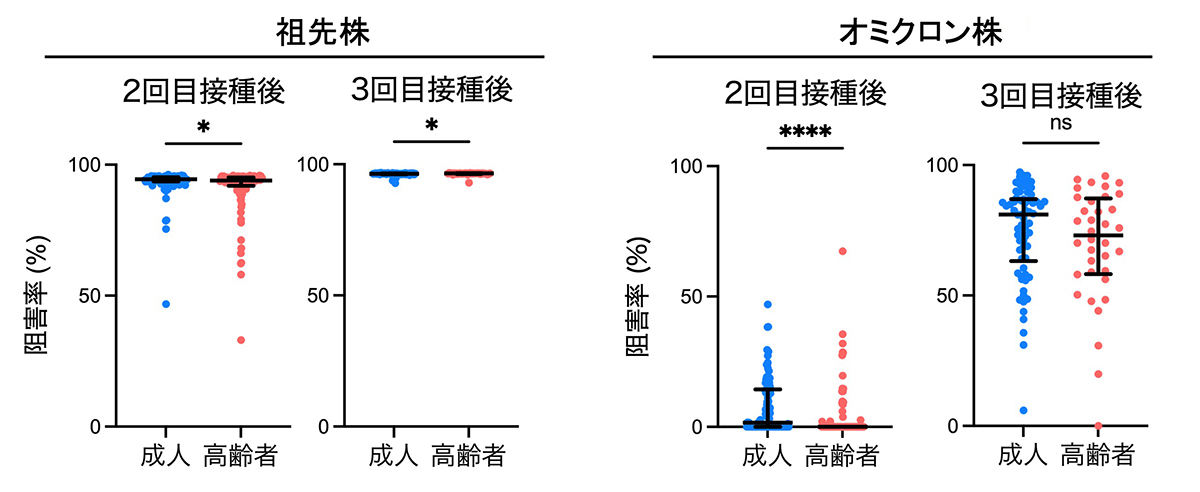
Fig. 2 変異株に対する中和活性の年齢差
3. 3回目接種で中和抗体の産生を促すT細胞の数は高齢者でも増加したものの成人よりは少なかった
3回目のワクチン接種により、高齢者の抗体産生が高まったメカニズムを調べるため、抗体産生を促す記憶ヘルパーT細胞(cTfh1細胞)の応答を調べました。3回目接種後、高齢者・成人ともにcTfh1細胞の数が増加しましたが、高齢者では成人と比べると低い値にとどまりました。
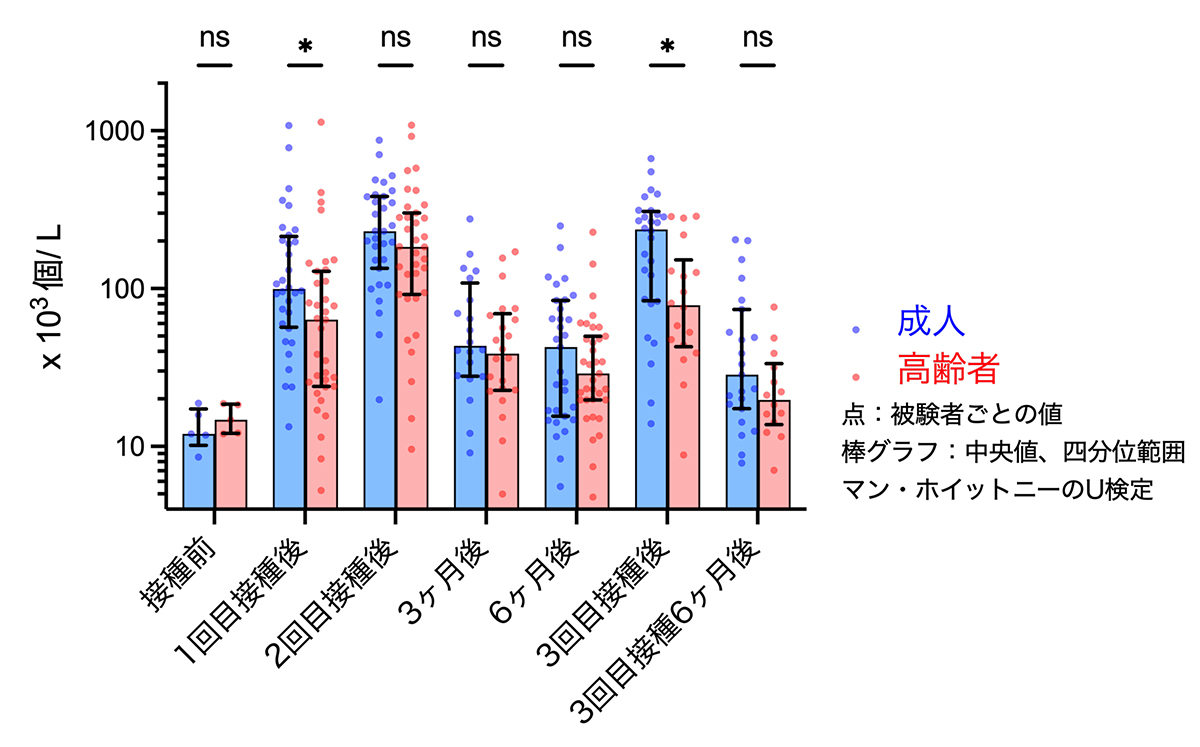
Fig. 3 抗体産生を促進するヘルパーT細胞(cTfh1細胞)応答の年齢差
4. 3回目接種後、細胞傷害性T細胞数も高齢者は成人より少なかった
次に、ウイルスに感染した細胞を殺傷する細胞傷害性T細胞(CD8+ T細胞)の反応を調べました。3回目のワクチン接種により、高齢者・成人ともに増加していましたが、高齢者では低い値となりました。
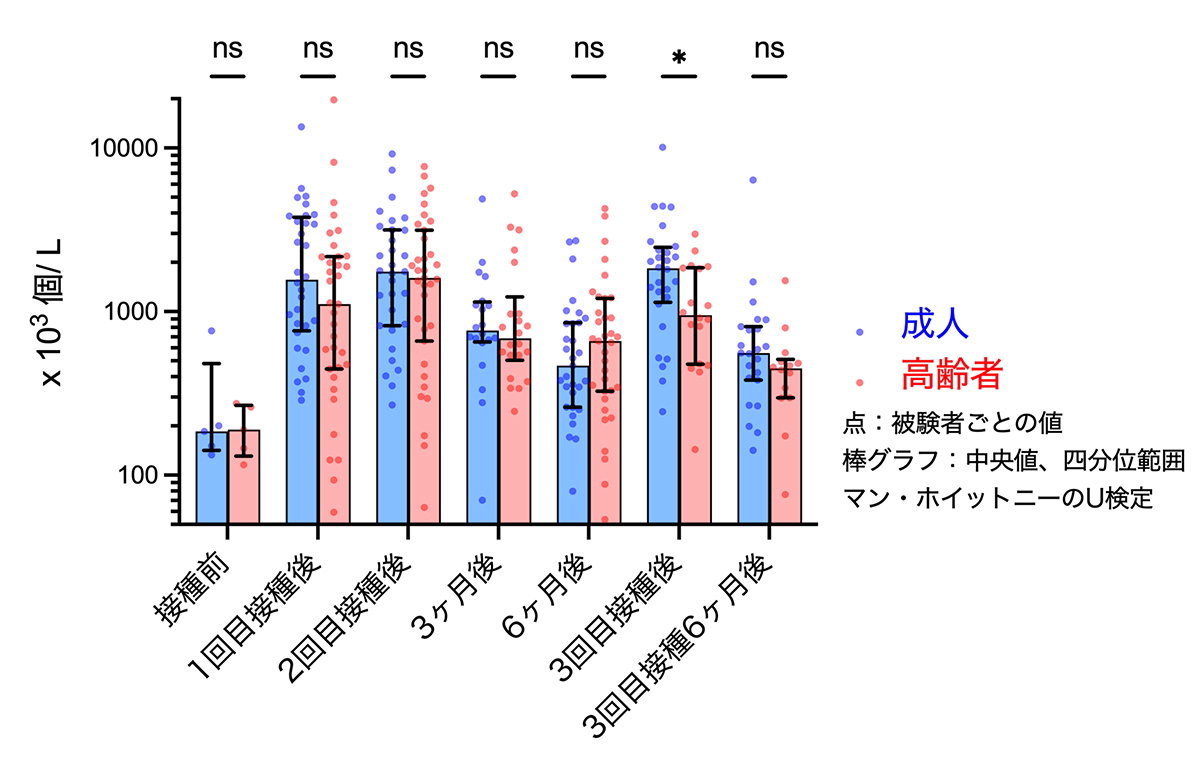
Fig. 4 細胞傷害性T細胞応答の年齢差
5. 3回目接種で高齢者の記憶B細胞数は成人と同等に誘導された
次に抗体を産生する記憶B細胞の応答について調べました。初回の接種では、成人と比べると高齢者では、祖先株、オミクロン株を認識する記憶B細胞共に少ない傾向がありましたが、3回目の接種では、高齢者も成人と同等に誘導されていました。
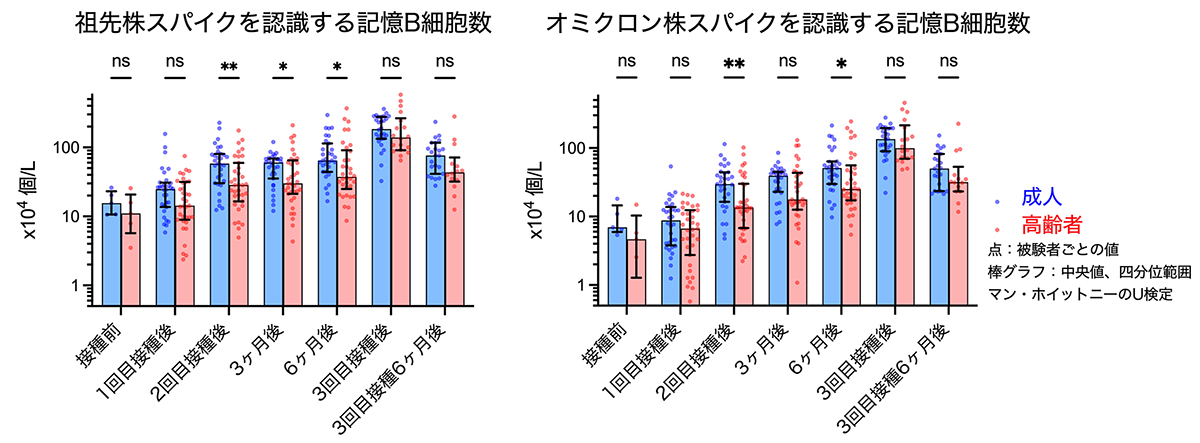
Fig. 5 抗体を作るB細胞応答の年齢差
4. まとめ
本研究では、COVID-19 mRNAワクチンのブースター接種による免疫記憶応答の、高齢者と成人との違いを調べました。3回目のワクチン接種により、高齢者ではB細胞の応答が成人と同等まで増強されていました。一方、T細胞の応答もおこりましたが成人と比べると低いレベルにとどまったことから、高齢者ではT細胞の記憶応答が誘導されにくいと考えられます。すなわち、3回目接種により高齢者でもB細胞応答が増強されるため、ヘルパーT細胞の誘導が弱くても抗体がになう液性免疫は増強しますが、細胞傷害性T細胞の誘導は依然として低い傾向があることが分かりました。
したがって、高齢者では細胞性免疫をより効率的に活性化することが今後の課題と考えられます。他方で、これは必ずしも高齢者で効果がないということではなく、免疫T記憶の維持には役立っている可能性があります。また、さらなる追加接種により高齢者のT細胞応答や免疫記憶が改善したかについて、今後さらなる検討を行っていきます。
以上、今回の研究成果は、免疫システムの老化の理解につながり、高齢者により効果的なワクチンや治療法の開発、さらにはワクチン戦略の立案に役立つことが期待されます。
5. 論文名と著者
- 論文名
Booster COVID-19 mRNA vaccination ameliorates impaired B-cell but not T-cell responses in older adults - ジャーナル名
Frontiers in Immunology - 著者
Kohei Kometani1, Takaaki Yorimitsu1,2, Norihide Jo1,3, Erina Yamaguchi1, Osamu Kikuchi4,5,6, Masaru Fukahori7,8, Takeshi Sawada7,8, Yoshitaka Tsujimoto1,9, Ayana Sunami1,10, Mengqian Li1, Takeshi Ito1, Yann Pretemer1, Yuxian Gao1,10, Yu Hidaka11, Masaki Yamamoto12, Natsuko Kaku13,14, Yu Nakagama13,14, Yasutoshi Kido13,14, Alba Grifoni15,16, Alessandro Sette15, Miki Nagao12, Satoshi Morita11, Takako E. Nakajima7,8, Manabu Muto4,5,8 and Yoko Hamazaki1,10,17* - 著者の所属機関
- 京都大学iPS細胞研究所 (CiRA)
- 京都大学大学院医学研究科 人間健康科学専攻
- 京都大学大学院医学研究科 先端医療基盤共同研究講座
- 京都大学大学院医学研究科 腫瘍内科学講座
- 京都大学医学部附属病院 クリニカルバイオリソースセンター
- 京都大学大学院医学研究科附属 がん免疫総合研究センター
- 京都大学大学院医学研究科 早期医療開発学
- 京都大学医学部附属病院 次世代医療・iPS細胞治療研究センター
- 京都大学大学院医学研究科 脳神経外科学
- 京都大学大学院医学研究科 免疫生物学
- 京都大学大学院医学研究科 医学統計生物情報学
- 京都大学大学院医学研究科 臨床病態検査学
- 大阪公立大学大学院医学研究科 ウイルス・寄生虫学
- 大阪公立大学 大阪国際感染症研究センター
- Center for Vaccine Innovation, La Jolla Institute for Immunology
- Department of Medicine, Division of Infectious Diseases and Global Public Health,
University of California, San Diego (UCSD) - 京都大学免疫モニタリングセンター
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)
(JP21gm5010005, JP20fk0108265, JP20fk0108454, JP223fa627009, and JP24gm1810012) - iPS細胞研究基金
- 京都大学iPS細胞研究所山中伸弥研究室への新型コロナウイルス特別研究助成
- 文部科学省/日本学術振興会(JSPS) 科研費(19K23862, 21K15467)
- 関西経済連合会
- 京都大学三井住友信託銀行COVID19研究基金
- 武田科学振興財団
- 京都大学医学部教育研究支援基金
- 米国国立アレルギー・感染症研究所(National Institute of Allergy and Infectious Diseases)
- 米国国立衛生研究所(National Institutes of Health)
- 米国保健社会福祉省(Department of Health and Human Services)
7. 謝辞
採血にご協力いただいたボランティアの皆様に、心から御礼申し上げます。
8. 用語説明
注1)mRNAワクチン
メッセンジャーRNA(mRNA)という分子を使用して免疫応答を誘導するワクチン。mRNAは、体内の細胞に取り込まれ、細胞内で特定のタンパク質を合成する指示を伝える。COVID-19ワクチンでは、新型コロナウイルスのスパイクタンパク質を合成するよう設計されており、免疫系がウイルスに対する免疫応答能を獲得する。
注2)免疫応答
病原体に対する感染防御と排除を担う生体反応のこと。細胞性免疫と液性免疫の2つの主要なタイプがある。細胞性免疫は、細胞傷害性T細胞などがウイルスなどが感染した細胞を直接殺傷する。液性免疫は、ヘルパーT細胞がサイトカインなどを産生することでB細胞に抗体産生を誘導する。抗体は、病原体に特異的に結合し、中和したり排除を促進したりする。
注3)記憶細胞 (記憶B細胞・記憶T細胞など)
過去に特定の抗原(病原体など)にさらされた際に形成され体内に維持される免疫細胞のこと。再び同じ病原体にさらされた場合に、迅速で強い応答を引き起こすことができる(免疫記憶)。
注4)中和抗体
病原体の表面の特定の部位に結合し、受容体との結合を阻害することで細胞への感染を防止する抗体のこと。