2018/11/20 九州大学,日本医療研究開発機構,理化学研究所
九州大学大学院医学研究院の今井猛教授、大学院生坂口理智(京都大学大学院生命科学研究科博士課程3年)、Marcus Leiwe助教からなる研究グループは、蛍光タンパク質を用いて神経回路を明るくカラフルに染色し、神経回路のつながり方を明らかにする新しい手法Tetbow法を開発しました。
我々の脳機能は、膨大な数の神経細胞がつながった神経回路によって生み出されます。従って、脳の機能を理解するには、神経細胞の配線を一つ一つ明らかにすることが必要です。しかしながら、一つ一つの神経細胞を区別してその配線様式を明らかにすることは容易ではありません。2007年に、個々の神経細胞に異なる色の蛍光タンパク質を異なる組み合わせで発現させ、個々の神経細胞を区別して蛍光標識する手法が開発されました。しかしながら、この従来法では輝度が十分ではなく、神経細胞の配線の全貌を明らかにすることが困難でした。そこで、本研究では様々な改良を加え、蛍光輝度を大幅に向上した改良版Tetbowを開発しました。Tetbow法を用いてマウスの脳を染色し、さらに研究グループが以前に開発した、脳を透明にする手法SeeDB2を用いて脳標本を透明化すると、多くの神経細胞が複雑に配線する様子を大規模かつ立体的に捉えることが可能となりました。実際にマウス嗅球の僧帽細胞では、樹状突起が複雑に配線する様子を立体的に可視化できたほか、数ミリメートル以上の長い軸索をカラフルに染めて追跡することができました。本手法は神経回路の詳細な配線様式の研究を加速し、神経回路の作用機序や発達、精神疾患の神経回路基盤を明らかにする研究に貢献することが期待されます。
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」、新学術領域研究「スクラップ&ビルドによる脳機能の動的制御」、日本学術振興会(JSPS)科学研究費補助金、ブレインサイエンス財団の助成によって行われました。成果は、11月20日に英国のオンライン科学雑誌『eLife』に掲載されます。また、本研究は九州大学および理化学研究所にて実施されました。
詳細ファイル
神経細胞を明るくカラフルに染めることで神経回路研究を加速
九州大学大学院医学研究院の今井猛教授、大学院生坂口理智(京都大学大学院生命科学研究科 博士課程 3 年)、Marcus Leiwe 助教からなる研究グループは、蛍光タンパク質を用いて神経回路 を明るくカラフルに染色し、神経回路のつながり方を明らかにする新しい手法 Tetbow 法を開発し ました。
我々の脳機能は、膨大な数の神経細胞がつながった神経回路によって生み出されます。従って、 脳の機能を理解するには、神経細胞の配線を一つ一つ明らかにすることが必要です。しかしなが ら、一つ一つの神経細胞を区別してその配線様式を明らかにすることは容易ではありません。2007 年に、個々の神経細胞に異なる色の蛍光タンパク質を異なる組み合わせで発現させ、個々の神経 細胞を区別して蛍光標識する手法が開発されました。しかしながら、この従来法では輝度が十分 ではなく、神経細胞の配線の全貌を明らかにすることが困難でした。そこで、本研究では様々な 改良を加え、蛍光輝度を大幅に向上した改良版 Tetbow を開発しました。Tetbow 法を用いてマウ スの脳を染色し、さらに研究グループが以前に開発した、脳を透明にする手法 SeeDB2 を用いて脳 標本を透明化すると、多くの神経細胞が複雑に配線する様子を大規模かつ立体的に捉えることが 可能となりました。実際にマウス嗅球の僧帽細胞では、樹状突起が複雑に配線する様子を立体的 に可視化できたほか(図 1)、数ミリメートル以上の長い軸索をカラフルに染めて追跡することが できました。本手法は神経回路の詳細な配線様式の研究を加速し、神経回路の作用機序や発達、 精神疾患の神経回路基盤を明らかにする研究に貢献することが期待されます。
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プ ロジェクト」、新学術領域研究「スクラップ&ビルドによる脳機能の動的制御」、日本学術振興会(JSPS) 科学研究費補助金、ブレインサイエンス財団の助成によって行われました。成果は、11 月 20 日 に英国のオンライン科学雑誌『eLife』に掲載されました。また、本研究は九州大学および理化学研 究所にて実施されました。
研究者からひとこと: Tetbow 法を使って得られた、神経回路の 美しい画像や動画をご覧下さい。
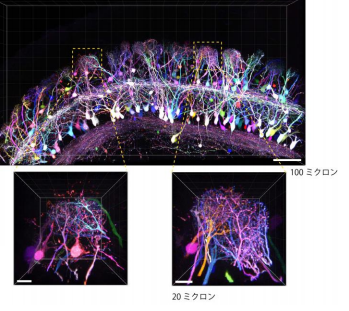
(図 1) マウス嗅球僧帽細胞・房飾細胞を Tetbow 法で標識。 樹状突起の混み合った配線の様子を異なる色で明 瞭に区別することができる。
■背 景
脳機能は多くの神経細胞からなる複雑な神経回路によって生み出されます。従って、脳の機能を理解するに は、神経回路の配線図を理解することが必要です。近年、脳標本を透明にする手法が数多く開発され、蛍光タ ンパク質によって標識された神経細胞を立体的に観察することが可能となってきました。しかしながら、脳の中 では数多くの神経細胞が複雑に絡み合っているため、神経細胞を単色で染色した場合、個々の神経細胞を区 別して配線パターンを調べることは容易ではありません。
個々の神経細胞を区別して観察するため、2007 年にハーバード大学の Lichtman 教授らのグループは Brainbow という手法を開発しました。Brainbow 法は、3 色の蛍光タンパク質をうまく組み合わせて中間色を作り 出すことで、多くの神経細胞を異なる色で標識できるという方法です。しかしながら、既存の Brainbow 法では蛍 光輝度が十分ではなく、神経細胞の配線の全体像を調べることが難しいという点が課題でした。
そこで、研究 グループは Brainbow 法の輝度の向上に取り組みました。
■研究手法と成果
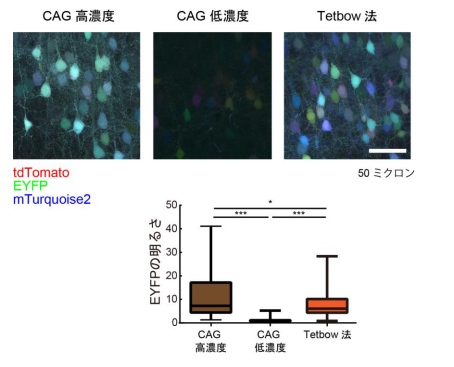
Brainbow 法においては、赤色、緑色、青色の 3 色の蛍光タンパク質をそれぞれ異なる組み合わせ導入する ことによって、個々の神経細胞を異なる色で染色することができます。例えば、ある細胞は「赤+赤+青=赤 紫」、別の細胞は「赤+緑+緑=黄緑」というように染色されます。しかしながら、輝度を上げるために蛍光タン パク質遺伝子をたくさん導入したらどうなるでしょうか?どの細胞でも赤と緑と青が同程度ずつ導入されること になってしまうため、色あいがどれも似通ってしまうことになります。したがって、輝度を向上させるには、導入 する遺伝子の数を増やすのではなく、個々の蛍光タンパク質遺伝子の強さを上げてやる必要があります。
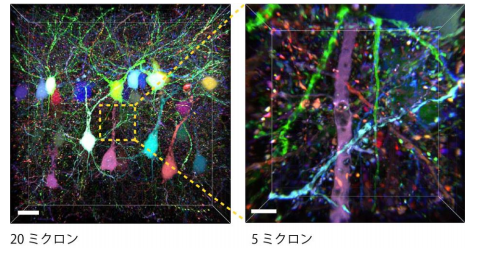
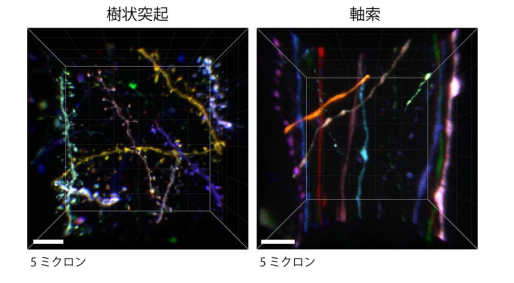
そこで研究グループは、従来の遺伝子プロモーター(※1)よりも蛍光タンパク質をたくさんつくりだすことがで きる、テトラサイクリン応答配列プロモーター(※2)を用いることで輝度の向上を実現しました(図2)。また、汎用 性を高めるためにプラスミドやウイルスベクターを用いて蛍光タンパク質遺伝子を導入する方法に最適化を行 いました。さらには、蛍光タンパク質だけでなく、ケミカルタグ(※3)と呼ばれるタンパク質を使い、合成色素での 多色標識も実現しました。このようにしてできた Brainbow 法の改良版、「Tetbow 法」を用いると、個々の神経細 胞を異なる色で、かつ高輝度で染色することが可能となりました。同グループが以前に開発した透明化試薬 SeeDB2(※4)を用いると、蛍光輝度を最大限保ったまま脳標本を透明にし、神経細胞を立体的に観察すること が可能です。たとえば、匂いの検出に関わる脳の嗅球の僧帽細胞の樹状突起が複雑に絡まり合う様子が可視 化できたほか(図 1)、大脳皮質の神経細胞においては、樹状突起や軸索の微細なシナプス構造までカラフル に浮かび上がらせることに成功しました(図 3、4)。
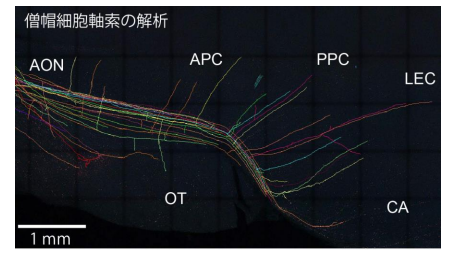
更に、Tetbow 法では、長距離に亘って伸びる軸索を追跡することも可能となりました。嗅球の僧帽細胞の軸 索は複雑に分岐し、数ミリメートルに亘って伸びているため、従来は追跡することが非常に困難でしたが、 Tetbow 法を用いることで、その全体像を観察することができました(図 5)。
■今後の期待
この手法は、蛍光顕微鏡を用いて、神経細胞の配線図を詳細かつ大規模に解析するための強力なツール になると期待されます。例えば、脳の機能や発達過程、精神疾患の神経回路基盤を明らかにするのに役に立 つと期待されます。また、Tetbow のウイルスベクターを使うことで、マーモセットをはじめとする高等ほ乳類の神 経回路の理解にもつながることが期待されます。
■本研究について
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェク ト」、新学術領域研究「スクラップ&ビルドによる脳機能の動的制御」(JP16H06456)、日本学術振興会(JSPS) 科学研究費補助金 JP17H06261, P16K14568, JP15H05572, JP15K14336, JP17K14946、ブレインサイエンス財 団の助成によって行われました。また、本研究は九州大学および理化学研究所にて実施されました。
■用語解説
(※1) プロモーター: DNA から RNA への転写を制御する、遺伝子上流の DNA 領域。RNA の転写効率もプロ モーターによってかなり決まると考えられている。
(※2) テトラサイクリン応答配列プロモーター: 大腸菌由来のDNA配列を改変して作られた人工的なプロモー ター。大腸菌由来の転写因子を改変した人工転写因子 tTA が結合すると転写が起こる。
(※3) ケミカルタグ: 遺伝子によってコードされたタンパク質で、そのままでは蛍光を発しないが、蛍光標識し た基質を反応させることで蛍光標識が可能な分子。近年、SNAP、HaloTag、CLIP といったケミカルタグが生命 科学研究に使われるようになっている。 (※4) SeeDB2: 今井猛教授のグループによって2016年に開発された組織透明化試薬。脳組織を数日浸ける ことで透明にすることができる。数ある透明化試薬の中でも、蛍光タンパク質の輝度が高く、高解像観察に適し ているという特長がある。
■論文情報
タイトル: Bright multicolor labeling of neuronal circuits with fluorescent proteins and chemical tags (蛍光タンパク質およびケミカルタグを用いた神経回路の高輝度マルチカラー標識)
著者: 坂口理智、Marcus N. Leiwe、今井 猛
掲載誌: eLife DOI: https://doi.org/10.7554/eLife.40350
■動画(YouTube へリンク)
[動画 1] 僧帽細胞の樹状突起配線の様子を Tetbow で可視化
[動画 2] 僧帽細胞の軸索投射の様子を Tetbow で可視化
[動画 3] Tetbow で可視化したマウス大脳皮質の神経回路
[動画 4] Tetbow で可視化された大脳皮質の樹状突起
[動画 1-4]再生リスト
【報道に関するお問い合わせ】
九州大学広報室
理化学研究所 広報室
【AMED 事業について】
日本医療研究開発機構 脳と心の研究課
(図 2) Tetbow 法の原理。従来の多色標識法は CAG プロモーターがよく用いられていた。この場合、蛍光タン パク質遺伝子をたくさん導入すると、赤(tdTomato)、緑(EYFP)、青(mTurquoise2)とも同程度光るため、色が 似通ってしまう(白っぽくなる)。一方、導入する遺伝子の数を制限すると、色の多様性は作られるが、輝度が低 くなってしまう。Tetbow 法では、導入する遺伝子の数を制限しつつ、強力なプロモーター(テトラサイクリン応答 配列プロモーター)を用いることで、高輝度多色標識を実現した。大脳皮質 2/3 層ニューロンを子宮内エレクト ロポレーション法を用いて標識した実験。
(図 3) Tetbow 標識された大脳皮質
(図 4) Tetbow 標識された大脳皮質 2/3 層ニューロンの神経突起
(図 5) 僧帽細胞軸索の解析。数ミリメートルに亘って軸索を同定可能。軸索を同定後、異なる軸索を異なる色 で後付け。嗅皮質の異なる領域を示している。