第3世代ALK阻害薬耐性の克服を目指す
2019-01-30 がん研究会,京都大学,理化学研究所,日本医療研究開発機構
概要
ALK融合遺伝子(注1)をもつ肺がん(ALK陽性肺がん)は非小細胞肺がんの患者さんの3~5%程度に見つかるといわれています(日本では推定2000例/年)。ALK融合遺伝子とは受容体型チロシンキナーゼ(注2)をコードするALK遺伝子とEML4などの多量体化する機能を持つたんぱく質をコードする遺伝子が染色体の逆位や転座により融合することでできる強力ながん遺伝子です。ALK融合たんぱく質は、恒常的にALKチロシンキナーゼを活性化し、結果として細胞増殖シグナルを異常に活性化し続けることで細胞ががん化します。このALK陽性肺がんに対しては、ALKチロシンキナーゼを阻害する薬剤(ALK阻害薬、注3)が有効であることが実験的にまた臨床試験により明らかにされており、我が国では、これまでに4つのALK阻害薬が承認され臨床応用されています。これら4つのALK阻害薬の中で、ALK陽性肺がんに対する一次治療薬としては、現在のところ、アレクチニブが最も多く使用されていますが、治療後、数年以内にがん細胞が薬剤耐性化し、がんが再発してしまうことが問題となっています。これまでの研究からアレクチニブ耐性化機構としてALKの薬剤結合部位に存在するG1202R変異(1202番目のグリシン(G)がアルギニン(R)となる変異)やI1171N変異が比較的高頻度に発見されています。これらのアレクチニブ耐性変異に対しても有効な薬剤として期待されているのが、昨年9月に本邦で承認された第3世代ALK阻害薬ロルラチニブです。しかしながら、アレクチニブ耐性後にロルラチニブで逐次治療した後にも耐性が生じることが懸念されており、実際に米国のグループなどからは、ALK阻害薬逐次治療後の耐性機構として2つ以上の変異がALKに生じることが最近報告されました(重複変異)。しかし、それらの克服法はほとんど明らかになっていませんでした(図1)。

図1 本研究の目的
がん研究会の片山量平(がん研究会がん化学療法センター基礎研究部 部長)、岡田康太郎(東京大学大学院新領域創成科学研究科大学院博士課程)らの研究グループは、ALK陽性肺がんにおいて、アレクチニブ‐ロルラチニブ逐次治療後の耐性機構として新規ALK重複変異体を複数発見し、また、1塩基変異のみでロルラチニブ耐性を示すALK-L1256F変異を発見しました。これら耐性変異体の多くに対しては、既に臨床で使用されてきたALK阻害薬が再び効くようになること、一方でALK阻害薬全てに耐性を示した重複変異の1つは他のチロシンキナーゼABLを標的とする薬剤で克服が可能であることを実験的に証明しました。さらに京都大学の奥野恭史(京都大学大学院医学研究科 教授)、荒木望嗣(京都大学大学院医学研究科 准教授)らの研究グループとの共同研究により、スーパーコンピュータ「京」を用いて従来の耐性変異や今回発見された重複変異と各ALK阻害薬との結合自由エネルギーをMP-CAFEE法(注4)により算出したところ、実験的なデータとシミュレーションで求めた結合親和性に高い相関があることを確認し、in silicoにおける耐性変異予測の可能性を示すことに成功しました。
本研究の成果は、Lancet誌とCell誌が共同でサポートするオープンアクセス誌EBioMedicineに、2019年1月18日に公開されました。
ポイント
- ALK陽性肺がんにおいて、アレクチニブ耐性変異G1202R変異やI1171N変異後のロルラチニブ治療に耐性となるメカニズムとしてG1202RやI1171Nに新たに変異が蓄積する重複変異を多数発見しました。
- ロルラチニブ耐性を示すALK重複変異の大半が、既に臨床で使用されているALK阻害薬(クリゾチニブ、アレクチニブ、セリチニブ、brigatinib)に再感受性を示すこと、一方であらゆるALK阻害薬に耐性を示すG1202R+L1196M重複変異体は、ABLチロシンキナーゼ阻害剤のAG-957やAdaphostinに感受性を示すことを発見しました。
- ALKのL1256F単独変異がロルラチニブに高度耐性を示す一方で、アレクチニブに高感受性を示すことを発見し、スパコン「京」を用いた構造シミュレーションから結合親和性低下の理由の一端を明らかにしました。
- スパコン「京」を用いたMP-CAFEE法などのシミュレーションにより、ALK阻害薬とALK耐性変異体の結合親和性(結合自由エネルギー:ΔG)の算出に成功しました。算出したΔGは実際の薬剤感受性と高い相関関係を示し、シミュレーション精度の高さが示されました。
- 本研究から、様々なALK阻害薬耐性機構と耐性克服法の候補が示され、治療耐性時に耐性機構が明確にできると、そのメカニズムに合わせた更なる治療の可能性が示されました。将来的にはさらなるシミュレーションの予測精度向上により、コンピューター内で耐性変異と効果的な薬剤の予測が、可能となると期待されます。
論文名、著者およびその所属
- 論文名:Prediction of ALK Mutations Mediating ALK-TKIs Resistance and Drug Re-purposing to Overcome the Resistance
- ジャーナル名:EBioMedicine (Cell誌とLancet誌が共同でサポートする新規オープンアクセス誌)
(※2019年1月18日にオンラインに掲載されました。) - 著者:Koutaroh Okada1,2, Mitsugu Araki3,4, Takuya Sakashita1, Biao Ma5, Ryo Kanada6, Noriko Yanagitani7, Atsushi Horiike7, Sumie Koike1, Tomoko Oh-hara1, Kana Watanabe8, Keiichi Tamai9, Makoto Maemondo8, Makoto Nishio7, Takeshi Ishikawa10, Yasushi Okuno3,4, Naoya Fujita1,2, Ryohei Katayama1*
* 責任著者 - 著者の所属機関:
-
- (公財)がん研究会 がん化学療法センター 基礎研究部
- 東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
- 理化学研究所 計算科学研究センター
- 京都大学大学院 医学研究科
- Research and Development Group for In Silico Drug Discovery, Pro-Cluster Kobe, Foundation for Biomedical Research and Innovation
- RIKEN Compass to Healthy Life Research Complex Program
- (公財)がん研究会 がん研有明病院 呼吸器内科
- 宮城県立がんセンター 呼吸器内科
- 宮城県立がんセンター 研究所 がん幹細胞研究部
- 長崎大学大学院 医歯薬学総合研究科
研究の詳細
背景と経緯
現在、わが国において肺がんは死亡率1位のがん腫であり、肺がんの約8割以上を占める非小細胞肺がんの3-5%にALK融合遺伝子が見つかります。このALK融合遺伝子は2007年に東京大学の間野博行博士らのグループにより、強力ながん遺伝子として肺がん患者から発見されました。ALKは、受容体型チロシンキナーゼと呼ばれるたんぱく質であり、細胞増殖を促進する機能を有しますが、正常組織ではその発現と活性化が厳密に制御されています。しかし、ALK融合遺伝子では、ALK遺伝子が、恒常的に発現し多量体化能をもつML4などの遺伝子と、染色体逆位や転座により融合遺伝子を形成することで、ALK融合たんぱく質が恒常的に発現すると共に多量体化を通じて異常に活性化し、がん化を強力に引き起こします。従って、ALKチロシンキナーゼを阻害することでALK陽性のがん細胞は増殖が抑制され顕著な腫瘍縮小効果が得られます。現在までに、我が国においては4つのALKチロシンキナーゼ阻害薬が承認され、実臨床で使用されています。最初にALK阻害薬として開発・承認された第1世代ALK阻害薬クリゾチニブに比べて、第2世代ALK阻害薬アレクチニブは、1次治療薬として比較する臨床試験においてクリゾチニブの2倍以上の長さの無増悪生存期間(PFS)を示したことから、現在ではアレクチニブがALK陽性肺がん患者の1次治療薬として使用されることが多くなっています。しかし、どれほど高い腫瘍縮小効果がみられても、治療開始から数年以内に耐性化してしまうことが臨床上、問題となっています。アレクチニブ耐性化機構の約半数において、ALKの薬剤結合部位近傍に変異が認められます。特に1202番目のグリシン(G)がアルギニン(R)に変異するG1202R変異や、1171番目のイソロイシン(I)がアスパラギン(N)に変異するI1171N変異が高頻度で出現することが報告されています。現在、これら変異に対する耐性克服薬としては、昨年、我が国が世界に先駆けて臨床承認した第3世代ALK阻害薬ロルラチニブがあります。ロルラチニブはこれらの変異を有するALK肺がん症例にも有効であることが実験室レベルでも臨床試験においても示されています。しかしながら、アレクチニブ耐性後にロルラチニブで逐次治療した後にも耐性が生じることが懸念されており、実際に米国のグループなどからは、逐次治療後の耐性機構として2つ以上の変異がALKに生じ(重複変異)、ロルラチニブに耐性となることが報告されました。しかし、アレクチニブ-ロルラチニブ逐次治療の耐性機構の詳細とそれらの耐性克服法はほとんど明らかになっていません。
がん研究会の片山量平(がん研究会がん化学療法センター基礎研究部 部長)、岡田康太郎(東京大学大学院新領域創成科学研究科大学院博士課程)らの研究グループはアレクチニブ耐性を示すG1202R変異やI1171N変異後のロルラチニブ治療に耐性となるメカニズムとしてG1202RやI1171Nに新たに変異が蓄積する重複変異を複数発見しました。そして、その克服法を探索し、これら重複変異の大半が、既に臨床で使用されているALK阻害薬(クリゾチニブ、アレクチニブ、セリチニブ、brigatinib)に感受性を示すこと、一方であらゆるALK阻害薬に耐性を示すG1202R+L1196M重複変異体は、ABLチロシンキナーゼ阻害剤のAG-957やAdaphostinに感受性を示すことを発見しました。さらにはスーパーコンピュータ「京」を用いた分子動力学シミュレーションとMP-CAFEE法により、ALK阻害薬とALK耐性変異体の結合親和性(結合自由エネルギー:ΔG)の算出に成功しました。算出したΔGは実際の薬剤感受性と高い相関関係を示し、シミュレーション精度の高さが示されました。
研究内容
我々はまず、がん研有明病院において十分なインフォームド・コンセントを受けたALK陽性肺がん患者のアレクチニブ耐性腫瘍から培養細胞株の樹立を行うと共に、ALKの耐性変異の有無を確認しました。その結果、I1171N変異を有するJFCR-043細胞やG1202R変異を有するJFCR-041-2細胞の樹立に成功しました。培養細胞レベル(in vitro)、および動物実験レベルにおいて(in vivo)ロルラチニブはこれら2種の患者由来ALK融合遺伝子陽性がん細胞に有効であり、JFCR-043細胞は第2世代ALK阻害薬セリチニブに対しても感受性を示しました。次に、G1202R変異陽性のJFCR-041-2細胞を用いて、in vivoにおいてロルラチニブ耐性化機構を検討することにしました。JFCR-041-2細胞をマウスに移植し、ロルラチニブによる治療を開始し、長期間にわたり治療を継続した結果、ロルラチニブ耐性腫瘍を得ました。この腫瘍をシークエンス解析したところ、G1202R変異にG1269A変異が蓄積した、G1202R+G1269A重複変異を発見しました(図2)。
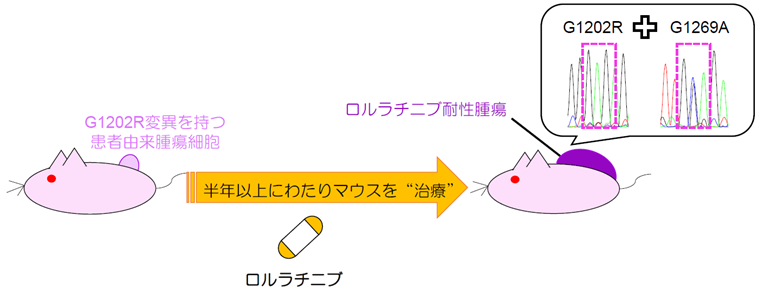
図2 ロルラチニブ耐性腫瘍の樹立
ALK阻害薬耐性機構の約半数がALK薬剤結合部位近傍の変異が原因であることが、これまでに様々な研究から示されています。そこで、我々は、IL-3依存的に増殖するマウス前駆Bリンパ球(Ba/F3細胞株)に、EML4-ALK(野生型、G1202RまたはI1171N変異型)を遺伝子導入することで、IL-3に依存せずにEML4-ALKに依存して生存・増殖するBa/F3細胞を作製しました。この細胞にENUと呼ばれる遺伝子変異を人為的に多数導入できるDNAアルキル化剤を処理し、ロルラチニブ存在下で培養することにより耐性獲得細胞のスクリーニングを行いました。約3週間の培養ののちに生存してきた変異導入Ba/F3細胞のALK融合遺伝子をシーケンス解析した結果、G1202R+L1196M重複変異やI1171N+L1256F重複変異等のロルラチニブ耐性重複変異を13種発見しました。これらの重複変異を有するBa/F3細胞の半数以上は、驚いたことに既に我が国で使用されているALK阻害薬(または現在本邦では臨床試験中で、米国では承認されたALK阻害薬)で克服可能であることを見出しました。特に、I1171N+L1256F重複変異は、I1171N単独変異がアレクチニブに高度な耐性を示す一方で、L1256F変異が付加することでアレクチニブに再感受性化を示しました。一方で、G1202R+L1196M重複変異は全てのALK阻害薬に耐性を示したため、標的がはっきりしている低分子化合物からなる約300の薬剤ライブラリーを用いてG1202R+L1196M変異にも有効な候補薬剤のスクリーニングを実施したところ、慢性骨髄性白血病の原因遺伝子の1つとして知られるBCR-ABLチロシンキナーゼに対して阻害活性を持つAG-957と、その構造類縁体Adaphostinがこの重複変異体に選択的に有効であることを見出しました。これらの結果は、ALK阻害薬による再治療がロルラチニブ耐性後の治療法として一部の患者では有効性を示す可能性があること、近年注目されている「ドラックリパーパシング(既存薬再開発)」により耐性克服薬が思いがけず発見できる可能性を示唆しています(図3)。
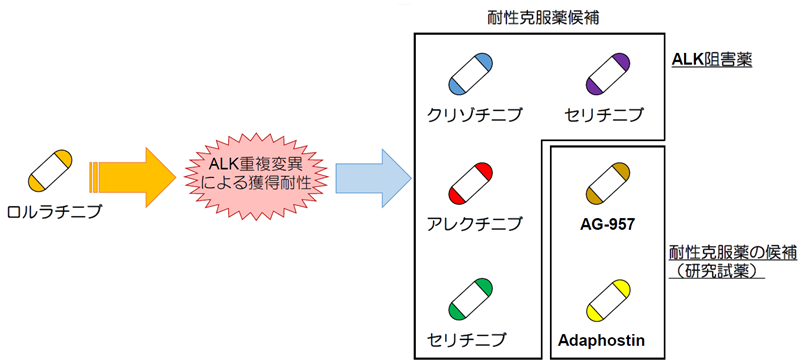
図3 ALK重複変異とその克服薬候補の発見
L1256F変異自体はこれまでに報告の無いALK阻害薬耐性変異であったため、我々は次にL1256F単独変異がロルラチニブ耐性を付与するかどうか検討したところ、ロルラチニブに高度耐性を付与する一方でアレクチニブには高感受性であることを発見しました。さらに、スーパーコンピュータ「京」を用いたタンパク質構造シミュレーションを実施することで、L1256Fが立体障害となり、ロルラチニブが薬剤結合ポケットから押し出されるようになることが示されると共に、新たに量子化学も駆使した構造シミュレーションにより、アレクチニブに高感受性化する理由の一端を明らかにしました(図4)。
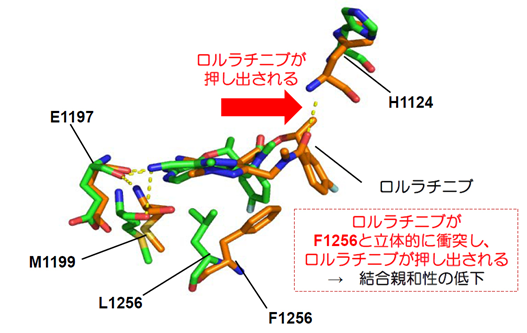
図4 ALK-L1256Fがロルラチニブ耐性となる理由
(スパコン京を用いた構造シミュレーション)
さらにALK阻害薬耐性変異による薬剤の結合親和性低下をコンピュータシミュレーションで描写し、将来的には耐性変異と耐性克服薬を予測できるようにすることを目指し、分子動力学シミュレーションとMP-CAFEE法を駆使し、既報のALK阻害薬耐性変異と各ALK阻害薬との結合自由エネルギー(ΔG)を算出したところ、各変異型EML4-ALKを発現するBa/F3細胞株の薬剤感受性データ(IC50値)とΔGが高い相関を示す結果を得ることに成功しました。しかしながら、I1171N+L1256F重複変異などでは、MP-CAFEE法によりアレクチニブ再感受性化をシミュレーションから見出すことはできませんでした。しかし、芳香環のπ電子を介した相互作用の寄与をも考慮することのできる量子化学計算(FMO法)を取り入れることにより、L1256F変異の導入がアレクチニブへの感受性を増す理由の一端を明らかにすることができました (図5)。
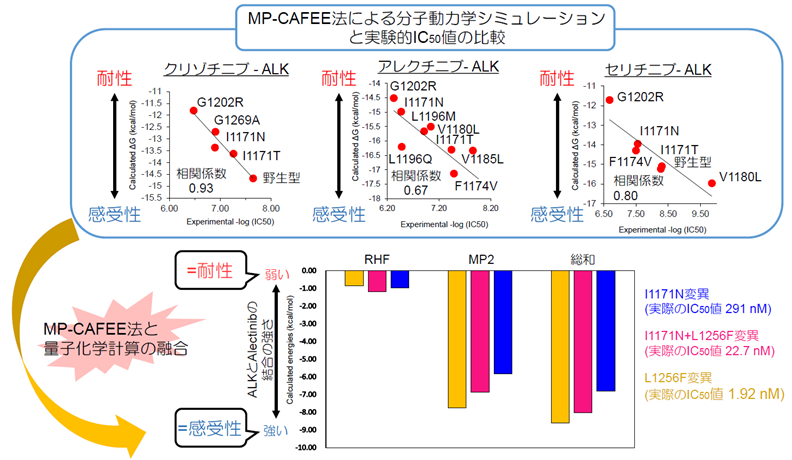
図5 MP-CAFEE法によるALK阻害薬耐性変異予測
本研究により、ロルラチニブ耐性機構として様々なALK重複変異を発見し、その克服法の候補を新たに発見したわけですが、これまでのALK阻害薬耐性機構としてALK自身の変異以外にもALK以外のチロシンキナーゼの活性化(バイパス経路活性化)や薬剤排出トランスポーターの発現上昇など様々な耐性機構の報告があるので、耐性変異外にも引き続きロルラチニブ耐性化機構とその克服法を明確にしていくことも重要な課題です。
研究のインパクトおよび今後の展開
アレクチニブは現在、我が国において、ALK陽性進行肺がんの1次治療薬として広く使用されるようになっており、2018年にロルラチニブが承認されたことを鑑みると、今後、G1202R変異やI1171N変異によりアレクチニブ耐性となった患者にロルラチニブが使用され耐性となる症例が少なからず出てくることが予想されます。そのため、ロルラチニブ耐性機構とその後の克服法を明らかにしていくことは非常に重要です。さらに、今回のコンピュータシミュレーションの精度をより高くし、ALK融合たんぱく質のみならず他のがん遺伝子産物と阻害薬にも適応できるようになると、飛躍的に耐性予測と効果的薬剤の探索が可能になると期待されます。
本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)
「異分野先端技術融合による薬剤抵抗性を標的とした革新的複合治療戦略の開発」 - 独立行政法人日本学術振興会 科学研究費補助金
- 公益財団法人車両競技公益資金記念財団
- 文部科学省 ポスト「京」で重点的に取り組むべき社会的・科学的課題に関するアプリケーション開発・研究開発 重点課題1(課題責任者 奥野恭史 教授)
- 本論文の一部は、理化学研究所のスーパーコンピュータ「京」を利用して得られたものです。
(課題番号: hp160213, hp150272, hp170275, hp180186, ra000018)
用語解説
- (注1)ALK融合遺伝子
- 通常、細胞膜上に発現するチロシンキナーゼ受容体であり、胚発生時の神経システムの発達に関わっています。増殖因子が結合すると2量体化を形成後、活性化し、細胞増殖シグナルを活性化することで、細胞を生存・増殖させます。しかしながら、ALK融合遺伝子陽性肺がん細胞においてはALK遺伝子が他の遺伝子と染色体逆位や転座により融合遺伝子を形成することで、恒常的に活性化し、がん化を誘導します。そのため、臨床ではALK融合タンパク質の働きを抑制することができるALK阻害薬が使用されています。
- (注2)チロシンキナーゼ
- キナーゼとは基質をリン酸化する酵素の総称であり、そのうちチロシンキナーゼは基質タンパク質のチロシン残基をリン酸化する酵素のことです。一般にその活性化は私たちの細胞の増殖を正に誘導します。
- (注3)ALK阻害薬
- 現在、我が国においては、クリゾチニブ、アレクチニブ、セリチニブが1次治療やそれ以降の治療において使用することができ、昨年、ロルラチニブが世界に先駆けて我が国で臨床承認されました。また、現在はbrigatinibがALK融合遺伝子陽性肺がんに対して第Ⅲ相臨床試験中です。
- (注4)MP-CAFEE法
- 東京大学の藤谷秀章博士らが開発したコンピュータシミュレーションによりたんぱく質とリガンド(阻害薬など)の結合親和性(結合自由エネルギー)を高精度に計算する方法です。Massively Parallel Computation of Absolute biding Free Energy methodの略。 計算量が膨大であり、スパコン「京」のような大規模並列計算が可能なスーパーコンピュータが必要です。
お問い合わせ先
本研究に関すること
公益財団法人がん研究会 がん化学療法センター 基礎研究部
片山量平
取材等に関すること
公益財団法人がん研究会 広報部
がん対策全般についてのお問い合わせ
厚生労働省健康局 がん・疾病対策課
次世代がん医療創生研究事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED) 戦略推進部 がん研究課