2019-05-21 大阪大学,日本医療研究開発機構
本研究成果のポイント
- パーキンソン病※1の発症に関わるタンパク質のαシヌクレイン※2の蓄積を抑制する核酸医薬※3を新たに開発
- これまで病気の発症・進行を抑制する根本的な治療法は存在せず、治療法開発に新展開をもたらす成果
- パーキンソン病だけでなく、αシヌクレインの蓄積が原因である認知症の治療への応用にも期待
概要
大阪大学大学院医学系研究科の望月秀樹教授(神経内科学)らの研究グループは、同大学院薬学研究科創薬センター、東京医科歯科大学脳神経病態学らのグループと共同研究で、遺伝性パーキンソン病※4の原因であるαシヌクレインタンパク質の蓄積を抑制する核酸医薬を新たに開発し、パーキンソン病の症状を改善することを動物モデルにおいて証明しました。今回開発した核酸医薬は、生体内での安定性が高く、αシヌクレイン遺伝子に特異的に結合し分解することでタンパク質の蓄積を抑制します(図1)。
これまで、パーキンソン病の発症や進行を遅らせる根本的治療法は確立していませんでしたが、本研究グループの研究成果および研究手法が、今後のパーキンソン病の画期的な治療法になるものと期待されます。
なお、本研究成果は英国科学雑誌「Scientific Reports」に、5月21日(火)18時(日本時間)に公開されます。
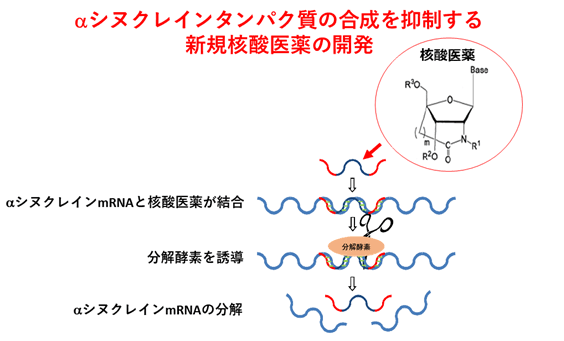
図1:新規核酸医薬
αシヌクレイン遺伝子を断片化して、タンパク質の合成を抑制
研究の背景
パーキンソン病は世界で約1千万人の人々が罹患している神経疾患で、日本では1000人に1~1.5人、60歳以上では100人に1人が発症していると言われています。しかしながら、パーキンソン病に対して、ドパミン製剤など症状を改善する治療薬は存在しますが、進行を抑制する根本的な治療法は存在しません。そのため、寝たきりの原因となるなど、大きな社会問題になっています。全世界でパーキンソン病の進行を抑制する治療法の開発が期待されています(図2)。
パーキンソン病は神経細胞にαシヌクレインタンパク質が蓄積することで発症すると考えられています。望月教授らの研究グループでは、遺伝性パーキンソン病の原因遺伝子であるαシヌクレイン遺伝子をターゲットとする核酸医薬を開発し、αシヌクレインタンパク質の蓄積を抑制することを目的としました。
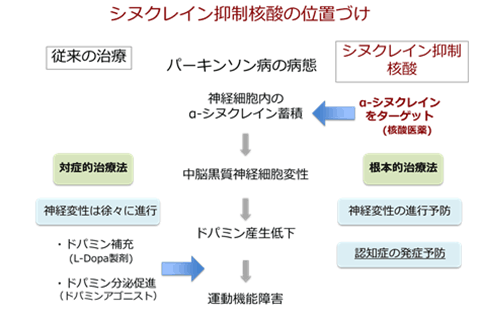
図2:パーキンソン病の従来の治療法とシヌクレイン抑制核酸の比較
今回の成果
今回、望月教授らの研究グループは、パーキンソン病の原因であるαシヌクレインタンパク質の蓄積を抑制するため、αシヌクレインのタンパク質の合成を阻害する核酸医薬を開発しました。通常、核酸は細胞外では速やかに分解されますが、今回開発した核酸医薬は核酸を人工的に修飾することで生体内での安定性を獲得しました。パーキンソン病モデルマウスを用いてこの薬剤の有効性を調べたところ、αシヌクレインの蓄積を抑制し、本来パーキンソン病モデルマウスに見られる行動障害を改善することを確認しました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果は臨床での投与法に近い方法で効果を発揮することから、遺伝性パーキンソン病や孤発性パーキンソン病の有効な治療法として大変期待されます。また、異常シヌクレインの蓄積によって生じることが知られている、レヴィー小体型認知症や多系統萎縮症認知症などの神経疾患への応用も期待されます。
用語解説
- ※1 パーキンソン病
- 手足のふるえ、動きの鈍さ、体のこわばり、転びやすさを主な運動症状とする進行性の神経変性疾患である。
- ※2 αシヌクレイン
- 神経細胞内に存在するタンパク質で、機能は不明である。αシヌクレインが異常に蓄積することでパーキンソン病を引き起こすと考えられている。αシヌクレインの異常な蓄積は、パーキンソン病だけでなく、認知症などの幅広い神経疾患も引きおこすとされている。
- ※3 核酸医薬
- デオキシリボ核酸(DNA)やリボ核酸(RNA)が連なっており、特定の遺伝子に直接結合し、標的遺伝子を分解することで、タンパク質の合成を抑え、病気の発症を抑制する作用をもつ。こうした形状をもつ核酸医薬は、ハンチントン病や筋強直性ジストロフィーなど、ほかの神経筋疾患への治療応用が進んでいる。
- ※4 遺伝性パーキンソン病
- パーキンソン病はおよそ90%が孤発性パーキンソン病で、残りの10%が遺伝性パーキンソン病とされている。遺伝性パーキンソン病の一つに、シヌクレイン遺伝子の重複が認められるPARK4が存在する。過剰に産生されたαシヌクレイン蛋白質が蓄積・凝集することがパーキンソン病の原因とされている(図3)。
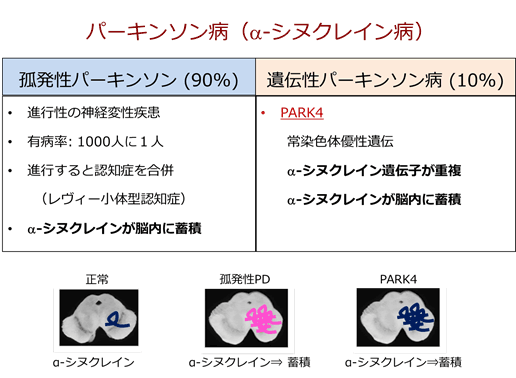
図3:孤発性パーキンソン病と遺伝性パーキンソン病
どちらもαシヌクレインの神経細胞内への蓄積が発症と進行に関与
特記事項
本研究成果は、2019年5月21日(火)18時(日本時間)に米国科学誌「Scentific Reports」(オンライン)に掲載されます。
- タイトル
- “Amido-bridged nucleic acid (AmNA)-modified antisense oligonucleotides targeting α-synuclein as a novel therapy for Parkinson’s disease”
- 著者名
- Takuya Uehara1, Chi-Jing Choong1, Masayuki Nakamori1, Hideki Hayakawa1, Kumiko Nishiyama1, Yuuya Kasahara2,4, Kousuke Baba1, Tetsuya Nagata3, Takanori Yokota3, Hiroshi Tsuda1, Satoshi Obika2,4 & Hideki Mochizuki1
- 所属
-
- 大阪大学 大学院医学系研究科 神経内科学
- 国立研究開発法人医薬基盤・健康・栄養研究所
- 東京医科歯科大学 脳神経病態学
- 大阪大学 大学院薬学研究科 創薬センター
本研究は、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業(研究開発課題:シヌクレイン抑制AmNA核酸によるパーキンソン病の治療研究)の一環として行われました。
お問い合わせ先
研究に関すること
望月 秀樹(もちづき ひでき)
大阪大学大学院 医学系研究科 神経内科学 教授
報道に関すること
大阪大学医学系研究科 広報室
AMED事業に関するお問い合わせ先
日本医療研究開発機構 戦略推進部 難病研究課