2019-07-09 京都大学ips細胞研究所
ポイント
- マウス胎生期膵臓形成に必須の転写因子Pdx1は成体膵外分泌細胞のミトコンドリア機能維持に必要であることを見出した。
- 成体膵外分泌細胞でPdx1を不活化すると細胞老化(注1)に陥るが、周囲の正常細胞の増殖が刺激され、組織恒常性が保たれる。
- これまで注目されてこなかった成体膵外分泌組織でのPdx1機能が明らかとなり、成体膵臓の機能的恒常性維持や臓器老化の理解が深まった。
1. 要旨
堀口雅史客員研究生(CiRA未来生命科学研究部門、京都大学医学研究科)、吉田昌弘研究生(CiRA同部門、京都大学医学研究科)および川口義弥教授(CiRA同部門)らの研究グループは、胎生期膵臓形成に必須の遺伝子Pdx1が、成体膵外分泌細胞のミトコンドリア機能を維持し、細胞老化を阻害していることを見出しました。薬剤を用いて成体膵外分泌組織の半分でPdx1を不活すると、Pdx1不活化細胞はミトコンドリア障害を介した細胞老化に陥って増殖を停止しますが、同時に周囲の正常細胞の増殖が刺激されることで組織恒常性が保たれることがわかりました。本研究により、これまで不明であった成体膵外分泌組織でのPdx1機能が解明されました。
この研究成果は、2019年6月30日(独国時間)に独科学誌「FEBS Letters」で公開されました。
2. 研究の背景
膵臓は、消化酵素を分泌する外分泌組織と、血糖調節を担うホルモンを血液中に放出する内分泌組織(膵島)の2種類の組織で構成され、外分泌組織が全体の約95%を占めます。これまで、転写因子Pdx1は、胎生期の膵臓形成において外分泌・内分泌組織両方の形成に必須で、成体になると内分泌インスリン産生細胞でインスリンやグルコキナーゼ、グルコーストランスポーター2などの血糖調節に重要な遺伝子群の発現調整をすることが知られていましたが、成体外分泌組織でのPdx1の働きはよく分かっていませんでした。
3. 研究結果
本研究では、薬剤を用いて成体外分泌細胞だけでPdx1をノックアウト(注2)させたマウス(Elastase-CreER;Pdx1cKOマウス(注3))を用いた解析を行いました。このマウスでは薬剤投与量を調整することで、Pdx1をノックアウトする細胞量を調整することが可能です。成体膵外分泌細胞の半分でPdx1をノックアウトしたところ、膵臓は肉眼的には全く異常を示しませんでした。
次に、Elastase-CreER;Pdx1cKO; ROSA-LacZマウスを用いて、Pdx1ノックアウトと細胞系譜解析法(Lineage tracing)(注4)の組み合わせを行いました。このマウスでは、薬剤によってPdx1がノックアウトされた細胞をX-Gal陽性、薬剤の影響を受けずにPdx1が保たれた細胞をX-Gal陰性として、顕微鏡下で両者を区別して観察することが可能になります。
成体膵外分泌細胞の半分でPdx1をノックアウトする条件で観察したところ、 薬剤投与1ヶ月後までは50%の細胞がX-Gal陽性でしたが、3ヶ月、6ヶ月と経過していくうちにX-Gal陽性細胞率が徐々に低下することを見出しました。この間、膵臓サイズに大きな変化なかったことから、Pdx1ノックアウト細胞が徐々に消失すると同時に、周囲の正常細胞の増殖が亢進していることで臓器恒常性が維持されていると考え、組織解析でそれを確認しました(図1)。
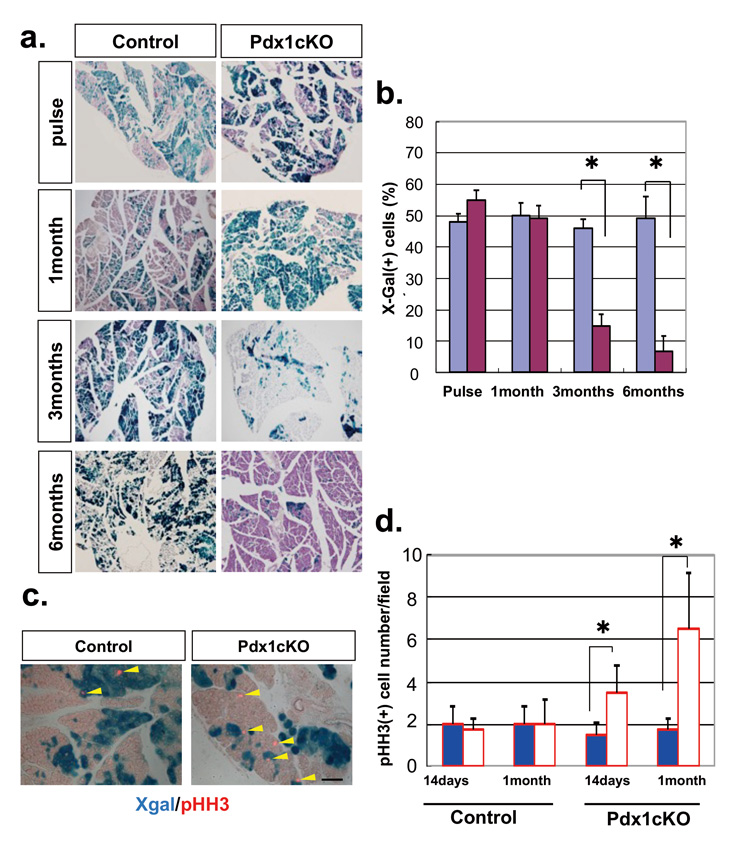
図1:Pdx1ノックアウト細胞は徐々に減ってゆくが、周囲の正常細胞の増殖が増える
細胞系譜解析法(Lineage tracing)実験結果:薬剤投与直後(pulse)からの経時的組織像(a)、X-Gal陽性細胞率の変化(b)。 1ヶ月時点ではX-Gal陽性細胞率は50%のままで変化ないが、その後減少してゆく。変異マウスではX-Gal陰性の正常細胞(白い細胞)でpHH3が発現しており、細胞増殖が活性化していることがわかる。
このような緩徐な細胞入れ替わり現象の背景に潜む細胞機構を理解するために、以下の観察を加えました。まず、電子顕微鏡の観察から、Pdx1ノックアウトされた外分泌細胞では、ミトコンドリアストレスと小胞体ストレスが起こっていることがわかりました(図2)。さらに、Pdx1ノックアウト細胞は、アポトーシス(注5)のような急激な細胞死をおこしているのではなく、細胞老化に陥っていることを見出しました。Elastase-CreER;Pdx1cKOマウスの膵臓では、免疫細胞が多く浸潤していることも判明し、老化細胞が免疫細胞によって徐々に除かれると考えられました(図3)。
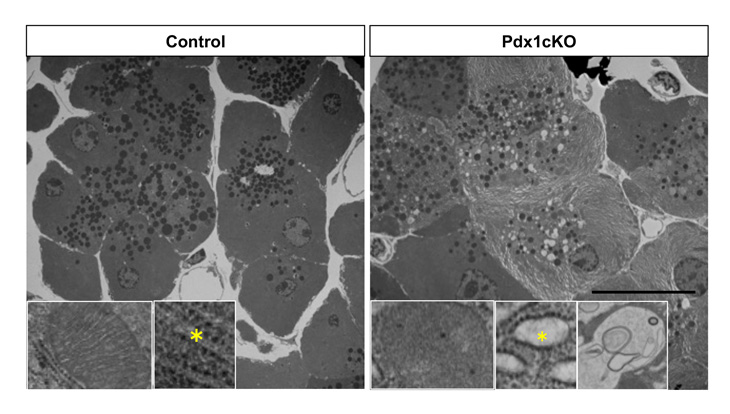
図2:電子顕微鏡所見
Pdx1ノックアウトされた外分泌細胞では、クリステが減少した丸い異常ミトコンドリア(挿入左)、小胞体内腔の拡張(挿入中:*)とオートファジー(挿入右)の増加を認め、ミトコンドリアストレス・小胞体ストレスを示している。
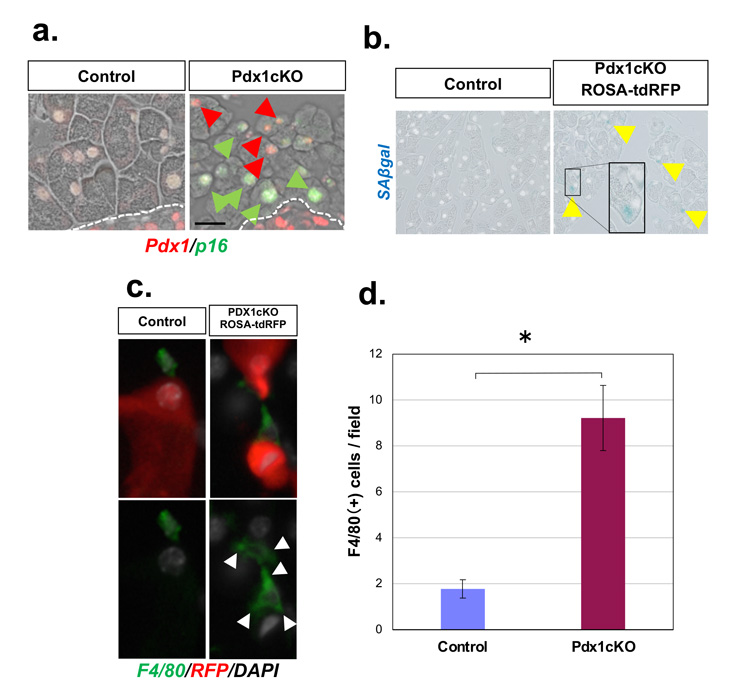
図3:Pdx1ノックアウト細胞の細胞老化と免疫細胞浸潤
Pdx1ノックアウト細胞はp16やSaβgalなどの細胞老化マーカー陽性となる(a,b)。Pdx1ノックアウト膵には多くの免疫細胞(c,dにはF4/80陽性マクロファージを示す)が浸潤している。
以上より、Pdx1ノックアウトによって引き起こされた細胞ストレスは細胞老化をきたし、自らは増殖周期を停止させてしまうが、それと同時に老化細胞は何らかのSASP(注6)分子を介して周囲の正常細胞の増殖を促し、臓器恒常性を保とうとしていると考えられます(図4)。
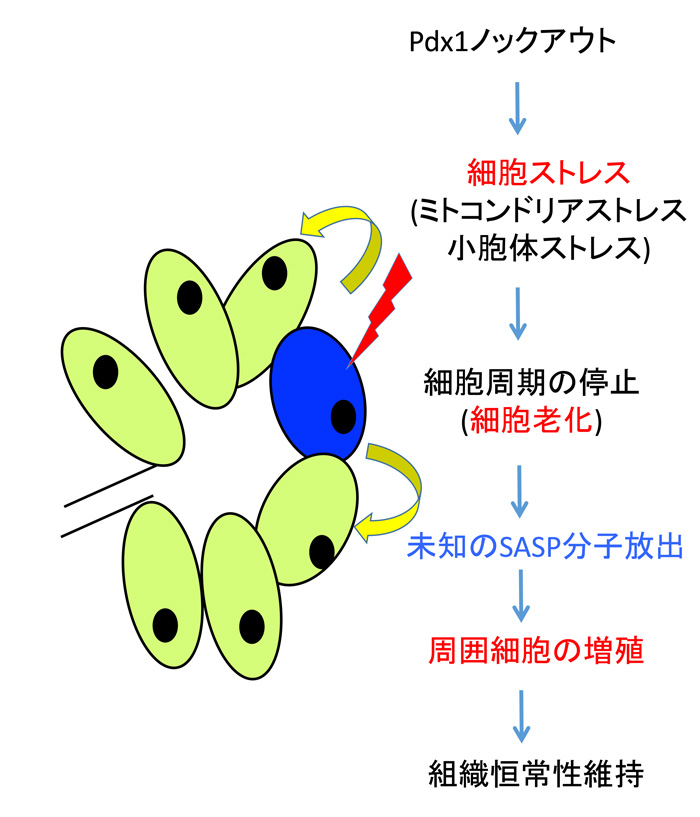
図4:想定される組織恒常性維持メカニズム
本実験モデルで膵臓サイズが保たれた背景には、老化細胞が未知のSASP分子を放出することで周囲の正常細胞の増殖が賦活したと想定される。
4. 本研究の意義と今後の展望
今回の研究は、これまでよく分かっていなかった成体膵外分泌組織におけるPdx1の機能を解明しました。研究グループはこれまでの研究で、胎生期膵臓形成においてPdx1と並んで必須の、もう一つの転写因子Ptf1aを成体でノックアウトすると、過大な小胞体ストレスを契機としたアポトーシスによって、膵臓が急激に小さくなることを見出しており(参考:2018年10月25日CiRAプレスリリース)、今回の現象とは全く結果が異なっています。つまり、胎生期臓器形成に重要な転写因子を成体臓器でノックアウトすることで生じる細胞ストレスの違いによって、アポトーシスによる急速な細胞除去、あるいは細胞老化を来たした後の免疫細胞によるゆっくりとした細胞除去の2通りの結末があるということになります。「成体はどのようにしてこの両者を使い分けているのか?」が今後の研究課題になります。
研究グループでは、「老化細胞は、自らがSASPを介して周囲細胞の増殖を促し、組織恒常性が保たれるのを見届けるまでは、組織に留まるのだろう」と考えて研究を続行しています。
5. 論文名と著者
- 論文名
“Senescence caused by inactivation of the homeodomain transcription factor Pdx1 in adult acinar cells in mice” - ジャーナル名
FEBS Letters - 著者
Masashi Horiguchi1,2*, Masahiro Yoshida1,2*, Koji Hirata1,2, Kenichiro Furuyama1,2, Toshihiko Masui1, Shinji Uemoto1 and Yoshiya Kawaguchi2**
* 筆頭著者、**責任著者 - 著者の所属機関
- 京都大学大学院医学研究科 肝胆膵・移植外科学教室
- 京都大学iPS細胞研究所(CiRA)
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会(JSPS)最先端・次世代研究開発支援プログラム(NEXT)
7. 用語説明
注1)細胞老化:Senescence
過度の細胞ストレスによって、細胞増殖周期を停止させてしまう現象。加齢によって増える現象として認識されていたが、近年では、個体の年齢とは関係なく、様々な細胞ストレスによって細胞老化をきたすことが分かってきている。
注2)ノックアウト
遺伝子の働かせないようにすること。
注3)Elastase-CreER;Pdx1cKOマウス
Pdx1は発生過程において、膵臓の内分泌細胞・外分泌細胞の形成に必須の遺伝子。Pdx1Elastase-CreER: Pdx1cKOマウスは、タモキシフェンという薬剤を投与することで、目的とする遺伝子を特定の細胞でのみノックアウトできるCreER/loxPシステムを利用して作製されたマウスで、エラスターゼ(消化酵素)をつくる外分泌細胞だけでCreERが活性化して、膵臓形成に必要なPdx1の発現を無くしてしまう。タモキシフェン投与量を調整することで、Pdx1をノックアウトできる外分泌細胞の数を調整することができる。
注4)細胞系譜解析法(Lineage tracing)
上記マウスとROSA-LacZマウスを交配することで得られたマウス(Elastase-CreER;Pdx1cKO; ROSA-LacZマウス)にタモキシフェンを投与することで、Pdx1ノックアウトされた細胞だけでLacZという酵素を発現させることができる。LacZの酵素反応(X-Gal染色)を利用して、Pdx1ノックアウト細胞をX-Gal陽性細胞として青く染色できる。
注5)アポトーシス
細胞死の1つで、細胞内の何らかの異常に反応して起こるプログラムされた細胞死。多くは急激な細胞死を示す。
注6)SASP (Senescence Associated Secretory Phenotype)
老化細胞が様々なタンパク質を放出して周囲の細胞に働きかける現象。組織再生や癌における細胞老化の役割が注目されている。