Slc38a4遺伝子の欠損は胎盤低形成・胎児発育遅延を引き起こす
2019-10-08 理化学研究所
理化学研究所(理研)バイオリソース研究センター遺伝工学基盤技術室の的場章悟専任研究員、小倉淳郎室長(開拓研究本部小倉発生遺伝工学研究室 主任研究員)らの共同研究グループ※は、マウスの胎盤・胎児の正常な発生に必要なアミノ酸トランスポーター(アミノ酸の細胞膜透過を担う膜タンパク質)を発見しました。
本研究成果は、ヒトを含むさまざまな哺乳動物で起こる子宮内発育遅延のモデルとして、病態の理解および治療法の開発に貢献すると期待できます。
哺乳類では、胎児の発生に必要なエネルギー源(糖・脂質・アミノ酸など)は全て、胎盤を介して母体から供給されていますが、その分子メカニズムはよく分かっていません。
今回、共同研究グループは、マウスを用いて胎盤でのアミノ酸供給に関わる遺伝子を探索し、SNAT4というアミノ酸トランスポーターをコードするSlc38a4遺伝子が胎盤・胎児の発生に必須であることを発見しました。Slc38a4は父方由来の遺伝子座から発現するインプリント遺伝子[1]であり、その父方遺伝子座をノックアウトすると、胎盤のサイズが3~4割ほど小さくなり、胎児は重篤な発育不全を示しました。Slc38a4/SNAT4はヒトを含むさまざまな哺乳動物でも胎盤に発現していることから、マウスと同様に他の動物種でも胎盤・胎児の発生に重要な機能を持っている可能性があります。
本研究は、米国の科学雑誌『Proceedings of the National Academy of Sciences (PNAS)』のオンライン版(9月30日付け)に掲載されました。
背景
哺乳類の胎盤は、胚発生を支えるさまざまな機能を持っています。胎盤の機能の中でも特に重要なのは、母体-胎児間の血流を介して栄養やガス、老廃物などのやりとりをし、胎児が正常に発生できる環境を用意することです。胎盤の機能不全があると、胚の発生に悪影響を及ぼし、結果として子宮内発育遅延(Intrauterine growth restriction; IUGR)や流産などを引き起こします。さらに最近の研究では、胎児期の栄養環境が悪化すると、胎児の全身での代謝プログラムが変化してしまい、生後も長期にわたって健康状態に悪影響を及ぼす可能性が示唆されています。そのような重要性にもかかわらず、胎盤の機能、特に母体から胎児への栄養供給(図1)に関わる分子メカニズムはほとんど解析されていませんでした。
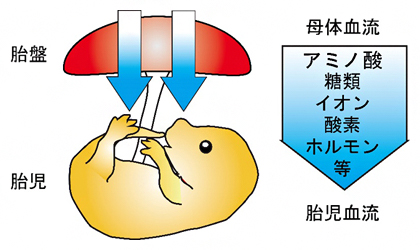
図1 胎盤を介した母体血流から胎児血流への物質供給
哺乳類の胎児は、発生に必要なさまざまな物質(アミノ酸・糖類・イオン・酸素・ホルモンなど)を、母体血流から胎盤を介して受け取っている。
母体から胎児に供給される栄養源には糖、脂質、アミノ酸などが含まれ、特にアミノ酸はタンパク質合成の素材となることから、胚発生に重要な要素であると考えられます。実際に、例えばヒトの胎盤では、20種類ものアミノ酸トランスポーター(アミノ酸の細胞膜透過を担う膜タンパク質)が発現しています。その中でもシステムAアミノ酸トランスポーターは、ナトリウムイオン依存的に比較的小型の中性アミノ酸(アラニン、セリン、グルタミンなど)を輸送するという特徴を持ち、Small Neutral Amino acid Transporter(SNAT)と呼ばれるタンパク質3種類(SNAT1、SNAT2、SNAT4)が存在します。SNAT1はSlc38a1遺伝子、SNAT2はSlc38a2遺伝子、SNAT4はSlc38a4遺伝子にそれぞれコードされており、これらは哺乳類で広く保存されています。
これまで主にヒトの胎盤由来の細胞を用いた研究において、システムAアミノ酸トランスポーターの活性と胎盤の機能および胎児の正常性との間に相関が見られたことから、システムAアミノ酸トランスポーターが胎盤の形成や胎児の発生機能に重要な役割を果たすことが示唆されてきました。しかし、個体レベルで遺伝子の機能を解析した報告はありませんでした。そこで、共同研究グループはマウスを用いて、SNATファミリー遺伝子(Slc38a1、Slc38a2、Slc38a4)の機能の遺伝的解析を試みました。
研究手法と成果
共同研究グループはまず、SNATファミリー遺伝子(Slc38a1、Slc38a2、Slc38a4)のさまざまなマウス組織における発現を解析した結果、三つの遺伝子は全て、胎盤で高いレベルで発現していることが分かりました。そこで、Triple-target CRISPR法[2]によって3種類のSNATファミリー遺伝子をそれぞれノックアウトしたマウスを作製して、胎盤への影響をスクリーニングしました(図2)。その結果、Slc38a4をノックアウトした場合のみ、出生時の胎盤の重量がコントロール群と比べて30%ほど減少しました。さらに、Slc38a4ノックアウトマウスでは出生時の産仔重量も25%ほど減少し、出生直後に7割以上の産仔が死亡しました。これらの結果から、SNATファミリー遺伝子の中でもSlc38a4が胎盤の形成および胎児の発生に重要な機能を持つことが分かりました。
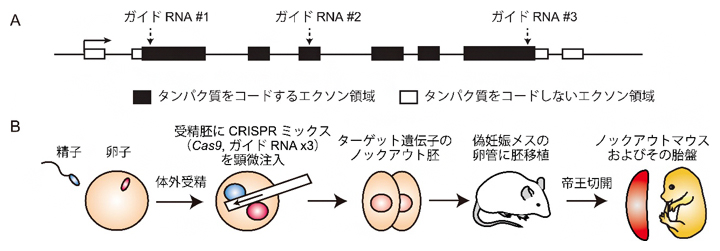
図2 Triple-target CRISPR法によるノックアウトマウスの作製
(A)ガイドRNAのデザイン法。ターゲット遺伝子を構成するエクソンのうち、タンパク質をコードする領域に対して3種類の異なるガイドRNAをデザインする。
(B)ノックアウトマウスの作出法。体外受精した1細胞期の受精胚にCRISPRミックス(Cas9 mRNAと3種類のガイドRNA)を顕微注入することで、ターゲット遺伝子にさまざまな変異を導入し、遺伝子の機能をほぼ100%の確率で阻害できる。こうして作製したノックアウト胚は、2細胞期に偽妊娠メスマウスに胚移植し、その後ノックアウトマウスとして生まれる。出生の際に自然分娩ではなく帝王切開にすることで、ノックアウトマウスの胎盤も同時に解析できる。
次に、詳細な発生プロセスを解析するために、Triple-target CRISPR法で生まれた様々な変異をもつ産仔の中からSlc38a4遺伝子領域をほぼ全て欠失しているノックアウトマウスを選び、ラインを樹立して解析を進めました。
まず、マウスのSlc38a4は父方遺伝子座から発現するインプリント遺伝子であるため、父方遺伝子座を欠損した(母方遺伝子座は正常)ヘテロ胚を作製したところ、ホモでのノックアウト胚と同様の胎盤低形成・胎児発育遅延の表現型を示しました。また、胎盤形成途中の変化を経時的に観察すると、Slc38a4ノックアウト胚で見られる胎盤の低形成は、胎盤形成中期頃から認められるのに対し、胎児の発生遅延は比較的後期から起きることから、胎盤の機能不全が原因で胎児が発生異常を示す可能性が考えられました。そこで、免疫染色法[3]によって、正常マウス胚の胎盤形成過程でのSNAT4タンパク質の局在を見ると、胎盤形成初期の絨毛膜領域(未分化な胎盤幹細胞が多く存在する領域)で強く発現しており、ノックアウト胚ではこの領域の細胞分裂頻度が低下していました。したがって、この細胞分裂頻度の低下がノックアウト胚で認められる胎盤低形成の原因だと考えられます。
一方で、正常マウスでSNAT4タンパク質の局在を見ると、胎盤形成中期以降は母体-胎児間の栄養交換を行うラビリンス層の栄養膜細胞でも発現していました。そこでSlc38a4ノックアウト胚では母体から胎児へのアミノ酸供給に異常があるのではないかと考え、胎児血漿のメタボローム解析[4]を行いました。その結果、Slc38a4ノックアウト胚では、SNAT4のトランスポートターゲットであるグルタミンなどを含む多くのアミノ酸の血中濃度が著しく低下していました。また、SNAT4は同じSNATファミリーに属するSNAT1やSNAT2と異なり、ヒスチジンなどのカチオン性アミノ酸もトランスポートするという特徴がありますが、実際にSlc38a4ノックアウトマウスの胎児血漿では、ヒスチジン濃度が大幅に低下していました。以上の結果から、SNAT4は母体から胎児へのアミノ酸の供給において重要な機能を持つことが強く示唆されました(図3)。
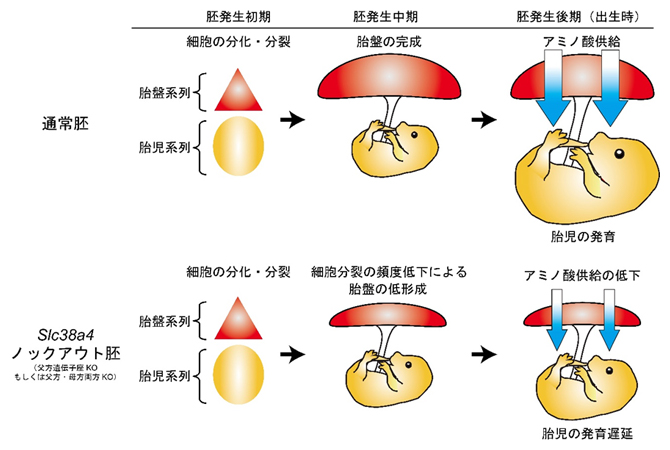
図3 胎盤の低形成および胎児の発育遅延を引き起こすSlc38a4遺伝子のノックアウト
正常な胚の発生過程(上段)では、発生初期に胎盤系列と胎児系列の細胞が分化し、さらに詳細な分化・分裂によって発生中期には胎盤が完成する。その後胎盤からのアミノ酸を含むさまざまな物質供給によって胎児は急激に発育し、出生に至る。一方で、アミノ酸トランスポーターSNAT4をコードするSlc38a4遺伝子のノックアウト(父方遺伝子座ノックアウト、もしくは父方・母方両方の遺伝子座のノックアウト)胚では、初期の胎盤・胎児系列の分化は正常に起こるものの、その後の胎盤での細胞分裂頻度が低下し、発生中期の段階で胎盤は正常の約6~7割のサイズしかない。さらに、後期には胎盤におけるアミノ酸供給が低下し、胎児は発育遅延により正常の約6~7割のサイズで生まれる。
今後の期待
本研究では、SNAT4がマウスの胎盤形成および胚発生において重要な機能を持つことを示しました。Slc38a4/SNAT4はヒトを含めた他の哺乳動物種の胎盤でも発現しているため、他の動物でも同様の機能を持つのか検証する必要があります。一方で、Slc38a4ノックアウトマウスは子宮内発育遅延(IUGR)の良いモデルとなるため、本マウスを利用して、IUGRの病態の理解や治療法の開発にもつながる可能性があります。
また、今後はSlc38a4と同じSNATファミリー遺伝子であるSlc38a1やSlc38a2も含め、他のアミノ酸トランスポーターが胎盤でどのような機能を持つのかさらに広く解析することで、母体から胎児へのアミノ酸供給メカニズムを包括的に理解されるものと期待できます。
補足説明
1.インプリント遺伝子
哺乳類のゲノムは父親と母親から半分ずつ染色体が引き継がれ、各染色体上に乗っている遺伝子を、父方遺伝子座、母方遺伝子座と呼ぶ。多くの遺伝子では父方・母方遺伝子座にかかわらず遺伝子の発現制御は同じだが、一部の遺伝子は「ゲノム刷り込み(ゲノムインプリンティング)」を受けており、父方遺伝子座からのみもしくは母方遺伝子座からのみ発現する。これらの遺伝子は「インプリント遺伝子」と呼ばれる。
2.Triple-target CRISPR法
小さなRNAをガイドとして利用することで、ゲノム中の特定のDNA配列に二本鎖切断を引き起こすCRISPR技術の応用版。一つの遺伝子の配列の中に3カ所ガイドRNAを同時に用意し、それらを一緒に受精卵に注入することで、生まれた個体はほぼ100%の確率で父方・母方の遺伝子座両方をノックアウトできる。
3.免疫染色法
組織切片中の標的分子に対する抗体を使い、その組織内でのタンパク質の局在を可視化する手法。免疫組織化学染色法とも呼ばれる。
4.メタボローム解析
生体サンプル(組織・血液など)中に存在する糖やアミノ酸、脂肪酸などの代謝物を網羅的に検出する解析法。
共同研究グループ
理化学研究所 バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 的場 章悟(まとば しょうご)
特別研究員 三浦 健人(みうら けんと)
テクニカルスタッフII 廣瀬 美智子(ひろせ みちこ)
室長 小倉 淳郎(おぐら あつお)
(理化学研究所 開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
岩手大学 農学部 共同獣医学科
特別研究員 中牟田 祥子(なかむた しょうこ)
准教授 中牟田 信明(なかむた のぶあき)
山梨大学 生命科学研究院
助教 志浦 寛相(しうら ひろすけ)
教授 幸田 尚(こうだ たかし)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究A「エピゲノム編集による体細胞核移植法の改善(研究代表者:的場章悟)」、同新学術領域研究「Y染色体と性スペクトラム(研究代表者:的場章悟)」「マウス核移植技術の開発による正常クローン胚・胎盤の構築(研究代表者:小倉淳郎)」による支援を受けて行われました。
原論文情報
Shogo Matoba, Shoko Nakamuta, Kento Miura, Michiko Hirose, Hirosuke Shiura, Takashi Kohda, Nobuaki Nakamuta and Atsuo Ogura, “Paternal knockout of Slc38a4/SNAT4 causes placental hypoplasia associated with intrauterine growth restriction in mice”, Proceedings of the National Academy of Sciences of the United States of America, 10.1073/pnas.1907884116
発表者
理化学研究所
バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 的場 章悟(まとば しょうご)
室長 小倉 淳郎(おぐら あつお)
(理化学研究所 開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
報道担当
理化学研究所 広報室 報道担当


