2018-03-15 理化学研究所
要旨
理化学研究所(理研)脳科学総合研究センター神経遺伝研究チームの山川和弘チームリーダー、鈴木俊光研究員と宮本浩行研究員らの国際共同研究グループ※は、若年ミオクロニーてんかんの原因遺伝子「ICK」を発見しました。
若年ミオクロニーてんかん(Juvenile Myoclonic Epilepsy: JME)は、8~20歳で発症し、起床時に頻発するミオクロニー発作[1]や強直間代発作[2]などを特徴とする、最も発症頻度の高いてんかんの一つです。山川チームリーダーらは2004年に、JME原因遺伝子としてタンパク質ミオクロニン1をコードするEFHC1を報告しました注1)。EFHC1の変異はJME患者の2~4%注2)に見いだされますが、多くのJME患者の原因遺伝子は未同定のまま残されていました。
今回、国際共同研究グループは、多くの家系・患者の詳細な遺伝学的解析により腸管細胞キナーゼ[3]をコードするICK遺伝子に複数の疾患変異を発見しました。さらにこれらの変異が腸管細胞キナーゼの機能を阻害すること、Ick欠損マウスがてんかん様症状を引き起こすことなどを見いだしました。EFHC1と腸管細胞キナーゼはともに、微小管[4]を介した繊毛[5]や神経細胞増殖・分化・細胞死に関わる機能を持つことから、これらの異常が患者脳でみられる「微小異形成(microdysgenesis)[6]」やてんかん発症につながっていると考えられます。
本成果は、JMEの共通発症メカニズムを示すものであり、今後、発症メカニズムの理解、治療法の開発に大きく貢献すると期待できます。
本研究成果は、英国の科学雑誌『New England Journal of Medicine』に掲載されるのに先立ち、オンライン版(3月14日付け:日本時間3月15日)に掲載されます。
本研究は、文科省科学研究費補助金・基盤研究(A)「てんかんの新規発症機構の解明と治療法の開発」などの支援を受けて行なわれました。
注1)2004年7月19日プレスリリース「若年ミオクロニーてんかん原因遺伝子の発見」
Suzuki, T. et.al.,“Mutations in EFHC1 cause juvenile myoclonic epilepsy”Nature Genetics 36, 842-849 (2004).
注2)Bailey JN, et al. “EFHC1 variants in Juvenile Myoclonic Epilepsy: Reanalysis according to NHGRI and ACMG Guidelines for assigning disease causality”. Genet Med 19(2):144-156 (2017).
※国際共同研究グループ
理化学研究所 脳科学総合研究センター 神経遺伝研究チーム
チームリーダー 山川 和弘 (やまかわ かずひろ)
研究員 鈴木 俊光 (すずき としみつ)
研究員 宮本 浩行 (みやもと ひろゆき)
ベルギー国 リエージュ大学
教授 バーナード・レイケイ(Bernard Lakaye)
米国カリフォルニア大学 ロサンゼルス校
教授 アントニオ・デルガドエスクイタ(Antonio Delgado-Escueta)
福岡大学 医学部 小児科
教授 廣瀬 伸一 (ひろせ しんいち)
弘前大学 医学部 神経精神医学講座
名誉教授 兼子 直 (かねこ すなお)
静岡てんかん・神経医療センター
院長 井上 有史 (いのうえ ゆうし)
東京女子医科大学 小児科
教授 大澤 真木子(おおさわ まきこ)
教授 小国 弘量 (おぐに ひろかず)
つつじが丘こどもクリニック
院長 藤本 伸治 (ふじもと しんじ)
背景
てんかんは反復するてんかん性発作を特徴とし、世界全人口 の0.5〜1.0%が発症する頻度の高い神経疾患です注3)。てんかんには多数の種類があり、その多くに遺伝的背景が想定され、原因となる、もしくは発症に寄与する遺伝子も数百にのぼると予想されています。てんかん性発作のみを症状とし脳内病変のみられない比較的軽症の特発性てんかんが全体の7割を占め、運動障害・知能障害などを伴い、しばしば進行性でより重症の症候性てんかん[7]、潜因性てんかん[8]が残りの3割を占めます。特発性てんかんに分類される若年ミオクロニーてんかん(Juvenile Myoclonic Epilepsy: JME)は、8~20歳で発症し、起床時に頻発するミオクロニー発作や全身性の強直間代発作を特徴とする最も発症頻度の高い、優性遺伝形式[9]をとるてんかんで、特発性てんかんの20~25%を占めるとされています。しかし、JMEなどの特発性てんかんについては、これまで同定された原因遺伝子の数は多くなく、ほとんどの患者の原因遺伝子は未解明のままです。
山川チームリーダーらは2004年に、多くの家系を用いた遺伝的連鎖解析[10]によるJMEの原因遺伝子EFHC1の同定とEFHC1がコードするタンパク質ミオクロニン1の細胞死誘導効果注1)、2008年にミオクロニン1の出生前脈絡叢、出生後の脳室壁上衣細胞繊毛での発現注4)、2009年にEfhc1欠損マウスでのてんかん発症と上衣細胞繊毛運動低下注5)などを報告しました。EFHC1の変異はJME患者の2~4%に見いだされますが注2)、多くのJME患者の原因遺伝子は未同定のまま残されていました。
注3)Flest KM et al., “Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies”. Neurology 88:296-303 (2017).
注4)Suzuki T et al., “Sequential expression of Efhc1/myoclonin1 in choroid plexus and ependymal cell cilia”. Biochem Biophys Res Commun. 357:226-323(2008).
注5)2009年1月16日プレスリリース「てんかん原因遺伝子異常による発症をマウスで確認」
Suzuki T, et al., “Efhc1 deficiency causes spontaneous myoclonus and increased seizure susceptibility”. Hum Mol Genet 18: 1099-1109 (2009).
研究手法と成果
共同研究グループは、JME大家系の全ゲノムエクソーム解析[11]と相関解析、334家系での候補遺伝子解析などにより、原因遺伝子が存在する染色体候補領域を6番染色体p12領域に絞り込み、そこに存在し腸管細胞キナーゼをコードするICK遺伝子に複数の疾患変異を発見しました。それら変異はJME患者のおよそ7%に見いだされました。さらに共同研究グループは、これらの変異が神経前駆細胞の移動を阻害すること、Ick欠損マウスがイソフルラン(吸入麻酔薬)による麻酔の傾眠時に強直間代発作を引き起こすことなどを明らかにしました。
腸管細胞キナーゼは、キネシンスーパーファミリータンパク質Kif3a[12]や細胞内シグナル伝達に関与するキナーゼ[13]の一種であるmTOR制御タンパク質Raptorのリン酸化などを通して、細胞分裂時の微小管生成、細胞増殖に関わることが知られています。また、JME患者の脳内では大脳皮質前部などにおいて微小異形成と呼ばれる異常な組織学的変化が共通してみられることが知られていました。ミオクロニン1も同様に、微小管を介した繊毛や神経細胞増殖・分化 ・細胞死に関わる機能を持っています。このことから、これら遺伝子の異常が共通のメカニズムを通して、患者脳でみられる「微小異形成」やてんかん発症を引き起こしていると考えられました(図1)。
今後の期待
本成果は、最も発症頻度の高いてんかんであるJMEの原因遺伝子を新たに明らかにするとともに、JME共通の発症メカニズムを示しています。今後、更なる詳細なメカニズムの理解、治療法の開発に大きく寄与すると期待できます。
原論文情報
Bailey JN+, de Nijis L+, Bai D+, Suzuki T+, Miyamoto H, Tanaka M, Patterson C, Lin YC, Medina M, Alonso M, Seratossa J, Duron R, Nguyen V, Wight J, Martinez-Juarez I, Ochoa A, Jara-Prado A, Guilhoto L, Molina Y, Yacubian E, Lopez-Ruiz M, Inoue Y, Kaneko S, Hirose S, Osawa M, Oguni H, Fujimoto S, Grisar T, Stern J, Yamakawa K*, Laykaye B*, Delgado-Escueta A* (+co-first authors, *co-corresponding authors)., “Variant intestinal cell kinase in juvenile myoclonic epilepsy.”, New England Journal of Medicine, doi: 10.1056/NEJMoa1700175
発表者
理化学研究所
脳科学総合研究センター 神経遺伝研究チーム
チームリーダー 山川 和弘 (やまかわ かずひろ)
研究員 鈴木 俊光 (すずき としみつ)
研究員 宮本 浩行 (みやもと ひろゆき)
報道担当
理化学研究所 広報室 報道担当
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- ミオクロニー発作
- 短時間のぴくぴくとした骨格筋の攣縮発作。全身の場合もあれば顔面、体幹、四肢の一部に限局する場合もある。
-
- 強直間代発作
- てんかん発作の中でも最もよくみられるもので、大発作として知られる。強直発作時には強く激しい筋の収縮により、四肢がこわばった姿勢に固定される。呼吸抑制のためにチアノーゼを呈し、しばしば眼球および頭部が側方へ偏位し、転倒を伴う。間代発作時には、筋の間欠的な攣縮によるガクガクとした動きを示す。
-
- 腸管細胞キナーゼ (Intestinal Cell Kinase:ICK)
- 発見の経緯から「腸管」細胞キナーゼと名付けられたが、実際には脳をはじめ全身のさまざまな組織で、特に繊毛先端部に強く発現する。微小管を介したタンパク質輸送の制御と繊毛形成に必須のタンパク質である。
-
- 微小管
- 細胞中に見いだされる管状の構造であり、主にチューブリンと呼ばれるタンパクからなる。細胞骨格の一種。細胞分裂の際に形成される分裂装置の主体である。
-
- 繊毛
- 細胞表面に存在する微小管を軸とした突起状の構造。回転運動によって水流を形成する運動性繊毛(motile cilia)と細胞外からのシグナルを受容する一次繊毛(primary cilia)が存在する。生物の発生過程や恒常性維持に重要な役割を果たしている。近年、繊毛の異常が網膜色素変性症、肥満、嚢胞腎、多指症などのさまざまな疾患において報告されている。
-
- 微小異形成(microdysgenesis)
- 大脳皮質などの脳内における微小な組織学的異常(構造の乱れ、神経細胞の異常な出現、浸潤など)。若年ミオクロニーてんかんなどの特発性てんかん患者に特徴的に観察される。
参考文献 Eriksson SH et al., Acta Neurol Scand 111:279-90 (2005) など。
-
- 症候性てんかん
- てんかんのうち、難治のてんかん発作に運動障害・知能障害などを伴い、しばしば進行性で、かつ脳内病変の認められるもの。
-
- 潜因性てんかん
- 重い症状から特発性てんかんには分類しがたいが、脳内病変が認められないてんかん。
-
- 優性遺伝形式
- 親から子に伝わる疾患において、常染色体上に存在する1対の遺伝子の一方に異常があれば発症する遺伝様式を「常染色体優性遺伝」と呼ぶ。通常、患者の両親のどちらかが遺伝子変異を持つ。
-
- 遺伝的連鎖解析
- 特定の遺伝疾患を有する多数の家系において、症状が染色体のどの領域と一緒に親から子へと伝わっているかを統計的に解析することにより、染色体上のどこに疾患原因遺伝子が存在するのかを推定する方法。
-
- 全ゲノムエクソーム解析
- 全エクソン(遺伝子内のタンパク質をコードしている塩基配列)の塩基配列を、次世代シーケンサーを用いて解読する方法。
-
- キネシンスーパーファミリータンパクKif3a
- キネシンは、モータータンパク質の一つで、主にATPを加水分解しながら微小管に沿って運動する性質を持ち、細胞分裂や細胞内物質輸送に重要な働きをしている。Kif3aはキネシンの一種で、微小管合成・繊毛形成に重要な働きを持つ。
-
- キナーゼ
- リン酸基を基質(タンパク質)あるいはターゲット分子に転移する(リン酸化する)酵素の総称で、リン酸化酵素と呼ぶ。
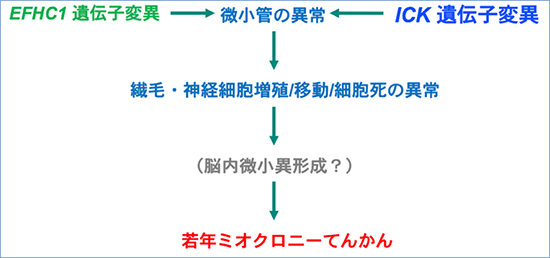
図1 ICK遺伝子とEFHC1遺伝子に共通する若年ミオクロニーてんかん発症メカニズム
EFHC1とICKの遺伝子異常が微小管の異常を引き起こし、それが繊毛・神経細胞増殖・移動・細胞死の異常につながり、患者脳でみられる微小異形成や若年ミオクロニーてんかんの発症を引き起こしていると考えられる。