2020-05-01 理化学研究所,近畿大学,東京理科大学
理化学研究所(理研)バイオリソース研究センターiPS細胞高次特性解析開発チームの林洋平チームリーダー、荒井優研究パートタイマー(東京理科大学薬学研究科薬科学専攻修士課程2年)らの共同研究グループは、遺伝性腎臓病の一つである「若年性ネフロン癆(ろう)」患者由来のiPS細胞(人工多能性幹細胞)[1]の樹立に成功しました。
本研究成果は、難病とされる若年性ネフロン癆の病態モデル細胞の開発を通した、発症機序の解明や治療法の開発に貢献すると期待できます。
ヒトiPS細胞は再生医療の実現だけではなく、さまざまな疾患の病態解析や治療法開発にも有効なツールであると考えられています。若年性ネフロン癆では腎移植以外に有効な治療法がないことから、発症機序解明のために病態モデル細胞のもとになる患者由来のiPS細胞の樹立が望まれてきました。
今回、共同研究グループは、発症に関わることが知られているNPHP1遺伝子[2]に欠失変異[3]がある2人の若年性ネフロン癆患者の末梢血からiPS細胞の樹立に成功しました。このiPS細胞の特性を解析したところ、NPHP1遺伝子の欠失変異が保持されており、その結果、遺伝子発現が消失していること、iPS細胞の特徴である自己複製能[4]と多能性[1]が維持されていることを確認しました。
本研究は、科学雑誌『Stem Cell Research』オンライン版(4月29日付)に掲載されました。
背景
ヒトiPS細胞(人工多能性幹細胞)は再生医療だけでなく、さまざまな疾患の病態解析や治療法の開発にも有効なツールであると、注目を集めています。「若年性ネフロン癆(ろう)」は遺伝性の腎臓疾患で、腎髄質に嚢胞(のうほう)が形成され、進行すると腎線維化、末期には腎不全を引き起こします。日本国内には約500人の患者がおり、腎移植以外に有効な治療法がないことから、発症機序の解明と新しい治療法の開発が望まれてきました。
近畿大学医学部小児科学教室は、2015年に日本人の若年性ネフロン癆患者では、「NPHP1遺伝子」の欠失変異が高い頻度で見られることを報告しました注1)。しかし、NPHP1遺伝子の欠失変異から発症に至る機序には不明な点が多いため、病態モデルを使った研究が必要です。
若年性ネフロン癆の病態モデル動物をつくる試みとして、NPHP1遺伝子を欠失変異させたマウスが以前にも報告されていました注2)が、そのマウスには腎臓の異常が見られず、病態モデルにはなりませんでした。もし、患者由来のiPS細胞が樹立されれば、そのiPS細胞から分化誘導した細胞を病態モデル細胞として研究対象とすることが可能になります。
注1)Sugimoto K., Miyazawa T., Enya T., Nishi H., Miyazaki K., Okada M., Takemura T., 2015. Clinical and genetic characteristics of Japanese nephronophthisis patients. Clin Exp Nephrol 20, 637-649.
注2)Jiang, S.T., Chiou, Y.Y., Wang, E., Lin, H.K., Lee, S.P., Lu, H.Y., Wang, C.K.L., Tang, M.J., Li, H., 2008. Targeted disruption of Nphp1 causes male infertility due to defects in the later steps of sperm morphogenesis in mice. Hum Mol Genet 17, 3368-3379.
研究手法と成果
若年性ネフロン癆患者由来のiPS細胞を樹立するため、共同研究グループは、近畿大学医学部小児科学教室で診療中のNPHP1遺伝子に欠失変異がある2人の同患者から末梢血を採取しました。
次に、京都大学iPS細胞研究所(CiRA)において、採取した末梢血からiPS細胞を作製しました。その作製には、2014年にCiRA で開発された方法を用いました注3-4)。患者由来の抹消血から分離した白血球の一種である単核球[5]に、エピソーマルプラスミドベクター[6]を用いてiPS細胞を作製した結果、6株のiPS細胞株の樹立に成功しました。
樹立しiPS細胞株は、配布機関である理研バイオリソース研究センター(BRC)細胞材料開発室(理研細胞バンク)へと寄託され、理研細胞バンクは、これらのiPS細胞に対する品質検査と、拡大生産するための培養を行いました。その後、三つの研究室からなる特性解析研究グループ(理研BRC iPS細胞高次特性解析開発チーム、理研生命機能科学研究センター(BDR)ヒト器官形成研究チーム、東京理科大学薬学部生命創薬科学科)へ提供しました。
特性解析研究グループが、このiPS細胞の特性を解析したところ、NPHP1遺伝子に欠失変異が保持されており、その結果、この遺伝子の発現が消失していること、iPS細胞の特徴である自己複製能と多能性が維持されていることを確認しました(図1)。
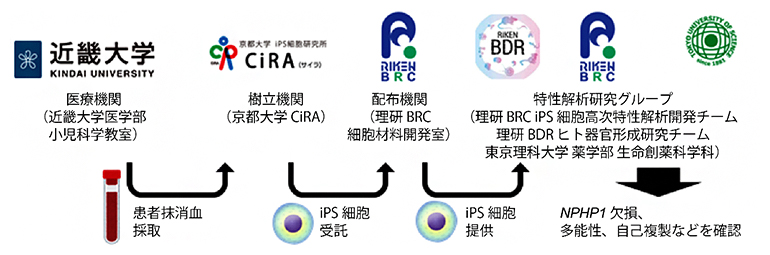
図1 本研究における他機関との連携
①医療機関(近畿大学医学部小児科学教室)でNPHP1遺伝子に欠失変異がある2人の若年性ネフロン癆患者から末梢血を採取。②樹立機関(京都大学iPS細胞研究所:CiRA)においてiPS細胞を作製。③配布機関(理研BRC細胞材料開発室)でiPS細胞に対する品質検査と拡大生産するための培養を実施。④特性解析研究グループ(理研BRC iPS細胞高次特性解析開発チーム、理研BDRヒト器官形成研究チーム、東京理科大学薬学部生命創薬科学科)でiPS細胞の特性を解析。その結果、NPHP1発現の消失や自己複製能、多能性が維持されていることを確認した。
注3)Okita, K., Yamakawa, T., Matsumura, Y., Sato, Y., Amano, N., Watanabe, A., Goshima, N., Yamanaka, S., 2013. An efficient nonviral method to generate integration-free human-induced pluripotent stem cells from cord blood and peripheral blood cells. Stem Cells 31, 458-466.
注4)Nakagawa, M., Taniguchi, Y., Senda, S., Takizawa, N., Ichisaka, T., Asano, K., Morizane, A., Doi, D., Takahashi, J., Nishizawa, M., Yoshida, Y., Toyoda, T., Osafune, K., Sekiguchi, K., Yamanaka, S., 2014. A novel efficient feeder-free culture system for the derivation of human induced pluripotent stem cells. Sci. Rep. 4, 3594.
今後の期待
本研究成果は、今後、若年性ネフロン癆の発症機序の解明や新しい治療法の開発に役立てられると期待できます。
また、本研究における多施設連携の枠組みを通して、医療機関・樹立機関・配布機関・解析機関(研究室)がそれぞれ連携することができれば、多くの難病に対するiPS細胞を用いた研究がより効率的に進むと期待できます。
補足説明
1.iPS細胞(人工多能性幹細胞)、多能性
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、成人の皮膚細胞などの体細胞・組織から採取した細胞にOct3、Sox2、Klf4遺伝子などを導入して初期化し多能性を持たせ、人工的に作製した多能性幹細胞である。
2.NPHP1遺伝子
ヒト2番染色体上に位置し、ネフロシスチン1タンパク質をコードする遺伝子。NPHP1遺伝子の欠失・変異は、若年性ネフロン癆の主要な遺伝的要因であることが知られている。このタンパク質は、細胞内で繊毛形成に関与していることが判明しているが、このタンパク質の機能不全がどのように若年性ネフロン癆の発症につながるかは不明な点が多い。
3.欠失変異
染色体上に存在する遺伝子(群)のDNA配列の一部が欠けてしまうこと。このことにより、特定の遺伝子(群)の発現がなくなり、細胞の機能異常や疾患の原因につながる。
4.自己複製能
iPS細胞などの多能性幹細胞は多分化能を維持したまま、ほぼ無限に増殖できる能力を持つ。これを自己複製能と呼ぶ。健常人由来や難病患者由来のiPS細胞は、自己複製能を維持し続けることができるため、研究、創薬、再生医療へと安定的に供給することが可能であり、バイオリソースとして、非常に価値が高い。
5.単核球
血液細胞のうちの、白血球の一種である。リンパ球と単球を合わせた総称である。技術的には、全血サンプルから遠心分離によって、濃縮回収することができる。
6.エピソーマルプラスミドベクター
従来のプラスミドDNAベクターを改変して、遺伝子導入した細胞内で、ゲノムDNAに組み込まれなくても、持続的に遺伝子発現を維持できるようにしたベクターの種類。技術的には、EBウイルス(エプスタイン・バール・ウイルス)由来のDNA複製を維持するためのEBNA1タンパク質をコードする遺伝子と、そこから発現されたEBNA1タンパク質が結合でき、ベクターのDNA複製起点となるOriP配列を同一ベクター内に構築してある。
共同研究グループ
理化学研究所 バイオリソース研究センター(BRC)
iPS細胞高次特性解析開発チーム
チームリーダー 林 洋平(はやし ようへい)
研究パートタイマー 荒井 優(あらい ゆたか)
(東京理科大学薬学研究科 薬科学専攻 修士課程2年)
研究パートタイマー 髙見 美帆(たかみ みほ)
(筑波大学大学院生、研究当時)
テクニカルスタッフ(研究当時) 安 瑜利(あん ゆり)
開発研究員 髙﨑 真美(たかさき まみ)
テクニカルスタッフ 若林 玲実(わかばやし たまみ)
細胞材料開発室
室長 中村 幸夫(なかむら ゆきお)
開発技師 野口 道也(のぐち みちや)
派遣職員 井上 循(いのうえ じゅん)
生命機能科学研究センター(BDR) ヒト器官形成研究チーム
チームリーダー 高里 実(たかさと みのる)
近畿大学 医学部 小児科学教室
教授 杉本 圭相(すぎもと けいすけ)
教授(研究当時) 竹村 司(たけむら つかさ)
(くしもと町立病院)
京都大学 iPS細胞研究所(CiRA)
未来生命科学開拓部門
講師 沖田 圭介(おきた けいすけ)
増殖分化機構研究部門
教授 長船 健二(おさふね けんじ)
東京理科大学 薬学部 生命創薬科学科 准教授 早田 匡芳(はやた ただよし)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究A「染色体異常を伴った疾患特異的iPS細胞を修復する「染色体編集法」の開発(研究代表者:林洋平)」による支援を受けて行われました。
原論文情報
Yutaka Arai, Miho Takami, Yuri An, Mami Matsuo-Takasaki, Yasuko Hemmi, Tamami Wakabayashi, Jun Inoue, Michiya Noguchi, Yukio Nakamura, Keisuke Sugimoto, Tsukasa Takemura, Keisuke Okita, Kenji Osafune, Minoru Takasato, Tadayoshi Hayata, Yohei Hayashi, “Generation of two human induced pluripotent stem cell lines derived from two juvenile nephronophthisis patients with NPHP1 deletion”, Stem Cell Research, 10.1016/j.scr.2020.101815
発表者
理化学研究所
バイオリソース研究センター iPS細胞高次特性解析開発チーム
チームリーダー 林 洋平(はやし ようへい)
研究パートタイマー 荒井 優(あらい ゆたか)
(東京理科大学 薬学研究科 薬科学専攻 修士課程2年)
報道担当
理化学研究所 広報室 報道担当
近畿大学 医学部・病院事務局 総務広報課
東京理科大学 広報部広報課