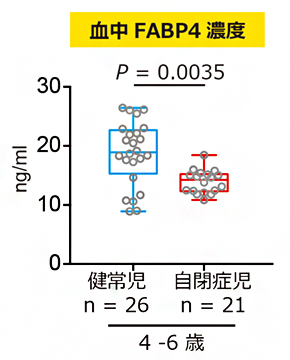
エイズウイルス誕生につながるウイルスの適応進化原理の解明へ
2020-09-11 東京大学
発表のポイント
- 分子系統学と実験ウイルス学の学際融合研究により、エイズウイルス(注1)を含むレンチウイルス(注2)が、「種の壁」を乗り越えて異なる種の宿主へと異種間伝播(注3)し、新たなウイルスとして適応進化する分子メカニズムの一端を解明した。
- 本研究成果は、ヒトに病原性を示すウイルスがどのように異種間伝播したのかというウイルスの適応進化の原理の一端を明らかにしたものである。
- 本研究の学際的なアプローチは、汎用性が高く、コウモリから異種間伝播して誕生したと考えられている新型コロナウイルスに関する研究にも応用・展開が可能である。
発表概要
東京大学医科学研究所 附属感染症国際研究センター システムウイルス学分野の佐藤佳准教授らは、分子系統学と実験ウイルス学の学際融合研究により、エイズウイルスを含むレンチウイルスが、「種の壁」を乗り越えて異種間伝播し、新たなウイルスとして適応進化(注4)する分子メカニズムの一端を解明しました。
ウイルスが異なる種の宿主に感染する(異種間伝播する)ためには、さまざまな障壁を乗り越える必要があります(図1)。ウイルスはまず、元の宿主から新たな宿主へと「暴露(spillover)」される必要があります。次にウイルスは、新たな宿主で複製する中において、新しい宿主の中で複製するために有利になる変異を獲得し、新たな宿主の個体の間で伝播し、新たなウイルスとして適応進化します。しかし、ウイルスが異なる種の宿主への異種間伝播を達成するためには、「種の壁(species barrier)」(注5)を乗り越える必要があります。

図1 ウイルスの異種間伝播と適応進化の原理
ウイルスが異種間伝播するためには、ウイルスはまず、元の宿主から新たな宿主へと「暴露(spillover)」される必要があります。次にウイルスは、新たな宿主で複製する中で、新しい宿主の中で複製するために有利になる変異を獲得します。さらに、新たな宿主の個体間で伝播することにより、新たなウイルスとして適応進化します。
分子系統学とウイルス分離場所の地理情報の統合解析(系統地理学的解析、biogeography)から、エイズウイルスは、類人猿(チンパンジーやゴリラ)のレンチウイルスがヒトに異種間伝播することによって、約100年前に中央アフリカで誕生したと推察されています(図2)。また、ゴリラのレンチウイルスもまた、チンパンジーのレンチウイルスが、ゴリラへと異種間伝播することで誕生したと推察されています(図2)。
このように、ウイルスの配列情報を用いた分子系統学的解析により、エイズウイルスの誕生につながるレンチウイルスの異種間伝播の経路については詳細が明らかとなっています。しかし、それぞれのウイルスがどのようにして新しい宿主の「種の壁」を乗り越え、新しいウイルス(ヒトにとってのエイズウイルス)へと適応進化したのか、その分子メカニズムについてはほとんど明らかとなっていませんでした。
本研究では、分子系統学情報とウイルス学・細胞生物学に基づく詳細な分子スクリーニング実験により、チンパンジーのレンチウイルスが持つタンパク質のたったひとつのアミノ酸変異によって、ゴリラの内因性免疫を乗り越える機能が獲得されることが明らかとなりました(図2)。

図2 エイズウイルス(HIV)の誕生に至るまでの霊長類レンチウイルスの異種間伝播経路と、本研究成果のまとめ
分子系統学とウイルス分離場所の地理情報の統合解析(系統地理学的解析、biogeography)から、エイズウイルスは、約100年前に中央アフリカで誕生したと推察されています。エイズウイルスは、系統学的に、グループM(major)、N(non-M-non-O)、O(outlier)、Pの4つのグループに分類されます(図右。カッコ内の数字は、現在に至るまでに生み出したと推定される総感染者数)。また、ウイルスの遺伝配列の分子系統学的解析から、グループMとNのエイズウイルスはチンパンジーのレンチウイルスSIVcpzが、グループOとPのエイズウイルスはゴリラのレンチウイルスSIVgorが、それぞれヒトへと異種間伝播することで誕生したことが示唆されています。また、ゴリラのレンチウイルスSIVgorもまた、チンパンジーのレンチウイルスSIVcpzが、ゴリラへと異種間伝播することで誕生したと推察されています。このように、ウイルスの配列情報を用いた分子系統学的解析により、エイズウイルスの誕生につながる、類人猿の中でのレンチウイルスの異種間伝播の経路については詳細が明らかとなっています。しかし、それぞれのレンチウイルスがどのようにして新しい宿主の「種の壁」を乗り越え、新しいレンチウイルス(ヒトにとってのエイズウイルス)へと適応進化したのか、その分子メカニズムについてはほとんど明らかとなっていませんでした。本研究により、HIVグループOとPの祖先であるSIVgorが誕生する際、その祖先であるSIVcpzのVifタンパク質が、M16Eという変異を獲得することにより、ゴリラの内因性免疫であるAPOBEC3Gを拮抗阻害する機能を新規に獲得したことが明らかとなりました。
本研究は、実世界で起こったレンチウイルスの種間伝播の原理を、分子系統学と実験ウイルス学の学際融合研究によって解明した初めての研究成果です。
本研究成果は、2020年9月10日米国科学雑誌「PLOS Pathogens」(オンライン版)に公開されました。
発表内容
ウイルスが異なる種の宿主に感染する(異種間伝播する)ためには、さまざまな障壁を乗り越える必要があります(図1)。ウイルスはまず、元の宿主から新たな宿主へと「暴露(spillover)」される必要があります。次にウイルスは、新たな宿主で複製する中で、新しい宿主の中で複製するために有利になる変異を獲得し、新たな宿主の個体の中で伝播し、新たなウイルスとして適応進化します。しかし、ウイルスが異なる種の宿主に適応進化し、異種間伝播を達成するためには、「種の壁(species barrier)」を乗り越える必要があります。宿主の「種の壁」のひとつとして、ほ乳類は、ウイルス複製を阻害する「内因性免疫(intrinsic immunity)」(注6)を進化的に獲得してきたことが知られています。
エイズウイルスはじめとするレンチウイルスの感染を阻害する内因性免疫のひとつとして、細胞性シチジン脱アミノ化酵素であるAPOBEC3G(注7)が知られています。ウイルス感染細胞に発現するAPOBEC3Gは、放出されるウイルス粒子に取り込まれ、新規感染細胞で合成されるウイルスゲノムに変異を挿入することにより、ウイルスの複製を強力に抑制します。
一方、多くのレンチウイルスは、viral infectivity factor(Vif)(注8)というウイルスタンパク質を保有しています。Vifは、感染細胞で発現するAPOBEC3Gをユビキチン・プロテアソーム依存的経路で分解することにより、APOBEC3Gの抗ウイルス活性を拮抗阻害します(図3)。レンチウイルスのVifと宿主のAPOBEC3Gの相互作用は、種特異性が極めて高いことが知られています。すなわち、レンチウイルスが新たな宿主へと異種間伝播するためには、APOBEC3Gという「種の壁」を乗り越える必要があります。

図3 内因性免疫APOBEC3Gによる抗ウイルス効果と、ウイルスタンパク質Vifによる拮抗阻害効果
(図左、グレー)レンチウイルスのVifタンパク質が存在しない場合、ウイルス感染細胞に発現するAPOBEC3G(図中青星)は、放出されるウイルス粒子に取り込まれ、新規感染細胞で合成されるウイルスゲノムに変異を挿入することにより、ウイルスの複製を強力に阻害します。
(図右)一方、レンチウイルスのVifタンパク質が存在する場合、Vifは、感染細胞で発現するAPOBEC3Gをユビキチン・プロテアソーム依存的経路で分解することにより、APOBEC3Gの抗ウイルス活性を拮抗阻害します。
分子系統学とウイルス分離場所の地理情報の統合解析(系統地理学的解析、biogeography)から、エイズウイルスは、約100年前に中央アフリカで誕生したと推察されています。エイズウイルスは、系統学的に、グループM(major)、N(non-M-non-O)、O(outlier)、Pの4つのグループに分類されます。
また、分子系統学的解析から、グループMとNのエイズウイルスはチンパンジーのレンチウイルスSIVcpzが、グループOとPのエイズウイルスはゴリラのレンチウイルスSIVgorが、それぞれヒトへと異種間伝播することで誕生したことが示唆されています(図2)。
また、ゴリラのレンチウイルスSIVgorもまた、チンパンジーのレンチウイルスSIVcpzが、ゴリラへと異種間伝播することで誕生したと推察されています(図2)。
このように、ウイルスの配列情報を用いた分子系統学的解析により、エイズウイルスの誕生につながる、類人猿の中でのレンチウイルスの異種間伝播の経路については詳細が明らかとなっています。しかし、それぞれのレンチウイルスがどのようにして新しい宿主の「種の壁」を乗り越え、新しいレンチウイルス(ヒトにとってのエイズウイルス)へと適応進化したのか、その分子メカニズムについてはほとんど明らかとなっていませんでした。
興味深いことに、チンパンジーのレンチウイルスSIVcpzのVifタンパク質は、ゴリラの内因性免疫APOBEC3Gを拮抗阻害できないことが知られていました(D’arc et al, PNAS, 2015)。
一方、ゴリラのレンチウイルスSIVgorのVifタンパク質は、ゴリラのAPOBEC3Gを拮抗阻害することができます。これらの事実は、ゴリラの内因性免疫APOBEC3Gが、チンパンジーからゴリラへのSIVcpzの異種間伝播を妨げる「種の壁」となっていること、また、SIVcpzのVifタンパク質は、ゴリラのAPOBEC3Gを拮抗阻害する機能を獲得することによって、SIVgorとして適応進化したと推察されます。しかし、ウイルス種間でのvif遺伝子の配列相同性はきわめて低く、SIVcpz Vifがどのような変異を獲得することによってゴリラのAPOBEC3Gを拮抗阻害する機能を獲得したのかは明らかとなっていませんでした。
本研究では、分子系統学情報とウイルス配列情報に基づいたさまざまなVifタンパク質変異体を作出し、ウイルス学と細胞生物学に基づく詳細な分子スクリーニング実験を行いました。その結果、M16Eというたったひとつのアミノ酸変異によって、ゴリラのAPOBEC3Gを拮抗阻害する機能が獲得されることが明らかとなりました(図2)。すなわち、チンパンジーのレンチウイルスSIVcpzは、Vifタンパク質のM16Eという変異を獲得することにより、ゴリラの内因性免疫APOBEC3Gという「種の壁」を乗り越え、SIVgorという新しいレンチウイルスへと適応進化したことが明らかとなりました。
本研究は、実世界で起こったレンチウイルスの種間伝播の原理を、分子系統学と実験ウイルス学の学際融合研究によって解明した初めての研究成果です。チンパンジーのウイルスSIVcpzを祖先とするグループMのエイズウイルスは、誕生から現在に至るまで、全世界で流行して7,000万人以上の感染者を生み出しているのに対し、ゴリラのウイルスSIVgorを祖先とするグループOのエイズウイルスは、アフリカで限局的に流行し、感染者数も数十万人に留まっています。
本研究成果とこれらの事実から、レンチウイルスがゴリラを経由することによって独自の進化を遂げ、ヒトへの異種間伝播にも影響を与えたことが示唆されます。今後の研究により、レンチウイルスの異種間伝播の分子メカニズムと、「種の壁」としてのヒトの内因性免疫の解明が期待されます。
本研究への支援
本研究は、佐藤 佳 准教授と中川 草講師(東海大学)に対する新学術領域研究「ネオウイルス学」、佐藤 佳 准教授と小柳 義夫 教授(京都大学)に対する日本医療研究開発機構 エイズ対策実用化研究事業、佐藤 佳 准教授に対する科学研究費補助金 基盤研究B(18H02662)、日本医療研究開発機構 感染症研究革新イニシアティブ(J-PRIDE)、日本医療研究開発機構 新興・再興感染症に対する革新的医薬品等開発推進研究事業、科学技術振興機構CREST、今野 順介 大学院生、木村 出海 大学院生、麻生 啓文 大学院生、長岡 峻平 大学院生、伊東 潤平 博士研究員に対する日本学術振興会 特別研究員奨励費などの支援の下で実施されました。
発表雑誌
雑誌名:「PLOS Pathogens」(2020年9月10日オンライン版)
論文タイトル:A role for gorilla APOBEC3G in shaping lentivirus evolution including transmission to humans
著者:中野 雄介1, 山本 啓輔1,2, 上田 真保子3, Andrew Soper1,2, 今野 順介1,4,5, 木村 出海1,4,6, 瓜生 慧也4,7, 熊田 隆一1,4,8, 麻生 啓文1,4,6, 三沢 尚子1, 長岡 峻平1,4,5, 清水 聡真1,6, 光宗 渓杜1,6, 小杉 優介1,6, Guillermo Juarez-Fernandez1,2, 伊東 潤平1,4, 中川 草3, 池田 輝政9,10,11, 小柳 義夫1,2,6, Reuben S Harris9,10, 佐藤 佳1,4,6,7,12*
1京都大学ウイルス・再生医科学研究所
2京都大学大学院医学研究科
3東海大学医学部
4東京大学医科学研究所附属感染症国際研究センターシステムウイルス学分野
5京都大学大学院生命科学研究科
6京都大学大学院薬学研究科
7東京大学大学院医学系研究科
8京都大学理学部
9ミネソタ大学
10ハワード・ヒューズ医学研究所
11熊本大学ヒトレトロウイルス学共同研究センター
12科学技術振興機構CREST
DOI 番号:10.1371/journal. ppat.1008812
URL: https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1008812
問い合わせ先
〈研究内容について〉
東京大学医科学研究所 附属感染症国際研究センター システムウイルス学分野
准教授 佐藤 佳(さとう けい)
〈報道について〉
東京大学医科学研究所 国際学術連携室(広報)
用語解説
(注1)エイズウイルス
後天性免疫不全症候群(エイズ)の原因ウイルス。ヒト免疫不全ウイルス(human immunodeficiency virus; HIV)。レトロウイルス科レンチウイルス属に属する。↑
(注2)レンチウイルス
レトロウイルス科レンチウイルス属に属するウイルスの総称。ヒトではHIVが、チンパンジーではSIVcpzが、ゴリラではSIVgorがそれぞれ分離・同定されている。また、ネコやウシ、ウマなどでも病原性ウイルスとしてレンチウイルスが分離・同定されている。↑
(注3)異種間伝播
ウイルスが、元の宿主から別の新たな宿主へと伝播されること。↑
(注4)適応進化
新たな宿主に暴露されたウイルスが、新たな宿主に適応するために変異を獲得する過程。↑
(注5)種の壁(species barrier)
ウイルスの異種間伝播を妨げる、宿主が生来持っている防御機構。↑
(注6)内因性免疫(intrinsic immunity)
ほ乳類が進化する過程において、ウイルスなどの外来の病原体から生体を守るために獲得した防御機構。レンチウイルスの感染を防御する因子として、APOBEC3Gやtetherinなどの細胞性タンパク質が同定されている。↑
(注7)APOBEC3G
霊長類がもつ内因性免疫のひとつ。シチジン脱アミノ化酵素。放出されるレンチウイルスの粒子に取り込まれ、新規感染細胞で合成されるウイルスゲノムに変異を挿入することにより、レンチウイルスの複製を強力に抑制する機能を持つ。↑
(注8)viral infectivity factor(Vif)
エイズウイルスをはじめとするほとんどのレンチウイルスがもつウイルスタンパク質のひとつ。細胞のユビキチン・プロテアソーム系を動員することにより、感染細胞で発現するAPOBEC3Gタンパク質を分解することにより、APOBEC3Gによるウイルス複製阻害機能を拮抗阻害する。↑