2021-03-31 京都大学iPS細胞研究所
ポイント
- 維持培養時の細胞外基質注1(合成ラミニン注2)によってiPS細胞の血液細胞への分化能が制御されていることを示した。
- 弱い接着性がインテグリンβ1サブユニット(ITGB1)注3-古典的Wnt経路注4により血液細胞への分化効率を高めていることを明らかにした。
- さらに血液分化培養方法の改良と併せて産生効率を大幅に向上させることに成功した。
1. 要旨
杠明憲 研究員、江藤浩之教授(CiRA臨床応用研究部門)らの研究グループは、複数の合成ラミニン(LM)を比較検討し、うちLM421-E8あるいはLM121-E8でコートされた培養皿上で維持培養したiPS細胞は血液前駆細胞へ分化する効率が高いことを示しました。さらにこの2種類の合成LMで培養したヒトiPS細胞は培養皿への接着性が弱い一方、LM受容体であるインテグリンβ1サブユニット(ITGB1)とその下流シグナリングである古典的Wnt経路の発現レベルが上昇していることを見出しました。その他の合成LMにおいても濃度希釈による基質接着性の低減や薬剤による直接的な古典的Wnt経路刺激で血液細胞への分化能力が回復することを示しました。同時に開発した改良型分化方法と併せてiPS細胞からの血液細胞分化効率を大きく向上させました。
この研究成果は2021年3月16日(英国時間)に「Stem Cell Research」にオンライン公開されました。
2. 研究の背景
iPS細胞の維持培養には、細胞と培養皿を接着させる足場となる細胞外基質が必要になります。本邦でこの細胞外基質として標準的に使用されているLM511-E8は、iPS細胞の多能性維持と増殖能の両立を果たす有用な分子ですが、一方でLM511-E8で培養したiPS細胞は血液細胞へ分化しにくい(分化抵抗性)ということがわかっていました。
研究グループはこれまでにiPS細胞から不死化巨核球株を介し、生体外で大量に血小板を生産する方法を提案し臨床応用を進めています(CiRAニュース 2014年2月14日)。さらなる汎用化のためには、不死化巨核球株を作製する段階で問題となる血液細胞への分化抵抗性についての原因究明、ならびに血液細胞分化法の効率化が求められていました。
3. 研究結果
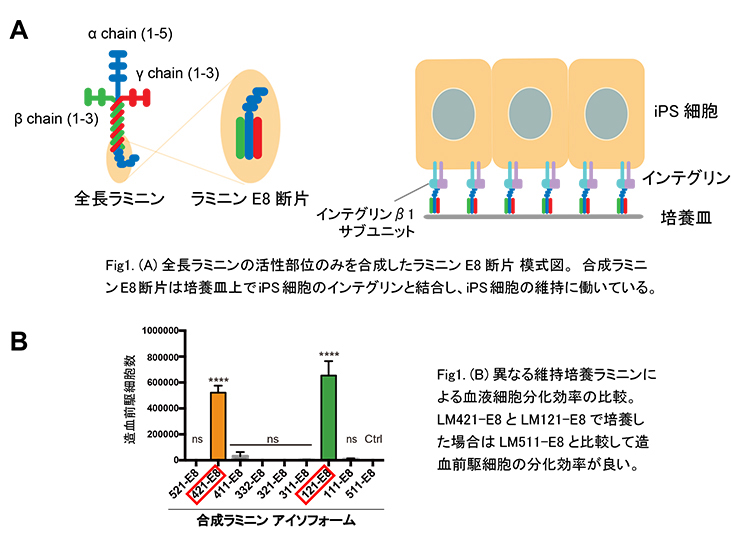
1) ラミニンの種類による血液細胞への分化効率の比較
9種類の合成LMを比較検討したところ、LM421-E8とLM121-E8でコートした培養皿上で維持培養したiPS細胞はLM511-E8などで維持した場合より血液細胞への分化効率が高く、LMが細胞外からiPS細胞の分化能力を制御していることを見出しました。(Fig1)
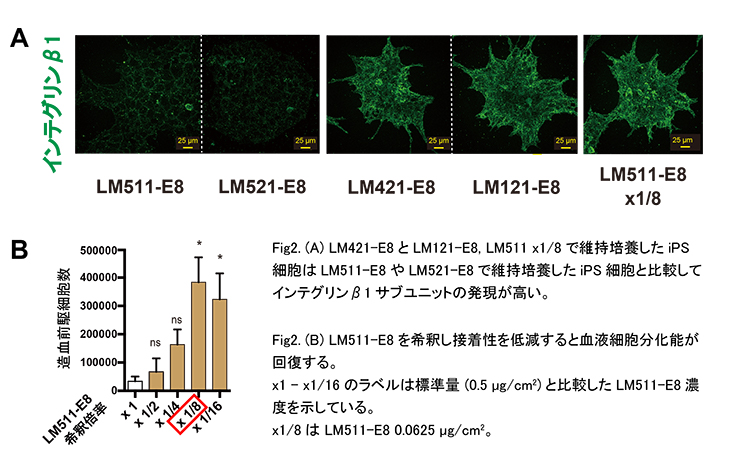
2) 弱い接着性がITGB1-古典的Wnt経路により血液細胞分化効率を高めている
LM421-E8とLM121-E8を用いて維持培養したiPS細胞では培養皿への接着性が減弱し、細胞表面に存在するITGB1の発現量が上昇することがわかりました。さらにマイクロアレイ解析により古典的Wnt経路の発現も上昇していることがわかりました。
「弱い接着性がITGB1と下流の古典的Wnt経路の発現を誘導し血液細胞分化効率を高めている」と仮説を立て、LM511-E8を希釈して接着性を弱めたところ、細胞表面のITGB1発現亢進と血液細胞への分化能回復を確認しました。(Fig2)
また、LM421-E8, LM121-E8,希釈LM511-E8では、ITGB1とその下流である古典的Wnt経路の中間に位置するILKの重要性が確認されました。
3) 血液細胞産生効率の向上
改良型血液分化法を組み合わせることで、iPS細胞から血液細胞への分化効率は大きく改善しました。(Fig3)
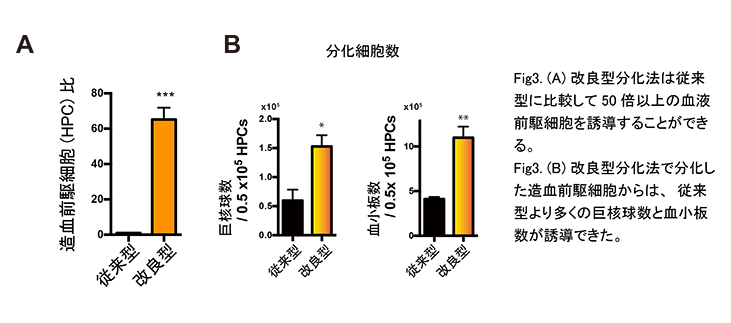
4. まとめ
iPS細胞から血液細胞へと分化する能力は未分化状態の細胞外環境によって影響され、臨床使用される511-E8ラミニンの濃度希釈や古典的Wnt経路刺激剤などの方法で制御できることがわかりました。
これまでiPS細胞の分化指向性は樹立する際の細胞特性(遺伝子,エピジェネティクス,由来細胞)などが主な要素であると考えられてきました。本研究は分化指向性を細胞への刺激などの細胞外部環境によって制御可能であることを示しています。
またLMのアイソフォームによってiPS細胞の未分化維持や分化指向性へ与える影響が異なることは報告されていましたが、その仕組みはわかっていませんでした。これについて本研究は細胞接着強度とITGB1-古典的Wnt経路の関与を提起しました。
これらの結果はiPS細胞由来血液細胞による再生医療の実現を加速することが期待されます。(Fig4)
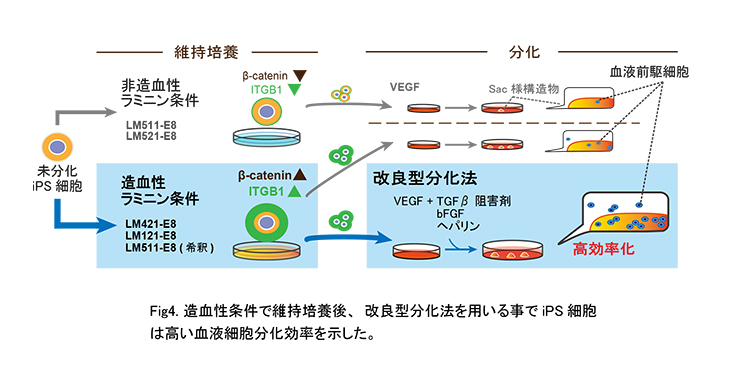
5. 論文名と著者
- 論文名
Extracellular laminin regulates hematopoietic potential of pluripotent stem cells through Integrin β1-ILK-β-catenin-JUN axis - ジャーナル名
Stem Cell Research - 著者
Akinori Yuzuhira1, Sou Nakamura1, Naoshi Sugimoto1, Shunsuke Kihara1, Masato Nakagawa1, Takuya Yamamoto1,2,3, Kityotoshi Sekiguchi4, and Koji Eto1,5 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学高等研究院ヒト生物学高等研究拠点(WPI-ASHBi)
- 国立研究開発法人日本医療研究開発機構(AMED)
- 大阪大学 蛋白質研究所
- 千葉大学大学院医学研究院
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED「再生医療の実現化ハイウェイ」
- AMED「iPS細胞研究中核拠点事業」
- 日本学術振興会「基 盤研究A」
- 日本学術振興会「特別研究員奨励費」
7. 用語説明
注1)細胞外基質
細胞間の隙間を埋める生体高分子(コラーゲンやプロテオグリカンなど)の集合体。骨・軟骨、歯、皮膚などに多く含まれ、組織を支えてメカニカル(クッション・伸び縮みなど)な機能を果たしている。
注2)合成ラミニン(LM)
ラミニンは細胞を接着させるために重要なタンパク質。上皮細胞や筋細胞、血管内皮細胞など様々な細胞で分泌合成されている。様々なタイプのラミニンがあり、細胞の種類によって作られているラミニンは異なる。合成ラミニンは、そのラミニンのうち必要な一部分を人工的に合成したもの。
注3)インテグリンβ1サブユニット(ITGB1)
インテグリンは細胞表面にあるタンパク質で、細胞を接着する分子。α鎖とβ鎖の2つのサブユニットから構成される、それぞれサブユニット内にも多数の種類があり多様な組合せが可能。β1サブユニットはラミニンと結合する。
注4)古典的Wnt経路
β-カテニンを介して遺伝子発現するWntシグナルの経路。脊椎動物や無脊椎動物の発生における細胞運命の決定の調節や細胞の増殖、分化の制御に働いていることが良く知られている。