たった1カ所のリン酸化が招く翻訳開始因子複合体の構造変化
2019-05-03 理化学研究所
理化学研究所(理研)生命機能科学研究センター翻訳構造解析研究チームの伊藤拓宏チームリーダー、柏木一宏研究員らの研究グループ※は、ストレスによって誘導される翻訳開始因子[1]「eIF2」のリン酸化[2]が、タンパク質合成を抑制する仕組みを解明しました。
本研究は、細胞に備わったストレス応答[3]の基本的な機構の構造基盤を解明するものであり、神経変性疾患[4]など翻訳開始因子が関与するさまざまな疾患の理解に貢献すると期待できます。
細胞は紫外線などのストレスにさらされると、タンパク質の合成反応である「翻訳」を停止して、細胞活動の負荷を下げることが知られています。細胞がストレスを検知すると、翻訳開始因子eIF2がリン酸化されます。通常eIF2は、別の翻訳開始因子「eIF2B」によって活性化されて翻訳を開始しますが、ストレスを受けてリン酸化されたeIF2は、eIF2Bの機能を阻害する分子へと変化し、その結果、活性型eIF2が減少して翻訳が抑制されます。この変化は、eIF2の1カ所のリン酸化で生じるもので、酵母からヒトまでの全ての真核生物に共通の機構です。しかし、「eIF2BによるeIF2の活性化」あるいは「リン酸化eIF2によるeIF2Bの機能阻害」の制御を切り替える分子機構は、長らく不明でした。
今回、研究グループは、eIF2とeIF2Bの複合体の立体構造を解析しました。リン酸化したeIF2は、eIF2Bへの結合の向きを反対側に切り替えてeIF2を活性化できない複合体を形成し、eIF2Bの機能を阻害することを明らかにしました。
本研究は、米国の科学雑誌『Science』(5月3日号)に掲載されます。

図 eIF2(青と紫)のリン酸化によるeIF2B(灰色)への結合の向きの切り替わり
※研究グループ
理化学研究所 生命機能科学研究センター
翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(いとう たくひろ)
研究員 柏木 一宏(かしわぎ かずひろ)
技師 西本 まどか(にしもと まどか)
技師 高橋 真梨(たかはし まり)
技師 坂本 恵香(さかもと あやこ)
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
研究員 横山 武司(よこやま たけし)
創薬タンパク質解析基盤ユニット
テクニカルスタッフI 米持 まゆ美(よねもち まゆみ)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金 新学術領域研究(研究領域提案型)「ピコルナウイルスの2Aペプチドの終止コドン非依存的翻訳終結の構造基盤(研究代表者:伊藤拓宏)」、「ウイルスが引き起こす非標準的な翻訳機構の構造基盤(研究代表者:伊藤拓宏)」、同基盤研究(B)「HCV IRESによるリボソーム・ハイジャックの分子機構(研究代表者:伊藤拓宏)」、同若手研究「ストレス環境における翻訳開始因子eIF2Bの活性阻害機構の解明(研究代表者:柏木一宏)」、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)「統合的構造解析に向けた高難度複合体の生産支援と高度化(研究代表者:白水美香子)」および武田科学振興財団ライフサイエンス研究奨励「真核生物の翻訳開始制御機構の解明(研究代表者:伊藤拓宏)」による支援を受けて行われました。
背景
タンパク質の合成反応である「翻訳」は、その原材料となるアミノ酸の生合成まで含めると、全体として非常に多くのエネルギーを消費する過程です。細胞が正常な活動ができなくなるほどのストレスを受けると、エネルギーを節約し、さらにストレスによって引き起こされるタンパク質合成のエラーを防止するために、翻訳を全体的に抑制します。そして特定のストレス応答タンパク質の合成を始めることで、ストレス環境への適応を行います。このようなストレスによる翻訳の制御には、翻訳開始因子「eIF2」のαサブユニット(eIF2α)のリン酸化が重要であることが知られています。
eIF2は、三つのサブユニット[5](α、β、γ)からなるGタンパク質[6]で、γサブユニット(eIF2γ)がGTP[6]またはGDP[6]と結合します。eIF2は、別の翻訳開始因子「eIF2B」によってGDP結合型(不活性型)からGTP結合型(活性型)へと変換されることで活性化され、翻訳に参加できるようになります。翻訳に参加したeIF2は、活性型から不活性型に戻り、次の活性化を待ちます(図1)。
しかし、ストレスによってeIF2がリン酸化されると、eIF2Bによる活性化が阻害されます。その結果、細胞内の活性型eIF2が減少し、翻訳抑制を始めとする一連のストレス応答が開始します。
eIF2がリン酸化されるとどのように翻訳が抑制されるのかについては、伊藤チームリーダーらによるeIF2Bの立体構造解析などから研究が進められてきました注1)。しかし、eIF2とeIF2Bがどのような複合体を形成するのか、そして複合体の構造がeIF2のリン酸化によってどう変化するのかは解明されていませんでした。
細胞がストレスを受けても翻訳が抑制されない、あるいはストレスがなくなっても翻訳抑制を解除できなくなる異常が生じると、さまざまな疾患の原因となります。例えば近年、eIF2BのeIF2活性化反応を促進する薬剤が、神経変性疾患の進行を遅らせ、外傷性脳損傷による認知機能の低下を防ぐ作用を持つことが報告されています注2)。この機構が解明されれば、将来的な薬剤開発などに役立つことが考えられます。
注1)2016年2月23日プレスリリース「白質消失病の発症機構」
注2)A. Chou, et al., Inhibition of the integrated stress response reverses cognitive deficits after traumatic brain injury. Proc Natl Acad Sci U S A, 114, E6420-E6426 (2017).
研究手法と成果
研究グループはまず、クライオ電子顕微鏡法[7]を用いて、ヒトのeIF2とeIF2Bの複合体の構造を解析しました。その結果、eIF2のリン酸化の有無によって、eIF2のeIF2Bへ結合する向きが大きく異なることが明らかになりました。
リン酸化していないeIF2とeIF2Bの複合体では、eIF2Bの活性を担う「HEATドメイン」と呼ばれる領域がeIF2γに結合しており、eIF2Bによる活性化反応(GDP/GTP変換反応)が行われている構造が捉えられました(図2上段)。一方、リン酸化されたeIF2との複合体では、HEATドメインは特定の位置に固定された状態として観察されず、活性化反応が阻害されている状態が捉えられました(図2下段)。このときeIF2γは、eIF2Bとは強く結合しておらず、代わりにリン酸化eIF2αがeIF2Bの主要な結合領域となっていました。
そこで次に、eIF2Bとリン酸化eIF2αの結合状態をより詳しく観察するために、eIF2BとeIF2αのみを用いて結晶を作製し、大型放射光施設「SPring-8[8]」にてX線結晶構造解析[9]を行いました。その結果、この複合体ではリン酸化されていないeIF2αも、リン酸化型と同じ結合状態が観察されました。しかし、リン酸化型eIF2αのほうが、eIF2Bに向かってより深く入り込み(図3A)、より安定に結合していました。この差異が、リン酸化によって結合状態が切り替えられる要因の一つであると考えられます。
また、eIF2Bは5種類のサブユニット2分子ずつから構成される2回対称(180度回転させると元と同じ姿になる)の構造を持ち、一つのeIF2Bに二つのeIF2が結合できます(図3B左)。しかし、リン酸化されたeIF2が一つでも結合すると、その反対側でのeIF2Bの非リン酸化eIF2との相互作用領域まで覆ってしまうため、結合が妨げられます(図3B右)。このように、eIF2のリン酸化は、リン酸化されたeIF2自体の活性化を防ぐだけでなく、他のeIF2の活性化をも防ぐ機構となっていると考えられます。
今後の期待
本研究から、eIF2とeIF2Bが結合した翻訳開始因子複合体には大きく異なる二つの結合状態が存在し、eIF2のリン酸化によってこの切り替えが行われ、eIF2Bの活性が制御されることが明らかになりました。
eIF2のリン酸化による翻訳制御機構の構造生物学的な理解は、eIF2Bを標的とした薬剤の作用機序の解明や、より効果の高い薬剤の開発へ向けた基礎となります。また、この制御機構自体も翻訳後修飾や他の翻訳開始因子によってさらに調節されており、今回の成果から、細胞のストレス応答が関与する神経変性疾患などの分子機構の解明や新規治療標的の発見などへの展開が期待できます。
原論文情報
Kazuhiro Kashiwagi, Takeshi Yokoyama, Madoka Nishimoto, Mari Takahashi, Ayako Sakamoto, Mayumi Yonemochi, Mikako Shirouzu, Takuhiro Ito, “Structural Basis for eIF2B Inhibition in Integrated Stress Response”, Science, 10.1126/science.aaw4104
発表者
理化学研究所
生命機能科学研究センター 翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(いとう たくひろ)
研究員 柏木 一宏(かしわぎ かずひろ)
お問い合わせ先
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 翻訳開始因子
- 細胞内でタンパク質の合成(翻訳)を行うリボソームが、合成を開始する際に協調的に働くタンパク質群。真核生物の翻訳開始因子は真核生物型開始因子(eIF; eukaryotic Initiation Factor)と呼ばれる。
-
- リン酸化
- タンパク質を構成するアミノ酸のうち、セリン、スレオニン、チロシン残基の持つ水酸基(-OH)にリン酸基が付加される反応をタンパク質のリン酸化と呼ぶ。リン酸基の付加は、しばしばタンパク質の構造変化を招き、細胞内シグナル伝達の制御などに重要な役割を果たす。
-
- ストレス応答
- 熱ショック、活性酸素、高浸透圧、紫外線、放射線など、環境からのストレスに対して細胞が示す反応。細胞の恒常性維持に働くほか、細胞死を誘導する場合もある。
-
- 神経変性疾患
- 神経細胞の変性・脱落を伴う病気の総称。異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起きると考えられている。前頭側頭葉変性症(FTLD)、アルツハイマー型認知症、パーキンソン病、プリオン病、筋萎縮性側索硬化症(ALS)などが知られている。
-
- サブユニット
- タンパク質が集まってできた複合体の中の構成単位のこと。通常はポリペプチド鎖で連なった1つのタンパク質分子に相当する。
-
- Gタンパク質、GTP、GDP
- グアニンヌクレオチドが結合するタンパク質をGタンパク質と総称する。グアノシン三リン酸(GTP)が結合した場合とグアノシン二リン酸(GDP)が結合した場合で、タンパク質機能を切り替えるものが多く、Gタンパク質に結合したGTPを加水分解してGDPに変換する酵素や、結合したGDPをGTPに交換するタンパク質の制御を受ける。
-
- クライオ電子顕微鏡法
- 生体試料を液体エタンにより急速凍結し、ガラス状の氷に閉じ込め、透過型電子顕微鏡を用いて直接観察する手法。画像処理技術を駆使することで、リボソームなどの超分子複合体や、タンパク質複合体の三次元立体構造を得ることができる。
-
- SPring-8
- 理化学研究所が所有する、兵庫県の播磨科学公園都市にある放射光を生み出す共用施設。SPring-8の名前はSuper Photon ring-8 GeVに由来する。放射光とは、荷電粒子が磁場の中で曲がる際に放射される光の一種。SPring-8では、周回する電子群のサイズが小さいことや高い安定性のため、干渉性の優れたX線が得られる。
-
- X線結晶構造解析
- 物質の結晶を作り、それにX線を照射して得られる回折データを解析することにより、物質の内部構造を調べる方法。タンパク質の立体構造を原子レベルの分解能で詳細に解明するための最も有力な方法の一つである。
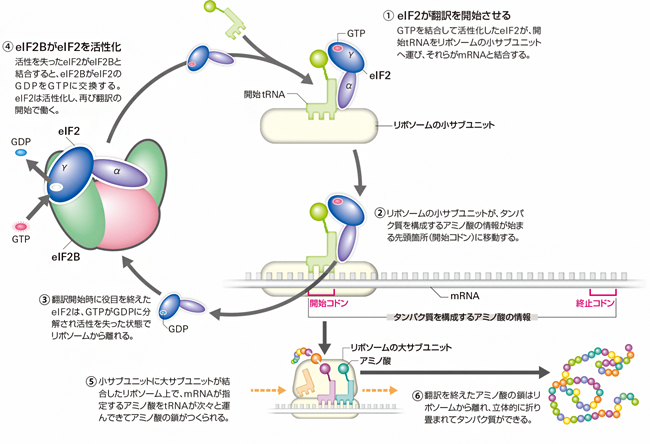
図1 真核生物の翻訳開始で働くeIF2BとeIF2
GTP結合型eIF2は、開始tRNAをリボソームに運び、翻訳を開始させる(①)。翻訳開始の役目を終えたeIF2はGDP結合型に変化するが(③)、eIF2Bと複合体を形成することで再びGTP結合型に戻り、次の翻訳開始に働く(④)。
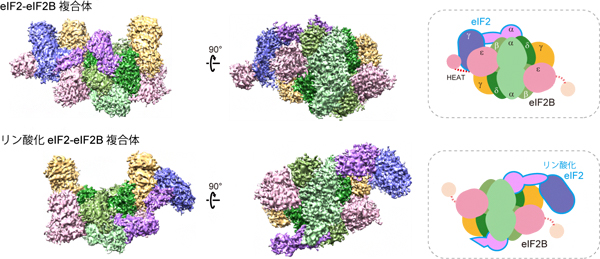
図2 ヒトeIF2-eIF2B複合体の構造
上段:非リン酸化eIF2とelF2Bの複合体の構造。右の模式図で示すように、eIF2γがeIF2Bの活性を担うHEATドメイン(赤点線およびピンクの円)に結合している。
下段:リン酸化eIF2とelF2Bの複合体の構造。HEATドメインは特定の位置に固定されておらず、eIF2αがeIF2Bと結合している。
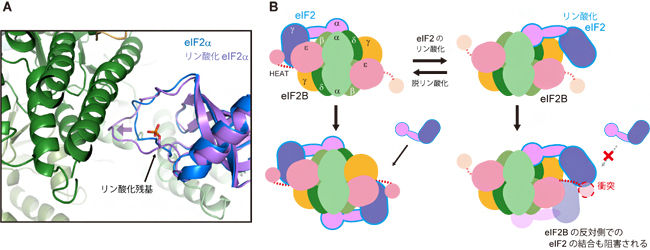
図3 eIF2のリン酸化による制御機構
(A) eIF2B-eIF2α複合体結晶構造中で観察された、リン酸化に伴う変化。リン酸化されたeIF2α(紫)は、非リン酸化eIF2α(青)より、eIF2B(緑)へ向かって深く入り込んでいることが分かる(紫色の矢印)。
(B) eIF2のリン酸化によるeIF2Bの活性制御のモデル。一つのeIF2Bには二つのeIF2が結合できる(左下)。しかし、eIF2Bにリン酸化eIF2が一つ結合すると、eIF2Bの反対側での非リン酸化eIF2との相互作用も阻害される(右下)。