2018-06-28 理化学研究所
理化学研究所(理研)開拓研究本部 田中生体機能合成化学研究室の田中克典主任研究員、リン・イシュアン国際プログラム・アソシエイト、ケンワード・ヴォン基礎科学特別研究員らの共同研究チーム※は、金触媒を用いることで、マウスの特定臓器上で炭素-炭素結合形成反応を経て2分子のカップリング[1]が起こることを発見しました。
本研究成果により、哺乳動物の体内で実施できる有機合成反応の範囲が格段に広がりました。近い将来、疾患部位における薬理活性分子の「現地合成」が可能になることで、副作用のない薬の実現が期待できます。
共同研究チームは2017年、マウスの特定の臓器上において3価の金触媒(Au3+)による、プロパルギルオキシ基[2]を持つエステル(プロパルギルエステル[2])と臓器表面上のアミノ基とのアミド化反応(求核置換反応)[3]を起こすことに成功しました。しかし、反応機構の詳細は分かっていませんでした。今回、反応過程における中間体や生成物などを調べた結果、ベンゼンとプロパルギルエステルのアセチレンとの間で、金触媒による炭素-炭素結合形成反応を経由して2分子のカップリングが起こっていることが分かりました。さらに、この反応機構をもとに、さまざまなタンパク質への、金触媒を利用した標識技術を確立しました。
本研究は、ドイツの科学雑誌『Chemistry – A European Journal』に掲載されるのに先立ち、オンライン版(5月23日付け)に掲載されました。
※共同研究チーム
理化学研究所 開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
国際プログラム・アソシエイト リン・イシュアン(Lin Yixuan)
基礎科学特別研究員 ケンワード・ヴォン(Kenward Vong)
埼玉大学 理工学部
教授 松岡 浩司(まつおか こうじ)
※研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)の研究領域「分子技術と新機能創出(研究総括:加藤隆史)」研究課題名「生体内合成化学治療:動物内での生理活性分子合成(研究者:田中克典)」の一環として行われました。
背景
生きている哺乳動物の体内で、金属触媒による有機合成反応(金属触媒反応)を自由に起こせるようになれば、疾患部位で選択的に薬理活性分子を合成することも夢ではありません。これが実現すると、優れた薬理活性を持つにもかかわらず副作用や体内での不安定さのために使用できなかった薬を、疾患部位で合成(現地合成)できるようになります。しかし、有機合成反応に必要な金属触媒などは、生体内に大量に存在するトリペプチド(三つのアミノ酸からなるペプチド)のグルタチオンによって活性が失われます。そのため、フラスコ内では金属触媒反応が起きても、哺乳動物体内では非常に難しいと考えられてきました。
田中克典主任研究員らは2016年、生体内での“金属触媒の運び屋”として、また体内のさまざまな生体分子から金属触媒を守る“触媒デリバリーシステム”として「糖鎖アルブミン[4]」を開発しました注1,2)。そして2017年には、この糖鎖アルブミンを「3価の金触媒(Au3+)」の運び屋として利用し、生きているマウスの肝臓や腸管に運ぶとともに、その臓器表面上にあるアミノ基とプロパルギルオキシ基を持つエステル(プロパルギルエステル)との間でアミド化反応(求核置換反応)を起こすことに成功しました注3)(図1)。これは、哺乳動物体内の標的臓器上で金属触媒反応を実現した初めての例となりました。
今回、共同研究チームは、①これまで実現が難しいと考えられてきた哺乳動物体内での金属触媒反応が、なぜこの実験系では効率的に進行したのか、そして②この反応がどのような機構で進行しているのかを、改めて詳しく調べることにしました。
注1)2016年2月23日プレスリリース「生体内部を高度に認識できる糖鎖複合体」
注2)2016年11月28日プレスリリース「糖鎖は不均一であることが重要」
注3)2017年2月15日プレスリリース「狙った臓器で金属触媒反応を実現」
研究手法と成果
2017年当初、共同研究グループは3価の金触媒がプロパルギルエステルのπ-親和性[5]部位であるアセチレンに配位することで、エステル部分の電子密度が低下し、臓器表面上にあるアミノ基の求核攻撃[3]が促進されてアミド化反応が起こると考えていました(図2上段)。そこで、さまざまな3価の金触媒を用いて、プロパルギルエステルとアミノ基とのアミド化反応をフラスコ内で試しました。その結果、配位子を持たない3価の金触媒を使った場合にはアミド化反応がゆっくりと進行したのに対して、2-ベンゾイルピリジンを配位子として持つ3価の金触媒を用いたときにはアミド化反応が著しく進行しました(図2下段)。
そこで、2-ベンゾイルピリジンを配位子として持つ3価の金触媒の反応機構について、中間体を検出し、アミド化反応が起こる過程を詳しく調べました。その結果、単純に3価の金触媒がプロパルギルエステルのアセチレンに配位して、エステル部分を活性化する触媒的な反応機構に加えて、図3の反応機構も並行して起こっていることが分かりました。
すなわち、2-ベンゾイルピリジンを配位子として持つ3価の金触媒とプロパルギルエステルが反応すると、まず3価の金の還元的脱離の過程を経て、2-ベンゾイルピリジンのベンゼンとプロパルギルエステルのアセチレンとの間で炭素-炭素結合が形成されます。この中間体では、金がピリジンの窒素原子とプロパルギルエステルのアセチレンとの間で挟まれています。このように、金がより強くπ-親和性部位であるアセチレンに配位することで、アミノ基によるプロパルギルエステルへの求核置換反応が促進されると考えられます。このような新しいプロパルギルエステルの活性化機構が、生体内でもアミド化反応が効率的に進むことを可能にしていると考えられます。
次に、図3で示した、フラスコ内におけるアミド化反応の反応機構を詳しく解析しました。その結果、以前行っていた動物内での反応においても、2-ベンゾイルピリジンのベンゼンとプロパルギルエステルのアセチレンとの間で、炭素-炭素結合形成反応を経た2分子のカップリングが起こっていたことが分かりました(図4)。
さらに、ここで明らかにした反応機構をもとにして、2-ベンゾイルピリジンを配位子として持つ金触媒を利用して、さまざまなタンパク質のアミノ基に対するプロパルギルエステルのアミド化反応を検討し、新しい標識技術として確立しました。
今後の期待
本研究では、生体内でも金属触媒反応による炭素-炭素結合形成反応を経た2分子カップリングが実施できることを証明しました。そして、共同研究チームが開発した、糖鎖アルブミンを基盤とした触媒デリバリーシステムや金属触媒の配位子をさらに検討することで、従来フラスコや細胞を対象としていた金属触媒によるカップリング反応が、生体内の特定の臓器上でも実施できることが示されました。
本研究成果は、哺乳動物の体内で実施できる有機合成反応の範囲を格段に広げました。近い将来、疾患部位における薬理活性分子の「現地合成」が可能になることで、副作用のない薬の実現が期待できます。
原論文情報
Yixuan Lin, Kenward Vong, Koji Matsuoka, and Katsunori Tanaka, “2-Benzoylpyridine ligand complexation with gold critical for propargyl ester-based protein labeling”, Chemistry – A European Journal, 10.1002/chem.201802058
発表者
理化学研究所
主任研究員研究室 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
国際プログラム・アソシエイト リン・イシュアン(Lin Yixuan)
基礎科学特別研究員 ケンワード・ヴォン(Kenward Vong)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- カップリング
- 2分子以上の分子が共有結合を介して結合し、新しい分子が生成する反応。有機合成化学の分野では、遷移金属を活用した効率的なカップリング反応に注目が集まっている。
-
- プロパルギルオキシ基、プロパルギルエステル
- プロパルギルオキシ基は、-O-C2H2C≡CHで表される三重結合を持つアルコキシ基。プロパルギルエステルは、カルボン酸(R-CO-OH)のOHがプロパルギルオキシ基で置換されたR-CO-O-C2H2C≡CHの構造式で表されるエステル。
-
- アミド化反応(求核置換反応)、求核攻撃
- 求核攻撃は反応の中心となる求電子剤に対して求核剤が攻撃すること。求核攻撃によって脱離基が脱離する反応を求核置換反応という。本研究のアミド化反応は求核置換反応の一つであり、求電子剤はエステルのカルボニル基(-C=O)の炭素原子(C)で、それに対して求核剤は1級アミンの窒素原子(N)である。Nの電子対がCを攻撃し、アルコキシ基が脱離することによりアミド結合が形成される。
-
- 糖鎖アルブミン
- 血清の主要タンパク質であるアルブミンに対して、人工的に糖鎖を付けた物質。
-
- π-親和性
- 二重結合や三重結合、芳香族環などの置換基はπ-電子が豊富である。この豊富なπ電子に対して結合しやすい状態をπ-親和性という。
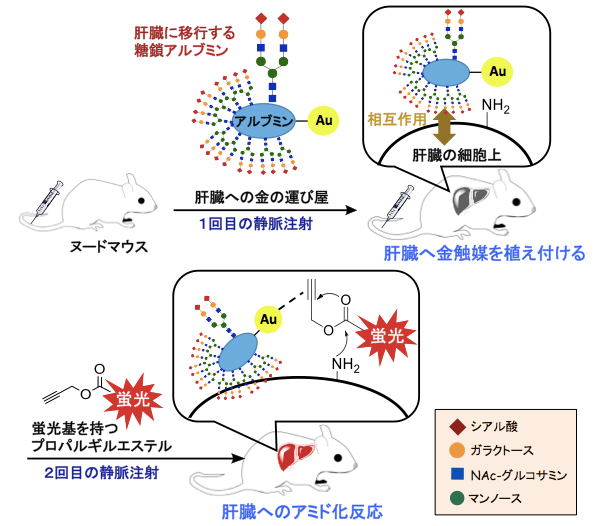
図1 金触媒を用いたマウス内の標的臓器におけるプロパルギルエステルのアミド化反応
マウス内の標的臓器(図では肝臓)に選択的に移行する糖鎖アルブミンを利用して、まず3価の金触媒(Au3+)を臓器に植え付けた。次に、同マウスにプロパルギルエステルを静脈注射すると、プロパルギルエステルが肝臓に達したときに、金触媒による臓器表面上のアミノ基(-NH2)とのアミド化反応(求核置換反応)が効率的に進行した。
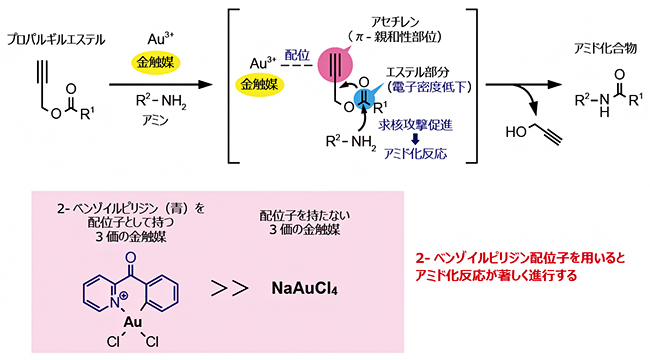
図2 金触媒によるプロパルギルエステルのアミド化反応
3価の金触媒(Au3+)がプロパルギルエステルのπ-親和性部位であるアセチレンに配位することにより、エステル部分の電子密度が低下し、アミンのアミノ基による求核攻撃が促進されアミド化反応(求核置換反応)が起こると考えられる。フラスコ内の実験で、配位子を持たない3価の金触媒(NaAuCl4)を使った場合にはアミド化反応はゆっくりと進行したのに対して、2-ベンゾイルピリジンを配位子として持つ3価の金触媒を用いたときにはアミド化反応が著しく進行した。
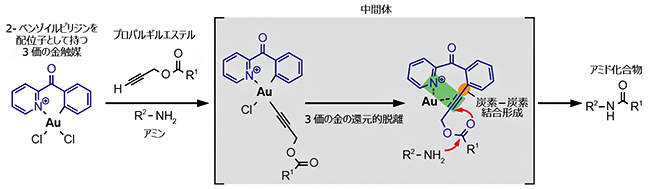
図3 2-ベンゾイルピリジンを配位子として持つ金触媒によるプロパルギルエステルのアミド化
2-ベンゾイルピリジン(青)を配位子として持つ3価の金触媒とプロパルギルエステルが反応すると、3価の金の還元的脱離の過程を経て、2-ベンゾイルピリジンのベンゼンとプロパルギルエステルのアセチレンとの間で炭素-炭素結合が形成される(オレンジの部分)。この中間体では、金がπ-親和性部位であるアセチレンにより強く配位することで(緑の部分)、アミンのアミノ基(-NH2)によるアミド化反応(赤の矢印)が促進される。
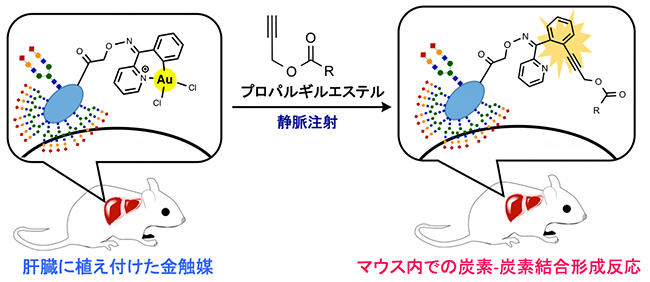
図4 哺乳動物内での金触媒を用いた炭素-炭素結合形成反応
多種多様な物質が共存する生体内の特定の臓器上でも、今回解明した臓器表面上にあるアミノ基とプロパルギルエステルとのカップリング反応に限らず、さまざまなカップリング反応を実施できる。