2021-11-12 理化学研究所
理化学研究所(理研)生命医科学研究センター免疫転写制御研究チームの谷内一郎チームリーダーらの国際共同研究グループは、米国で見つかった原発性免疫不全症(PID)の家族症例の解析から、PIDの新しい原因遺伝子変異としてAIOLOS転写因子[1]をコードする遺伝子の「ミスセンス変異[2]」を同定しました。
本研究成果は、PID病態のさらなる解明や治療応用へ貢献すると期待できます。
PIDは、先天的な遺伝子変異が原因で免疫細胞の分化異常や機能異常が起こり、免疫系が機能不全となるために感染症を繰り返す難病です。その原因となる遺伝子変異はさまざまで、それによって病態も異なります。
今回、国際共同研究グループは、血液中の抗体量の低下、B細胞やT細胞の減少が見られ、肺炎を繰り返し発症するPIDの家族症例を見つけました。全エクソーム解析[3]により原因遺伝子を探索したところ、AIOLOS遺伝子にN160S(160番目のアミノ酸のアスパラギンがセリンに置換される)のミスセンス変異が見つかりました。N160S 変異型AIOLOSの機能を試験管内で解析したところ、DNAへの結合能が変化していることが分かりました。また、マウスに同一の変異を導入することで、ヒトの患者と同様なPIDの症状が再現されることを見いだしました。これにより、AIOLOS遺伝子のN160S変異がヒトPIDの新しい原因遺伝子変異であることが証明され、病態の解明に重要な知見をもたらしました。
本研究は、科学雑誌『Journal of Experimental Medicine』(12月6日号)の掲載に先立ち、オンライン版(10月25日付)に掲載されました。
背景
原発性免疫不全症(PID)は、先天的な遺伝子変異が原因で免疫細胞の分化異常や機能異常が起こり、免疫系が機能不全となるために感染症を繰り返します。時には生後間もなく重篤な感染症にかかり死亡する可能性もあることから、PIDは迅速な診断と適切な治療を必要とする難病指定疾患です。その原因となる遺伝子変異はさまざまで、それによってPIDの病態も異なります。
AIOLOS転写因子はIKAROS転写因子ファミリーの一員であり、特定のDNA配列に結合して、遺伝子の発現を調節します。IKAROS転写因子ファミリーは、それ自体、あるいはファミリーメンバーと二量体[4]を形成することで機能します。主に血球系細胞で発現しており、リンパ球をはじめとする免疫細胞の発生に重要な働きをすることが知られています。
AIOLOS転写因子はIKZF3遺伝子(通称AIOLOS遺伝子)にコードされており、B細胞をはじめとするさまざまな免疫系細胞で発現が見られます。遺伝子を改変しAIOLOSを完全に欠損させたマウスでは、自己抗体[5]産生などのB細胞の機能異常が見られますが、B細胞の初期発生では大きな変化は示されず、AIOLOSの変異がPIDの原因となるかは不明でした。
谷内一郎チームリーダーらは2021年に東京医科歯科大学との共同研究において、B細胞欠損を特徴とするPID家族症例の原因遺伝子変異が、AIOLOS遺伝子の159番目のアミノ酸のグリシン(G)がアルギニン(R)へ置換される「G159Rミスセンス変異」であることを発表しました注1)。また、AIOLOS転写因子のN160(160番目のアスバラギン)に相当する、IKAROS転写因子ファミリーのN159(159番目のアスパラギン)のミスセンス変異がPIDの原因であることが海外の研究で報告されています。
注1)2021年6月21日プレスリリース「新たな疾患発症メカニズムによる免疫不全症(AIOLOS異常症)の発見」
研究手法と成果
原発性免疫不全症(PID)の家族症例における遺伝子解析
PIDは早期の対応が必要な疾患であり、国際的な研究協力関係が構築されています。PIDは、その原因となる遺伝子変異を同定することが重要であり、近年性能が飛躍的に向上している次世代シークエンサー[6]で、タンパク質をコードする遺伝子の配列を全て解読する全エクソーム解析を用いて、原因遺伝子変異を探索する方法が汎用されています。
国際共同研究グループは、血液中の抗体量の低下、B細胞やT細胞の減少が見られ、肺炎を繰り返し発症するPIDの米国の家族症例を見つけました。PID症状がある患者と健康な親、兄弟のDNAサンプルについて、全エクソーム解析したところ、AIOLOS遺伝子の160番目のアミノ酸のアスパラギン(N)がセリン(S)に置換される「N160Sミスセンス変異」を同定しました。
AIOLOS転写因子が属するIKAROS転写因子ファミリーは、タンパク質の中央に4個、C末端側に2個のジンクフィンガー領域[7]を持っており、特に中央のジンクフィンガー領域はDNAと結合するのに重要です。
加えて前述のように、AIOLOSのN160に相当するIKAROSのN159残基のミスセンス変異がPIDの原因であること、AIOLOSではN160の隣のG159残基のアルギニン(R)への置換を来たすG159R変異がPIDの原因となることがこれまでに分かっています注1)。これらの背景から、今回はAIOLOS N160S変異に着目し、N160S変異型AIOLOSの機能を調べました。
試験管内で転写因子と特定の配列を持つDNA断片との結合を調べるEMSA[8]という方法で、正常のAIOLOSとN160S変異型のAIOLOSのDNA結合能を調べた結果、N160S変異型AIOLOSは正常AIOLOSが認識するDNA配列へ結合する能力を喪失していました。また、正常AIOLOSとN160S変異型AIOLOSを同時に発現させると、正常AIOLOSのDNA結合能が減弱し、細胞内局在も影響され、正常な核内染色パターンが消失することが分かりました。この結果は、N160S変異型AIOLOSの存在により、正常AIOLOSの機能が阻害されることを示しており、N160S変異型AIOLOSはドミナントネガティブ変異体[9]として機能することが判明しました。
ヒト変異と同一の変異を持つ遺伝子改変マウスの作製と解析
試験管内でのN160S変異型AIOLOSの機能解析結果は、この変異が前述のPID家族症例の原因遺伝子変異であることを強く示唆していますが、現時点では検証不十分です。このような場合、同じ変異を持つ複数の患者を見つけること、または動物に同じ変異を導入して、患者と同じ病態を示すかを調べる必要があります。
谷内一郎チームリーダーらは、2021年にAIOLOS G159R変異を導入した遺伝子改変マウスを作製し、作製したマウスではB細胞が減少したことを報告しました注1)。そこで、CRISPR/Cas9ゲノム編集技術[10]を用いて、ヒトAIOLOS N160S変異に相当するAiolos N159S変異を導入した遺伝子改変マウス(ヘテロ変異接合体[11]とホモ変異接合体[11])を作製しました。作製したマウスでは、ヒトの患者と同様にT細胞およびB細胞の分化異常が見られました。
患者と同じヘテロ変異接合体のマウスでは、脾臓における成熟した濾胞性B細胞[12]やパイエル板[13]における濾胞性Tヘルパー細胞[14]の減少が見られました。ホモ変異接合体のマウスでは、上記の免疫細胞の発生障害がより顕著で、血清中の抗体価(具体的にはIgM、IgG、IgAの量)はヘテロ変異接合体のマウスでは、やや年を取ったマウスでIgMの低下が見られました。一方で、ホモ変異接合体のマウスでは、若年からIgM、IgG、IgA全てが低下することが分かりました。
以上の結果から、Aiolos N159S変異は、マウスでもヒトPIDと同様なB細胞およびT細胞の発生障害というヒトの患者と類似のPID表現型を示したことから、AIOLOS N160S変異が今回のPID家族症例の原因遺伝子変異であることを証明しました。
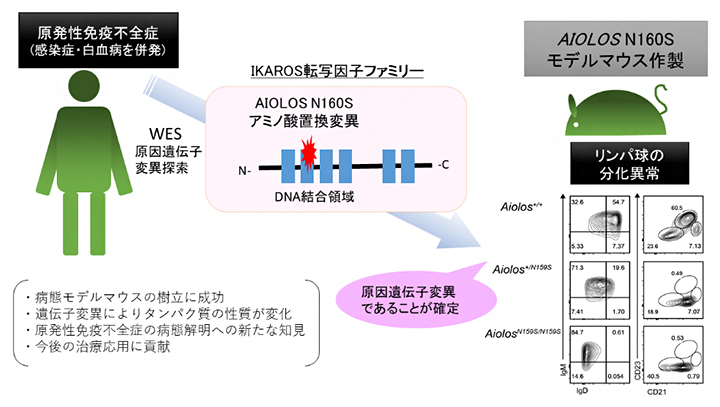
今回の研究の流れと要点
原発性免疫不全症と診断された家族症例で疾患発症の原因となる遺伝子変異を同定するために、全エクソーム解析を行い、候補としてAIOLOS遺伝子のN160Sアミノ酸置換が起こるミスセンス変異を抽出した。同じアミノ酸置換変異をマウスに導入すると、ヒトの患者と類似B細胞の分化異常が観察され、AIOLOS遺伝子のN160S変異が疾患発症の責任変異であることを確認した。
今後の期待
今回の研究は、Aiolos N159S変異マウスでヒトの患者と同じような免疫不全症が再現できるかという点に重きを置きました。そのため、AIOLOS N160S変異がどのようにしてリンパ球を中心として免疫細胞の発生を障害するのかという分子機序についてはまだ不明です。治療という側面では、創薬の分子標的を明らかにすることが重要であり、今後Aiolos N159S変異マウスを用いた研究により、分子病態が解明されるものと期待できます。
これまでに国際共同研究グループは、AIOLOS G159R、N160S変異のモデルマウスを作製・解析しましたが、IKAROS N159S変異のモデルマウスはまだ検証段階にあります。今後は、IKAROS N159S変異モデルマウスの作製・解析を行うことで、IKAROS転写因子のファミリータンパク質間における類似の変異により、どのような分子機序で疾患が発症するかを解明し、転写因子のミスセンス変異(一アミノ酸置換)を原因とする疾患の発症機序を明確にしていく予定です。
補足説明
1.転写因子
特定のDNA配列に結合し、遺伝子発現の促進または抑制を調節するタンパク質。
2.ミスセンス変異
DNA配列の変化により、発現するタンパク質のアミノ酸が置換される変異。変異によって異常タンパク質が合成されるため、疾患の原因になることがある。
3.全エクソーム解析
ゲノムのタンパク質をコードする遺伝子領域(エクソン)の配列を全て読むことで、タンパク質の変異を伴う遺伝子変異を検出する手法。ゲノム配列を全て読む全ゲノム解析より低コストなため、疾患の原因遺伝子を探る際に広く用いられる。
4.二量体
2分子のタンパク質がまとまって一つの分子を成す状態。同一のタンパク質で構成されればホモ二量体、別々のタンパク質で構成されればヘテロ二量体となる。
5.自己抗体
自分自身のタンパク質に反応する抗体。自己免疫疾患の発症原因となる。
6.次世代シークエンサー
核酸(DNA)の配列を読解する性能が上昇した(次世代)遺伝子配列解析装置(シークエンサー)の総称。
7.ジンクフィンガー領域
亜鉛イオンと結合することでDNAと結合するタンパク質上の領域。転写因子に多く見られ、遺伝子発現の調節に重要な役割を果たす。
8.EMSA
タンパク質とDNAの相互作用を評価する実験法。DNAがタンパク質と結合しているか否かでゲル電気泳動の移動度に差が生じることから、分離・検出する。EMSAはElectrophoresis Mobility Shift Assayの略。
9.ドミナントネガティブ変異体
正常のタンパク質に対してその機能を優勢に阻害する変異体。
10.CRISPR/Cas9ゲノム編集技術
最も多く応用されている遺伝子編集技術の一つ。ゲノム上の任意の配列に対してDNA二重鎖切断を誘導することで、修復の際に目的の遺伝子変異を導入する。
11.ヘテロ変異接合体、ホモ変異接合体
2個ある染色体のうち、ある遺伝子変異を一つで保有するものをヘテロ接合体、両方に保有するものをホモ接合体と呼ぶ。
12.濾胞性B細胞
二次リンパ組織(免疫反応の場)にあるB細胞の一種。
13.パイエル板
腸管の外側の二次リンパ組織(免疫反応の場)であり、発見者の名前からパイエル板と呼ばれる。
14.濾胞性Tヘルパー細胞
二次リンパ組織の濾胞杯中心に存在し、抗原に対し高親和性を示すB細胞の産生に重要なヘルパーT細胞の一種。
国際共同研究グループ
理化学研究所 生命医科学研究センター 免疫転写制御研究チーム
チームリーダー 谷内 一郎(たにうち いちろう)
研究員 奥山 一生(おくやま かずき)
特別研究員 チェンチェン・ゾウ(Chengcheng Zou)
国際プログラム・アソシエイト ジングジー・チャン(Jingjie Chang)
研修生 原田 淳司(はらだ じゅんじ)
東京医科歯科大学 発生発達病態学分野
教授 森尾 友宏(もりお ともひろ)
助教 山下 基(やました もとい)
アメリカ国立衛生研究所 Immunology Service, Department of Laboratory Medicine
教授 ローゼンバーグ ・セルジオ(Sergio D. Rosenzweig)
研究員 キューエン・ヘイサン(Hye Sun Kuehn)
研究支援
本研究は、理化学研究所生命医科学研究センターPIDプロジェクト「免疫不全症研究への取り組み」による支援を受けて行われました。
原論文情報
Kuehn HS, Chang J, Yamashita M, Niemela JE, Zou C, Okuyama K, Harada J, Stoddard JL, Nunes-Santos CJ, Boast B, Baxter RM, Hsieh EWY, Garofalo M, Fleisher TA, Morio T, Taniuchi I, Dutmer CM, Rosenzweig SD., “T and B cell abnormalities, pneumocystis pneumonia, and chronic lymphocytic leukemia associated with an AIOLOS defect in patients”, Journal of Experimental Medicine, 10.1084/jem.20211118
発表者
理化学研究所
生命医科学研究センター 免疫転写制御研究チーム
チームリーダー 谷内 一郎(たにうち いちろう)
報道担当
理化学研究所 広報室 報道担当