2022-03-02 国立がん研究センター,神戸大学,日本医療研究開発機構
発表のポイント
- 術後再発リスクの高い頭頸部がん患者さんを対象に、従来の標準治療(シスプラチン3週毎+放射線治療)に対して、シスプラチン毎週投与+放射線治療の非劣性を世界で初めて検証しました。
- 検証の結果、全生存期間の非劣性が証明され、副作用がより軽いことがわかりました。
- 本試験の結果、シスプラチン毎週投与+放射線治療が新たに標準治療となり、今後頭頸部がん患者さんに対してより安全で、エビデンスに基づいた術後補助療法を提供することが可能となります。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:島田和明、所在地:東京都中央区)が、中央支援機構(データセンター/運営事務局)を担い支援する日本臨床腫瘍研究グループ(JCOG)では、科学的証拠に基づいて患者さんに第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立するため、専門別研究グループで全国規模の多施設共同臨床試験を実施しています。
この度、JCOGの頭頸部がんグループでは、術後再発リスクの高い頭頸部がん患者さんを対象に、従来の標準治療(シスプラチン3週毎+放射線治療)に対して、シスプラチン毎週投与+放射線治療の非劣性を検証するランダム化比較第II/III相試験を実施しました。
中間解析の結果、全生存期間の非劣性が証明されました。さらに、シスプラチン毎週投与+放射線治療は、有害事象の発現頻度がより低いことも確認しました。その結果、術後再発リスクの高い頭頸部がん患者さんに対して、シスプラチン毎週投与+放射線治療が新たに標準治療となります。
本臨床試験の計画およびシスプラチン3週毎+放射線治療に対して、シスプラチン毎週投与+放射線治療が非劣性を示したのは世界初です。今後、日本のみならず、海外のガイドラインでも新たな標準治療に書き換えられ、頭頸部がん患者さんにさらに有効な治療が提供されることが期待されます。
本研究の成果は、米国学術雑誌「Journal of Clinical Oncology」に日本時間2022年3月2日(米国時間3月1日)付で発表されました。
背景
頭頸部がんの90%以上は、扁平上皮癌という組織型であることから、頭頸部扁平上皮癌を対象に臨床試験が実施され、標準治療(科学的根拠に基づいた観点で、現在利用できる最良の治療)が確立されてきました。ステージ3、4の切除可能な局所進行頭頸部扁平上皮癌は、術後に放射線治療を行った場合でも、局所再発、遠隔転移の頻度は高く、5年生存割合40%と予後も不良です。特に、切除断端陽性*1、頸部リンパ節の節外浸潤陽性*2、頸部リンパ節転移の多発、大きなリンパ節転移などは、再発リスクが高い因子と認識されています。
治療効果や安全性の向上を目指して、術後の放射線治療に抗がん薬シスプラチンを同時併用する治療の開発が行われてきました。術後再発するリスクが高い因子を有する頭頸部扁平上皮癌患者さんを対象とした術後放射線治療とのランダム化比較試験*3の結果、シスプラチン100 mg/m2を3週毎に3コースを放射線治療と同時併用する化学放射線療法(シスプラチン3週毎+放射線治療)は、再発を抑える効果が優れていることが示され、術後補助療法の新たな標準治療になりました。
しかし、1)吐き気、腎機能障害などの副作用が強い、2)副作用のために投与量を減らすことも多く、指示通りに治療を計画することが難しい、3)副作用のために長期の入院が必要である、4)術後の手術部位が感染するリスクが高まるなどを理由に、医師が治療提示を避けることが多く、普及してきませんでした。そのため、術後補助化学療法単独、術後放射線治療単独などの治療が頻用されている状況でした。
実臨床では、副作用の軽減を期待してシスプラチンの用量を30~40mg/m2に減らし、毎週投与する化学放射線療法(シスプラチン毎週投与+放射線治療)が頻用されてきました。しかし、標準治療であるシスプラチン3週毎+放射線治療との比較試験が行われていないため、シスプラチン毎週投与+放射線治療が、標準治療と同等の治療効果を示すかどうか明らかになっていませんでした。そのため、効果がわからない治療が実臨床で頻用されていることが問題視されていました。
研究方法と成果
頭頸部がんの術後補助療法の安全性・有効性を比較するためには、十分な精度をもった検証的な臨床試験が不可欠です。そこで、JCOGの頭頸部がんグループでは、日本の代表的な頭頸部がんの専門施設を中心に、術後再発リスク因子を有する頭頸部扁平上皮癌患者さんを対象に、標準治療であるシスプラチン3週毎+放射線治療に対して、シスプラチン毎週投与+放射線治療の非劣性を検証するランダム化比較第II/III相試験(JCOG1008/研究代表者:国立がん研究センター東病院 頭頸部内科科長 田原 信/研究事務局:神戸大学医学部附属病院 清田 尚臣)を実施しました。
(臨床研究実施計画・研究概要公開システム )
シスプラチン3週毎+放射線治療、シスプラチン毎週投与+放射線治療ともに実臨床で実施されていましたが、本試験計画時点で、両群の治療とも、参加施設では実施経験が少なく、実施可能性および安全性の情報は十分ではないと判断されました。そこで、第II相部分で両群の治療の安全性を確認し、第III相試験として試験を継続することが適切であるかを判断した後に、引き続いて第III相部分を行うランダム化第II/III相試験を実施しました。第II相部分は、各群33例、両群66例とし、第III相部分は、各群130例、両群260例としました。主要評価項目は、第II相部分が治療完遂割合、第III相部分が全生存期間としました。
対象の主な組み入れ規準は、年齢が20~75歳、口腔・中咽頭・下咽頭・喉頭のいずれかに原発巣を有する頭頸部がん、組織学的に扁平上皮癌と診断、術後の診断にてステージIII/IVA/IVBのいずれかと診断、切除断端陽性あるいはリンパ節外浸潤の術後再発高リスク因子を有する、遠隔転移を有さない、全身状態が良好(ECOG PSが0または1)である、十分な臓器機能を有する、他のがんに対する治療も含めて、放射線治療、抗がん薬、ホルモン療法いずれも受けた経験がないことなどとしました。
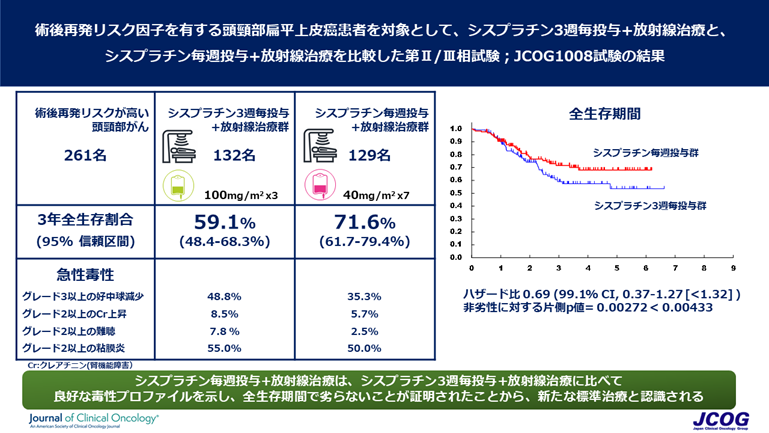
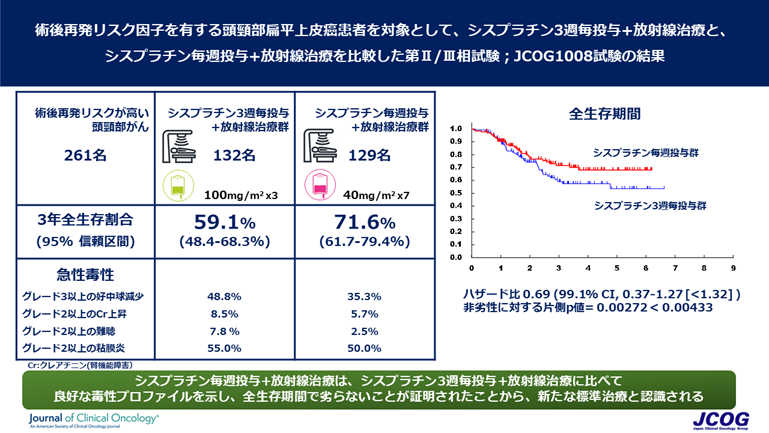
登録された患者さんは1:1にシスプラチン3週毎+放射線治療(シスプラチン3週毎投与群)かシスプラチン毎週投与+放射線治療(シスプラチン毎週投与群)に割り付けられ、どちらかの治療を受けました。2012年10月から2015年2月までに第II相分の登録が66例に達し、JCOG効果・安全性評価委員会にて試験の継続が認められ、第III相部分に移行し、2018年12月21日に261例で登録を完了しました(シスプラチン3週毎投与群132例、シスプラチン毎週投与群129例)。
第III相試験における2回目の中間解析を実施したところ、フォローアップ期間中央値2.2年において、3年生存割合はシスプラチン3週毎投与群59.1%、シスプラチン毎週投与群71.6%とシスプラチン毎週投与群にて良好な傾向を示しました。この結果、シスプラチン毎週投与+放射線治療がシスプラチン3週毎+放射線治療に比べて全生存期間で劣らないことが証明されました。
また、シスプラチン毎週投与群はシスプラチン3週毎投与群と比較して、グレード3以上の好中球減少(35.3% vs. 48.8%)、グレード2以上のクレアチニン上昇(5.7% vs. 8.5%)、グレード2以上の難聴(2.5% vs. 7.8%)、グレード2以上の粘膜炎(50.0% vs. 55.0%)など、急性期にみられる副作用が軽いことも示されました。
展望
本試験の結果、シスプラチン毎週投与+放射線治療が標準治療であることがガイドラインに記載され、新たな標準治療となることから、今後患者さんに対してより安全で、エビデンスに基づいた治療を提供することが可能となります。
また、シスプラチン毎週投与+放射線治療は、副作用が軽く、外来でも実施可能であることから、今まで術後補助療法を避けてきた患者さんに対しても術後補助療法が適切に実施されるようになり、頭頸部がん患者さん全体の予後改善が期待されます。
発表論文
- 雑誌名
- Journal of Clinical Oncology
- タイトル
- Weekly Cisplatin Plus Radiation for Postoperative Head and Neck Cancer (JCOG1008): A Multicenter, Noninferiority, PhaseⅡ/Ⅲ Randomized Controlled Trial
- 著者
- Naomi Kiyota, Makoto Tahara, Junki Mizusawa et.al
- DOI
- 10.1200/JCO.21.01293
- URL
- https://ascopubs.org/doi/abs/10.1200/JCO.21.01293
- 掲載日
- 2022年3月2日
研究費
- 国立がん研究センター研究開発費
- 成人固形がんに対する標準治療確立のための基盤研究(26-A-4、29-A-3、2020-J-3)
進行頭頸部がんに対する化学放射線療法を中心とした集学的治療の開発に関する共同研究 (23-B-2、25-B-2)
放射線治療を含む標準治療確立のための多施設共同研究(23-A-21) - 厚生労働科学研究委託費 革新的がん医療実用化研究事業
- 進行頭頸部がんに対する術後補助療法の標準治療確立のための多施設共同研究」(H26-革新的がん- 一般-052)
- 国立研究開発法人日本医療研究開発機構(AMED)
- 革新的がん医療実用化研究事業
「進行頭頸部がんに対する術後補助療法の標準治療確立のための多施設共同研究」
(15ck0106055h0002、17ck0106321h0001、20ck0106596h0001)
試験実施施設
本試験は全国28施設の協力を得て実施されました。
参考:臨床研究実施計画・研究概要公開システム
(1特定臨床研究の実施体制に関する事項及び特定臨床研究を行う施設の構造設備に関する事項>(4)多施設共同研究における研究責任医師に関する事項等)
日本臨床腫瘍研究グループ(JCOG)の概要
日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)は、新しい治療法の開発や検証的試験の実施を通じて、科学的証拠に基づいて第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立することを目的として研究活動を行っています。各種がんの治癒率の向上とがん治療の質の向上を図ることを目標としています。
JCOGは国立がん研究センター研究開発費、日本医療研究開発機構研究費を主体とする公的研究費によって助成される研究班を中心とする多施設共同臨床研究グループで、がん診療連携拠点病院を中心とした医療機関の研究者で構成される専門分野別研究グループと国立がん研究センターが管轄する各種委員会、中央支援機構(国立がん研究センター中央病院臨床研究支援部門)から構成されており、法人格を有さない任意団体です。
用語解説
- *1 切除断端陽性
- 切除断端にがん細胞が明らかに露出している状態。
- *2 節外浸潤陽性
- リンパ節に転移している腫瘍細胞がリンパ節被膜を越えて進展しているか、リンパ節周囲の軟部組織に浸潤している状態。
- *3 ランダム化比較試験
- 研究の対象者をランダムに分け(ランダム化)、治療法などの効果を検証すること。ランダム化により検証したい方法以外の要因がバランスよく分かれるため、公平に比較することができる。
お問い合わせ先
日本臨床腫瘍研究グループ(JCOG)
国立研究開発法人国立がん研究センター中央病院
臨床研究支援部門 研究企画推進部 多施設研究支援室
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室
国立大学法人神戸大学 総務部広報課
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部 医療技術研究開発課