2022-05-10 東京大学,科学技術振興機構
ポイント
- セレン含有たんぱく質であるセレノプロテインN(SELENON)は、セレンの高い還元作用を用いて、酸化ストレスから細胞を保護する役割がある。SELENONの発現制御は骨格筋の形成や機能に重要な役割を担っている。本研究は、筋分化の過程において、SELENON遺伝子が以下に示す2つの機構で発現制御されることを明らかにした。
- 筋分化の前期から中期にかけて、SELENONの前駆体mRNAの2次構造が変化し、RNA編集が導入されることで、異常なmRNAスプライシングが抑制され、SELENONたんぱく質の発現が維持されることが判明した。
- SELENONは21番目のアミノ酸として知られるセレノシステイン(Sec)を含んでおり、Secはリコーディングと呼ばれる特殊翻訳によって取り込まれる。筋分化の中期以降はリコーディング活性が低下し、SELENONの発現が低下することが明らかになった。リコーディング制御はこれまで報告されていない新規の現象であり、遺伝子発現制御の概念を大きく拡張させるものである。
- 本研究成果は、ヒト骨格筋形成のさらなる理解に加え、将来的にはSELENON関連疾患の治療法の開発や、加齢などによる筋力低下の改善につながることが期待される。
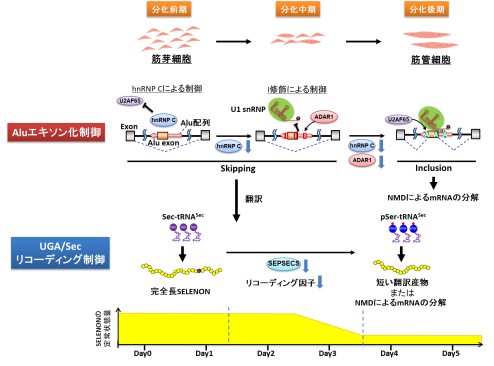
セレノプロテインN(SELENON)は活性中心に重金属であるセレンを含むセレン含有たんぱく質である。骨格筋が分化する過程において、細胞が一時的な酸化ストレスにさらされるが、SELENONはセレンの高い還元作用を用いて、酸化ストレスから細胞を保護する役割がある。SELENON遺伝子の変異はSELENON関連疾患と総称される重篤な筋疾患を引き起こすことから、SELENON遺伝子の正確な発現制御が骨格筋の形成や機能に不可欠である。骨格筋が分化する初期段階ではSELENONの発現が高く保たれ、分化が進むにつれてSELENONの発現が下がることが知られていたが、その仕組みはよく分かっていなかった。
東京大学 大学院工学系研究科化 学生命工学専攻の野田 悠太 大学院生(研究当時)、岡田俊平 特任研究員(研究当時)、鈴木 勉 教授のグループは、ヒトの筋芽細胞が骨格筋へと分化する前期と中期において、SELENONの発現が高く保たれ、後期において、発現量が徐々に低下する仕組みを明らかにした。その仕組みから、新規の遺伝子発現制御機構が見つかった。
SELENONのmRNA前駆体にはAlu反復配列が含まれており、mRNAスプライシングの過程でこの一部がエキソンとして取り込まれるとナンセンス変異依存mRNA分解機構(nonsense mediated mRNA decay、NMD)により発現が抑制される。筋分化の前期から中期にかけて、RNA結合たんぱく質とRNA修飾が、序列的に作用することで、Alu反復配列のエキソン化が抑制され、SELENONたんぱく質の発現が維持されることが判明した。
2つ目の制御機構は、特殊翻訳の制御である。SELENONはセレン含有たんぱく質であり、活性中心にセレノシステイン(Sec)残基を有している。Secは終止コドンの1つであるUGAコドンによりコードされ、リコーディングと呼ばれる特殊なたんぱく質合成によって取り込まれる。研究グループは、筋分化の中期から後期にかけて、多くのリコーディングに関与する因子の発現が低下することを見いだした。特にSecを受容したtRNASecが顕著に減少することで、UGA/Secコドンのリコーディングの効率が低下していることを明らかにした。この結果、筋分化の後期では、活性のあるSELENONが合成されず、またUGA/Secコドンが未成熟終止コドンとして認識されることで、SELENON mRNAはNMDの機構により分解され、発現量が低下することが明らかとなった。
本研究により明らかとなった段階的な転写後制御機構により、筋分化の過程でSELENONの発現が精密に制御されることが示された。今後は、これらの制御機構の生理的意義を明らかにすることで、骨格筋形成のさらなる理解に加え、将来的にはSELENON関連疾患の治療法の開発や、加齢などによる筋力低下の改善につながることが期待される。また本研究で示されたリコーディングの制御はこれまで報告されていない新規の現象であり、遺伝子発現制御機構の理解において大きな概念的進歩をもたらすものである。
本研究成果は、2022年5月6日(英国夏時間)に科学誌「Nature Communications」に掲載された。
本研究は、日本学術振興会(JSPS)の基盤研究(S)「RNAエピジェネティックスと高次生命現象」(代表:鈴木 勉、26220205)、基盤研究(S)「RNA修飾の変動と生命現象」(代表:鈴木 勉、18H05272)、新学術領域研究(研究領域提案型)「ncRNAのケミカルタクソノミ」(代表:鈴木 勉、26113003)、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「鈴木RNA修飾生命機能プロジェクト」(研究総括:鈴木 勉、JPMJER2002)の支援を受けて実施された。
<論文タイトル>
- “Regulation of A-to-I RNA editing and stop codon recoding to control selenoprotein expression during skeletal myogenesis”
- DOI:10.1038/s41467-022-30181-2
<お問い合わせ先>
<研究に関すること>
鈴木 勉(スズキ ツトム)
東京大学 大学院工学系研究科 化学生命工学専攻 教授
<JST事業に関すること>
加藤 豪(カトウ ゴウ)
科学技術振興機構 研究プロジェクト推進部 グリーンイノベーショングループ
<報道担当>
東京大学 大学院工学系研究科 広報室
科学技術振興機構 広報課