2020-04-16 東京大学
戸塚 隆弥(生物科学専攻 博士課程2年生)
大杉 美穂(総合文化研究科広域科学専攻 教授)
発表のポイント
- 精子ゲノムのみをもつ受精卵である雄性発生胚を、紡錘体の機能を軽度に阻害することにより簡単に作る方法を開発しました。
- 従来、雄性発生胚を作るためには、針を使って染色体を抜き取る除核や精子を注入する顕微授精といった難しい技術が使われていましたが、私たちの方法はこのような技術を一切使いません。
- 本手法により、技術的に敷居が高かった、哺乳類の受精時に精子核から受精卵の雄性前核(注1)へ転換する過程や、胚発生における精子ゲノムの役割についての研究が行いやすくなることが期待されます。
発表概要
東京大学大学院理学系研究科の戸塚隆弥大学院生、東京大学大学院総合文化研究科の大杉美穂教授は、紡錘体の機能阻害を利用して雄性発生胚を作る簡便な方法を開発しました。
哺乳類の精子および卵子のゲノム(注2)には機能的な差異があり、個体発生には両親由来のゲノムが欠かせません。発生過程での精子ゲノムの役割を調べるためには、卵子由来のゲノムは持たず精子由来のゲノムのみを持つ雄性発生胚がよく用いられます。従来は、細い針を使って卵子や受精卵から卵子由来のゲノムを抜き取る除核や、卵子に精子を注入する顕微授精といった難しい実験手技により作られていました。しかし、私たちは、こういった侵襲的で熟練の技が必要な操作を一切行わず、低濃度の微小管重合阻害剤(ノコダゾール)を含む培地中で体外受精するだけでマウスの雄性発生胚を作ることに成功しました。
受精後に精子核が雄性前核になる過程や、発生過程における精子ゲノムの役割はまだ完全には理解されておらず、研究すべき課題が多くあります。この研究分野は、熟練した技術を習得した研究者により行われてきましたが、今後は私たちの手法を用いることで多くの研究者がアプローチ可能になることが期待されます。
発表内容
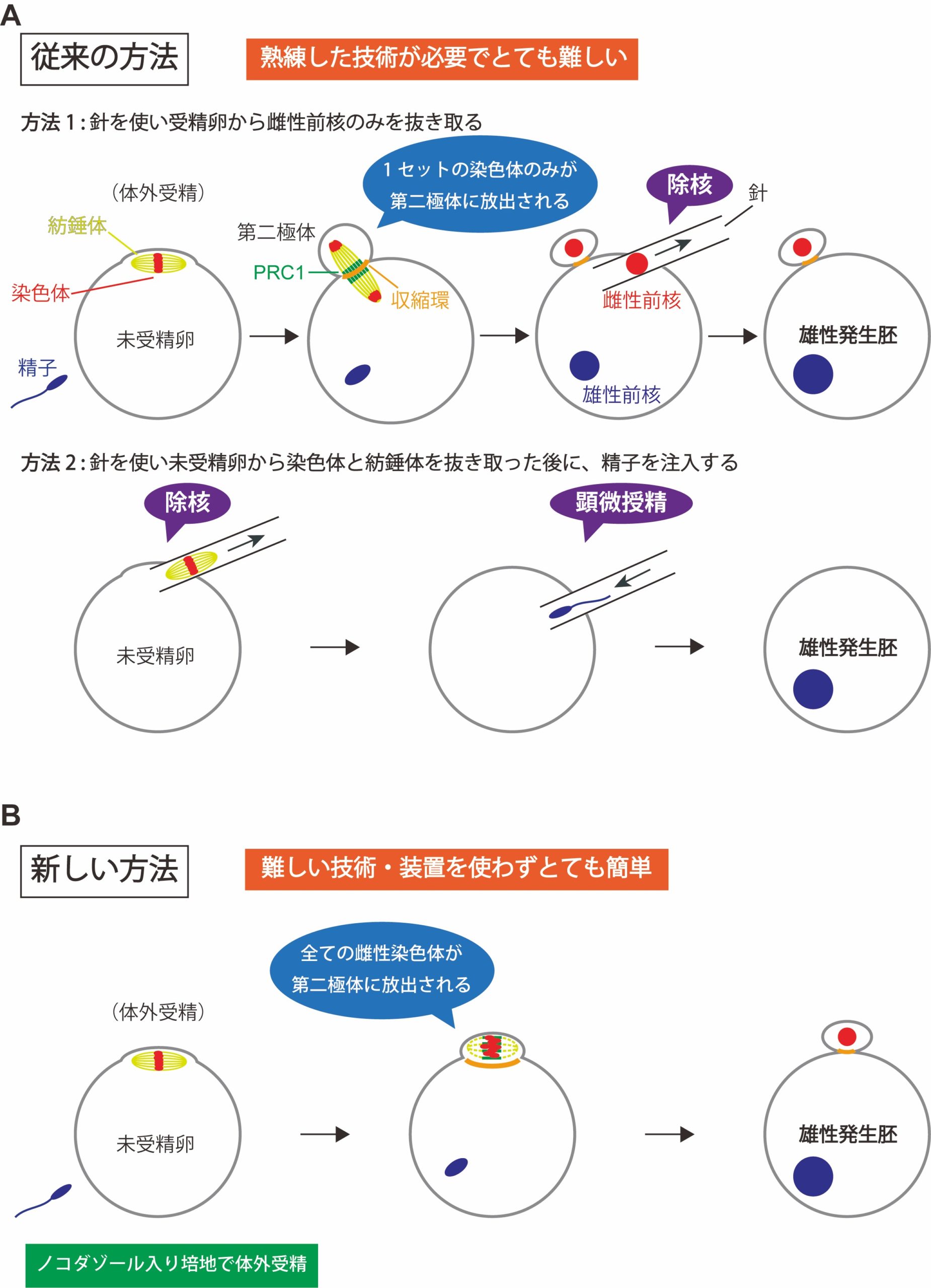
受精により卵子と精子が融合すると受精卵がつくられます。哺乳類の卵子は、減数第二分裂(注3)の中期(注4)で停止して精子がやってくるのを待ちます。精子の融合がきっかけとなり減数第二分裂の後期に進むと、紡錘体両極に分配した姉妹染色体は一方が第二極体(注5)として放出され、他方は雌性前核を形成します(図1A)。一方、精子ゲノムは受精後にクロマチンリモデリング(注6)を経て雄性前核を形成し、雌性前核とともに発生に使われます。精子および卵子由来のゲノムには機能的な差異があり、哺乳類の個体発生には両親由来のゲノムが欠かせません。このような差異は、片親由来のゲノムをもつ胚を作り解析することでわかってきました。雄性発生胚は、卵子由来のゲノムを持たない胚であり、受精後の精子ゲノムのクロマチンリモデリングや雄性前核の形成過程、初期発生における精子ゲノムの役割を調べるために有用です。しかし、雄性発生胚の作出には、卵子由来のゲノムを除去するための除核操作や、精子を注入する顕微授精といった熟練した実験手技(図1A)が必要で、技術的にとても敷居が高い研究分野です。したがって、この分野の研究を行える人は一部の研究者に限られています。
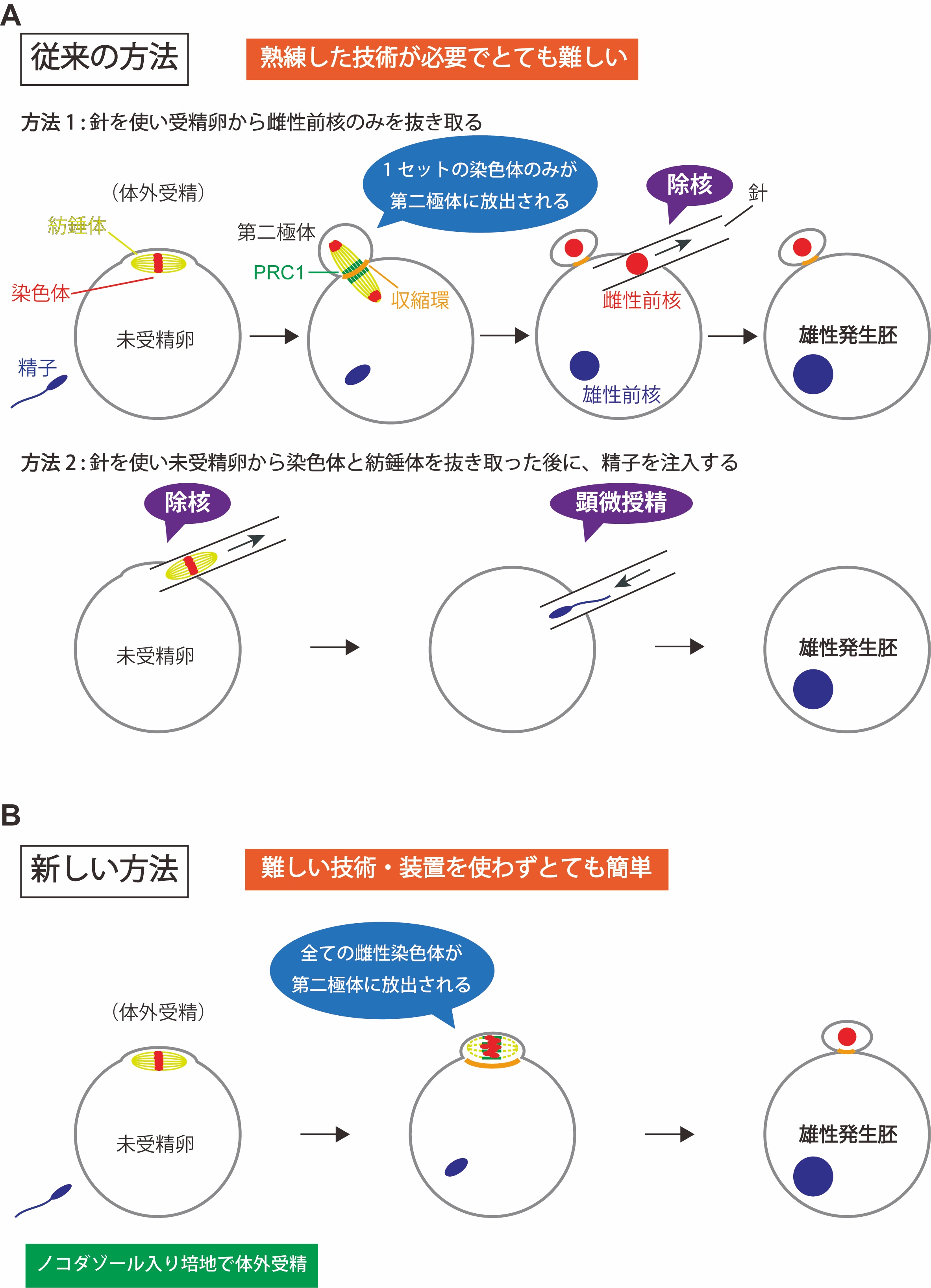
図1:雄性発生胚の作り方
方法1と方法2は、従来の雄性発生胚の作り方。方法1では、受精卵から、細いガラス針を使って雌性前核のみを細胞外に抜き取る。方法2では、減数第二分裂中期で停止している未受精卵から、細いガラス針を使って染色体と紡錘体を細胞外に抜き取ったのち、顕微授精により精子を注入する。新しい方法では、ノコダゾール入りの培地で体外受精を行うだけで、卵の染色体だけが全て極体として放出され、精子由来の染色体は受精卵に残る。
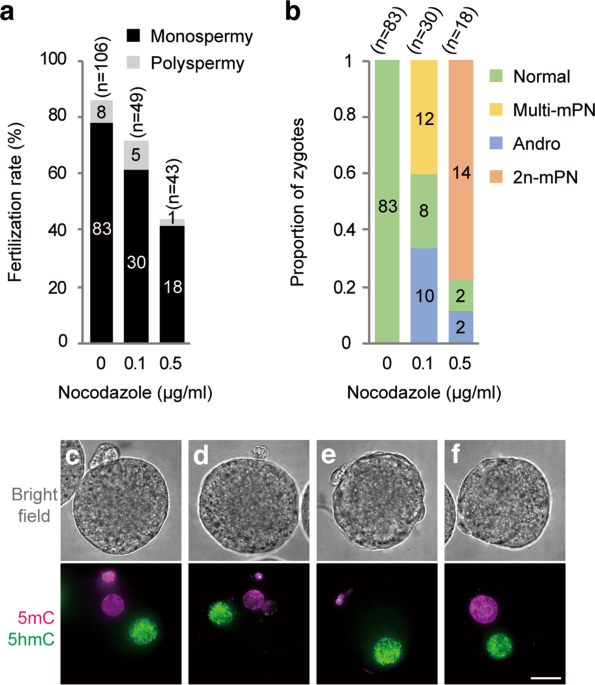
そのような中、私たちは非常に興味深い発見をしました。紡錘体は微小管というタンパク質の重合により形成されます。低濃度の微小管重合阻害剤(ノコダゾール)を含んだ培地中でマウス未受精卵を単為発生刺激(注7)したところ、姉妹染色体は分配されず小さくなった紡錘体とともに全てが第二極体として放出され、無核の卵子ができました。そこで、この現象をうまく利用することで簡単に雄性発生胚ができないかと考えました。さまざまな濃度のノコダゾールを含む培地中で体外受精を行ったところ、受精率に大きな影響を与えずに最も効率よく雄性発生胚を作り出せる最適濃度を見つけ出すことができました(図2)。
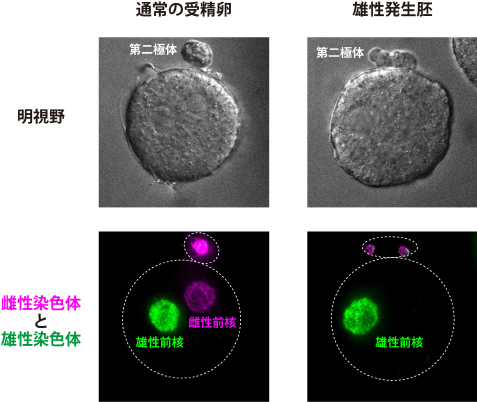
図2:通常の受精卵と雄性発生胚の比較
蛍光免疫染色法(注10)により卵由来の雌性染色体と精子由来の雄性染色体を可視化した、通常の受精卵と雄性発生胚の明視野の顕微鏡観察画像(上パネル)と蛍光顕微鏡観察画像(下パネル)。通常の受精卵(左)では、受精卵の中に雌性前核(マゼンタ)と雄性前核(緑色)が1つずつ存在している。一方、雄性発生胚(右)では、雌性染色体はすべて第二極体の中にあり、受精卵の中には雄性前核のみが存在している。白色の点線は細胞の概形を示している。
次に、この方法で作った雄性発生胚の発生率を調べました。雄性発生胚を5日間発生させると、胚盤胞(注8)への到達率は、ノコダゾールを使わずに未受精卵を単為発生刺激しただけの胚の胚盤胞への到達率と同程度でした。したがって、低濃度のノコダゾールは雄性発生胚の発生率にほとんど影響を与えないと考えられます。このように、受精卵にほとんど影響を与えずに簡単に雄性発生胚を作る簡便な方法を確立することができましたが、疑問が残ります。なぜ最適な濃度のノコダゾールが存在すると雄性発生胚ができるのでしょうか。そのメカニズムを探りました。
第二極体が放出されるとき、細胞を二つにくびり切るための細胞質分裂が行われます。細胞質分裂には、細胞膜直下に形成される収縮環が必要で、ちょうど巾着袋の口を閉めるかのように収縮環が収縮することで細胞がくびり切れます(図1A)。収縮環の形成は、分配した染色体間にできる中央紡錘体が、収縮環形成を誘導するタンパク質を細胞膜直下に寄せ集めることで開始されます。最適濃度のノコダゾールが存在しているとき、第二分裂中期の卵紡錘体は小型化しており、第二分裂後期に進行しても染色体は分配されませんでした。一方で、中央紡錘体に集積して収縮環の形成誘導にはたらくタンパク質であるPRC1(protein regulator cytokinesis 1)は、分配されていない染色体の周りに存在する微小管に適切なタイミングで集まりました。その後、染色体が存在する細胞膜突出部の周囲に収縮環が形成されて、全ての卵染色体と紡錘体を包み込む形で極体がつくられ細胞質分裂が達成されることがわかりました(図1B)。つまり、「染色体分配は阻害するが、細胞質分裂は起こせる程度」に第二分裂中期の卵紡錘体の機能を阻害することで、全ての卵染色体を極体に封じ込めることができることがわかりました。
本研究によって確立した雄性発生胚を作る新しい方法により技術的なハードルの高さが解消され、多くの研究者が雄性発生胚を用いた研究に取り組みやすくなります。さらに本手法はマウス以外の哺乳類にも応用可能だと考えられます。それにより、哺乳類の受精後の精子ゲノムのクロマチンリモデリングや発生過程におけるエピジェネティクス変化 (注9)、精子由来、卵子由来のゲノム機能の違いについての理解がよりいっそう進むことが期待されます。
発表雑誌
- 雑誌名
Scientific Reports論文タイトル
Production of mouse androgenetic embryos using spindle perturbation著者
Takaya Totsuka*, Miho OhsugiDOI番号
10.1038/s41598-020-63010-x
用語解説
注1 前核
受精卵内につくられる、ゲノム(注2)1セット分の染色体を含む核。卵子由来および精子由来それぞれの前核を雌性前核および雄性前核とよぶ。
注2 ゲノム
ある特定の生物についての全ての遺伝情報を含んだ最小単位のDNAや染色体。二倍体生物の場合、1つの細胞の核には2セットのゲノムDNAが入っている。
注3 減数分裂
動物においては精子、卵子をつくるための細胞分裂。1回のDNA複製の後、2回の連続した染色体分配と細胞質分裂(減数第一分裂、減数第二分裂)を行うことで、細胞のもつゲノムのセット数を半減させる。
注4 中期
分裂期のうち、すべての複製された染色体が紡錘体の中央に整列している時期。中期に続く後期に入ると、複製後の2組の染色体は紡錘体両極に1組ずつ分配される。
注5 極体
動物の卵子は減数第一分裂、第二分裂の2回の連続した細胞分裂の際に、大きな細胞と小さな細胞を生じる極端な不等割分裂を行うが、それぞれの分裂で生じた小さな細胞を第一極体および第二極体と呼ぶ。極体はやがて消失し、胚発生には関わらない。
注6 クロマチンリモデリング
DNAとヒストンなどのDNA結合タンパク質の複合体であるクロマチンの構造を大規模に変化させるしくみ。
注7 単為発生刺激
精子との融合なしに卵減数第二分裂中期の停止を解除し、第二分裂後期および分裂終期を経てその後の発生を進行させる誘導。
注8 胚盤胞
哺乳類の受精卵が数回の卵割を経た後の着床前の胚。胚盤胞は、将来胎盤になる栄養外胚葉(胚の外側を包む1層の細胞群)と、将来胎児になる内部細胞塊(胚の内側に存在する細胞群)に分かれている。
注9 エピジェネティクス変化
DNA配列の変化をともなわずに、後成的なクロマチン構造の変化により遺伝子発現パターンを制御するしくみ。
注10 蛍光免疫染色法
特定のタンパク質が細胞内のどこに分布するかを検出するための方法。観察したいタンパク質に特異的に結合する一次抗体と、一次抗体に特異的に結合する二次抗体を順番に反応させる。二次抗体には蛍光色素を付加させたものを用いることで、目的とするタンパク質の細胞内での分布を蛍光を捉えることにより観察できる。
―東京大学大学院理学系研究科・理学部 広報室―