産業利用されている光合成細菌ロドバクター・スフェロイデスの光捕集構造の可視化により、更に高効率な太陽光エネルギー活用の示唆
2022-05-11 三重大学,茨城大学,沖縄科学技術大学院大学,日本医療研究開発機構
- 光合成の際に酸素を発生しない「光合成細菌」であるロドバクター・スフェロイデスのコア光捕集反応中心複合体*1 の二量体*2構造を、クライオ電子顕微鏡*3により立体的に可視化することに成功
- ロドバクター・スフェロイデスは、肥料や食品の原料として使用されている5-アミノレブリン酸の生合成などに利用されており、その高効率な光捕集メカニズムは、他ではあまり見られない二量体構造を作る点が特徴
- 本研究グループの発見したタンパク質(protein-U*4)は、単量体*5と二量体双方の安定化に寄与するため、農業や環境分野での活用が進められてきた光合成細菌の品種改良への貢献に期待
- 非対称な二量体構造により、異なるキノン*6の出入口が2個形成され変換効率の調節可能
概要
三重大学大学院医学系研究科の谷一寿特任教授、溝口明教授、茨城大学の大友征宇教授、沖縄科学技術大学院大学のBruno Humbel博士らは、微生物発酵などでの利用が進んでいる光合成細菌の一種Rhodobacter sphaeroides(ロドバクター・スフェロイデス)の「膜タンパク質コア光捕集反応中心複合体(LH1-RC)の二量体構造」を、クライオ電子顕微鏡により立体的に可視化することに成功しました。
LH1-RCは、光合成細菌が光エネルギーを集め、電子変換し、伝達することを可能にしている膜タンパク質です。特に今回は、天然由来のLH1-RC単量体2個が合体した二量体の立体構造と、昨年発見した高エネルギー変換を支える新奇の膜タンパク質protein-Uが存在しない欠損株のLH1-RC単量体の立体構造を可視化できた初めての例となります。
二量体構造は、単純に単量体が2個結合した形状ではなく、非対称な形をとり、構成する2つのLH1-RC単量体のキノンの出入口は、互いに位置やサイズが異なり、エネルギー変換の調節機能をもっている可能性が示唆されました。
私たちがロドバクター・スフェロイデスのLH1-RC単量体複合体から発見したProtein-Uは、欠損株のタンパク質精製実験から二量体の安定化効果があることがわかっていましたが、新たな欠損株の立体構造から単量体の安定化にも役立っていることが明らかとなりました。本研究により、Protein-Uが高効率な太陽光エネルギー変換を支えていることを二量体と単量体の両構造から確認できました。
三重大学、茨城大学、沖縄科学技術大学院大学、神奈川大学、中国科学院植物研究所、神戸大学、南イリノイ大学の国際共同研究によるこの成果は、2022年4月7日、学術誌「Nature communications」にオンライン掲載されました。
背景
光合成細菌は、光合成時に植物やシアノバクテリアのように酸素を発生しないものの、非常に高い効率で太陽の光を電子エネルギーへ変換できるように進化してきました。棲息環境は淡水から海水まで幅広く、種ごとに適応し、光捕集において補助的な効果を持つカロテノイド類の種類・含有量にも差がみられるなどバラエティーに富んでいます。どの光合成細菌も太陽の光エネルギーを利用するという点では同じなのですが、菌の種類ごとに光捕集メカニズムが最適な装置になるようそれぞれが進化のバイアスを受けています。
当然ながら、光合成細菌の光合成は、酸素発生型である植物の光合成に類似している部分もありますが、酸素非発生型として効率を重視した独自の進化過程を遂げたことがわかっています。一方で、独自に発展した立体構造と機能との相関性は不明な部分も多く、発酵培養などで広く利用されている光合成細菌ロドバクター・スフェロイデスの光捕集反応中心複合体も謎が多いままでした。
また、光合成細菌は、田んぼや温泉など身近なところに生息しています。本種を含め農作物にとっての有害物質を栄養とし、有益な栄養分を排出するようなものが多く、化学物質に頼らない農業への活用も進められてきました。また、非常に高いエネルギー変換効率を持つことが知られており、酸素を発生しない光合成のメカニズムの解明は、様々な分野からの期待が寄せられています。
研究内容
ロドバクター・スフェロイデスのコア光捕集反応中心複合体は、他の種とは異なり、二量体形成ができ、より高い効率で光のエネルギー変換ができることが知られており、そのメカニズムを明らかにするために様々な変異体を含む研究が行われてきました。しかし、天然の状態にある二量体複合体内のメカニズムについては未解明で、今回クライオ電子顕微鏡を用いてようやく明らかにすることができました(図1)。
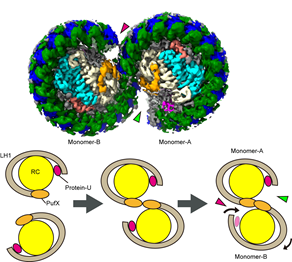
図1.二量体型コア光捕集複合体(上)と二量体形成モデル(下)矢頭で指した部分はキノンの出入口。前回発見したprotein-U(マゼンタ色)は、PufX*7橙(色)による二量体結合部に直接作用しないが、キノンの出入り口の形状を変えることで、二量体構造を安定化。
2021年に私たちが発見し命名した膜タンパク質「protein-U」は、二量体の接続部に直接関与するPufXから離れた位置にあるため、どうやってLH1-RCの二量体形成を安定化できるのかは大きな謎でした。実際に立体構造が明らかになると、protein-Uは自身の形を変えることで、キノンの出入口サイズを狭めて二量体の安定化を実現していました。
また、今回protein-Uを欠損したLH1-RCの単量体構造も明らかにすることができ、protein-Uが単量体構造の安定化にも貢献していることが示されました。
今後の展望
進化的に原始的な光合成細菌による光合成は、植物などとは異なり、酸素を発生しないタイプですが、非常に高いエネルギー変換効率を実現しています。特に、本研究で利用したロドバクター・スフェロイデスは、私たちの暮らしにとって有益な分子の生合成といった産業利用も既になされており、今回解明したprotein-Uが果たす安定性と変換効率の向上メカニズムは、生物工学な利用として促進されるだけでなく、太陽光エネルギーの人工的利用のさらなる発展にも貢献することが期待できます。
用語解説
- *1) コア光捕集反応中心複合体(LH1-RC)
- 光エネルギーをアンテナタンパク質(LH1)で効率的に捕集し、反応中心(RC)へ伝え、光から電子への変換を行い、キノン類*6を介して電子を伝達する複合体膜タンパク質。
- *2) 二量体
- 同じ種類の分子やサブニットが2つ集まった状態を呼びます。今回は、コア光捕集反応中心複合体単量体が2個まとまった状態を示しています。
- *3) クライオ電子顕微鏡
- 生体の高分子構造を立体的に解析できる手法の一種。2017年ノーベル化学賞。
- *4) protein-U
- 私たちが発見した2回膜貫通型膜タンパク質であり、そのノックアウト株の作製により、その機能はLH1-RC二量体化を安定させることであることがわかっています。
光合成細菌の高エネルギー変換を支える新しいタンパク質を発見―産業利用されている光合成細菌ロドバクター・スフェロイデスの光捕集構造の可視化により、太陽光エネルギー活用に新たな示唆―(令和3年11月5日成果情報) - *5) 単量体
- コア光捕集反応中心複合体1個の状態を示しています。
- *6) キノン
- 光合成の電子伝達体として生体内で利用されています。反応中心で電子を受け取ると細胞質側のH+と結合し、LH1-RCから離れていきます。
- *7) PufX
- 最近LH1-RC複合体中での立体構造がわかった1回膜貫通型膜タンパク質であり、これまでのノックアウト株の結果から、欠損するとLH1-RC二量体が見当たらず単量体になるだけでなく、光栄養成長できないことがわかっています。
論文情報
- 掲載誌
- Nature communications
- 掲載日
- 2022/4/7 (On line版)
- doi
- 10.1038/s41467-022-29453-8
- 論文タイトル
- Asymmetric structure of the native Rodobacter sphaeroides dimeric LH1-RC complex
- 著者
- Kazutoshi Tani, Ryo Kanno, Riku Kikuchi, Saki Kawamura, Kenji V. P. Nagashima, Malgorzata Hall, Ai Takahashi, Long-Jiang Yu, Yukihiro Kimura, Michael T. Madigan, Akira Mizoguchi, Bruno M. Humbel, and Zheng-Yu Wang-Otomo
研究支援
本研究は、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)JP21am0101118, JP21am0101116等の支援を受けて実施されました。
お問い合わせ先
本件に関するお問合せ
三重大学大学院医学系研究科 谷 一寿 特任教授
茨城大学大学院理工学研究科 大友 征宇 教授
AMED事業に関するお問合せ
日本医療研究開発機構(AMED) 創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)