2022-05-12 京都大学,日本医療研究開発機構
概要
京都大学大学院医学研究科 竹内理 教授らの研究グループは、免疫細胞の活性化や炎症を抑えるブレーキとしての働きをもつRegnase-1(レグネース-1)のはたらきを増強することで、免疫細胞の活性化を抑え、急性呼吸促拍症候群*1や、肺線維症*2、多発性硬化症*3モデルマウスの病状を改善する方法の開発に成功しました。
レグネース-1はRNA分解酵素として働き、サイトカインなど炎症や免疫細胞活性化に関わるタンパク質をコードするmRNAのステムループ構造*4を認識して分解することで免疫応答のブレーキとして機能しています。レグネース-1はヒト自己免疫疾患の病態に関与することが明らかとなりつつありますが、レグネース-1を標的とした免疫疾患制御法は開発されていませんでした。
本研究では、レグネース-1タンパク質が自己mRNAを3’非翻訳領域*5に存在する2か所のステムループ構造を介して分解することを利用して、レグネース-1の発現を増加させる方法を開発しました。そのため、レグネース-1 mRNAのステムループ構造を壊すようにアンチセンスオリゴ核酸*6を設計、細胞に導入したところ、レグネース-1タンパク質による抑制が解除され、レグネース-1の発現が増加しました。これにより、免疫のブレーキ機能が増強され、マクロファージ*7での炎症性サイトカイン産生が抑制されたことに加え、マウス個体において、急性呼吸促拍症候群や、肺線維症、多発性硬化症モデルマウスの病状を改善しました。また、ヒト多発性硬化症患者において、レグネース-1の血液細胞における発現とMRI検査で認められる病変部位の大きさに逆相関があることも分かりました。本制御法は、ヒトレグネース-1にも応用可能であることも明らかとなりました。
本研究成果は、2022年5月11日(現地時刻)に国際学術誌「Science Translational Medicine」にオンライン掲載されました。
発表のポイント
- 疾患の原因が免疫細胞の活性化と考えられる、急性呼吸促拍症候群や、肺線維症、多発性硬化症に対して、各疾患のモデルマウスを用いて免疫細胞の活性化や炎症を抑えるブレーキとしての働きをもつレグネース-1のはたらきを増強することで、病状を改善できる手法の開発に成功しました。
- レグネース-1が自身の mRNAを壊す自己制御機構を解明し、その自己制御を阻害するアンチセンスオリゴ核酸を設計し、レグネース-1の発現量を増加させることに成功しました。
- ヒト用に設計したアンチセンスオリゴ核酸は、ヒトのマクロファージ細胞株や血液由来単球においても、レグネース-1の発現を増強させ、免疫刺激によるサイトカイン産生を抑制する機能を発揮することも確認しました。
背景
マクロファージやT細胞などの免疫細胞は、細菌やウイルスなどの病原体感染時に活性化し、サイトカインなどのタンパク質を作り細胞外に分泌、炎症を起こします。適度な炎症や免疫細胞活性化は感染した病原体の排除に重要ですが、過剰な活性化や慢性化、また自分自身に対する免疫応答は、さまざまな炎症性疾患の発症につながります。例えば、細菌やウイルスの呼吸器感染による急性呼吸促拍症候群(ARDS)に、免疫応答の過剰な活性化やサイトカイン産生(サイトカインストームとも呼ばれる)が関わることは、新型コロナウイルス感染症の重症化機序の研究からも明らかにされています。また、慢性的な炎症は、特発性肺線維症や肝硬変など、臓器の線維化による疾患の原因ともなっています。免疫系が自分自身を攻撃してしまういわゆる自己免疫疾患にも炎症が深く関与しています。ヒトの自己免疫疾患には、慢性関節リウマチや、多発性硬化症、潰瘍性大腸炎など多くのものが知られています。ARDSや特発性肺線維症に対する有効な治療法は限られており、自己免疫疾患に対しては、免疫抑制剤や生物学的製剤が用いられ急速に治療法が進歩していますが、未だにこれらの治療法に不応性の患者も存在しています。新たな炎症制御法の開発は、炎症の関連するさまざまな疾患に効果を示す可能性があります。
マクロファージにおけるサイトカイン産生は、その細胞に存在するトル様受容体(TLR)*8をはじめとした病原体センサーにより病原体の感染を検知し、そのシグナルを核に伝えるところから始まります。核の中でDNAから、サイトカインなど免疫応答に関わるタンパク質をコードするメッセンジャーRNA(mRNA)が転写され、細胞質へ移動し、タンパク質へと翻訳され、働きます。T細胞など他の免疫細胞でも病原体の抗原を認識すると、同様の機構で活性化し、免疫応答をコーディネートしています。
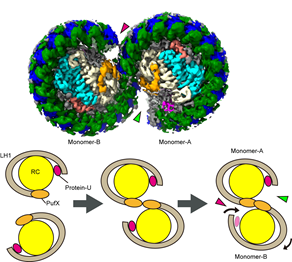
免疫細胞の活性化は、普段は緻密に制御され、過剰な活性化を防いでいます。この免疫応答の抑制機構の一つとして、サイトカインなど免疫応答の関わるタンパク質をコードするmRNAの量の調節があります。中でも、本研究グループがこれまで研究を行ってきたレグネース-1は、インターロイキン6(Interleukin-6、IL-6)などのサイトカインはじめとした免疫細胞活性化に関連するタンパク質をコードするmRNAを分解しその量を減らすRNA分解する酵素として機能し、免疫応答のブレーキとして働くタンパク質です(図1)。レグネース-1は、mRNAの3’非翻訳領域に存在するステムループ構造を認識して結合し、分解することで翻訳されるサイトカインなど免疫応答に関わるタンパク質の量を調節しています。マウスでレグネース-1を欠失させると、免疫系の暴走が起こり、自己免疫性炎症性疾患を発症しますが、近年の研究で、ヒト潰瘍性大腸炎の上皮でレグネース-1の機能獲得変異が見つかったり(参考文献1)、特発性肺線維症患で、その病理に関わる2型自然リンパ球(ILC2)*9細胞において細胞数とレグネース-1発現に負の相関を認め、マウスにおいてILC2の制御にレグネース-1が重要であることが明らかとなっています(参考文献2)。
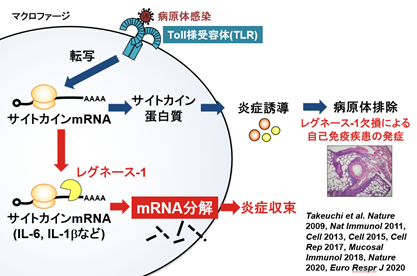
図1 レグネース-1によるmRNA分解を介した免疫応答、炎症制御
したがって、レグネース-1は、抗サイトカイン治療や免疫抑制剤とは異なる、炎症性疾患の新たな疾患治療標的となると考えられます。しかし、これまでレグネース-1を調節する制御法は開発されていませんでした。
研究手法・成果
1.Regnase-1の働きを高める手法の開発:アンチセンスモルフォリノオリゴ修飾核酸の投与
本研究ではレグネース-1の働きを高めることにより、免疫応答・炎症のブレーキを強める手法の開発に取り組みました。そのために、もともと存在するレグネース-1発現の制御メカニズムを利用することにしました。レグネース-1タンパク質もmRNAから翻訳されて作られますが、レグネース-1をコードするmRNA自身がステムループ構造を持ち、レグネース-1により分解されることを見出していました(参考文献3)。つまり、レグネース-1によって自身のmRNAおよびタンパク質の量が制御されており、レグネース-1のタンパク質やmRNAの変化に対して、その量を最終的に元に戻すような役割を果たしていると考えられます。
本研究で、まず、レグネース-1 mRNAの3’非翻訳領域を詳細に解析したところ、自分自身により認識される2か所のステムループ構造をとる配列が明らかとなり、それがヒトやマウスを始め多くの生物種で類似していることが分かりました。そこで、このステムループ構造を壊すことで、レグネース-1タンパク質によるレグネース-1 mRNAの分解を阻害し、増加したmRNAから多くのレグネース-1タンパク質を作らせることを目的とした検討を行いました(図2)。レグネース-1のmRNAに存在するステムループ構造を特異的に破壊するために、この構造をとる2か所のRNA配列に相補的に結合するようなオリゴ核酸をそれぞれ設計しました。このオリゴ核酸が細胞内でレグネース-1 mRNAに相補的に結合することにより、ステムループ構造をとることができなくなり、レグネース-1による自己抑制が解除されることが期待されました。核酸のバックボーンとしては、これまで核酸医薬として臨床応用もされているモルフォリノオリゴ修飾核酸*10(以下;MO核酸)を用いて合成しました。このレグネース-1標的MO核酸を細胞に導入すると、レグネース-1タンパク質がレグネース-1 mRNAに結合し分解するのを抑制し、レグネース-1のmRNAやタンパク質量が増加する事を確認しました。
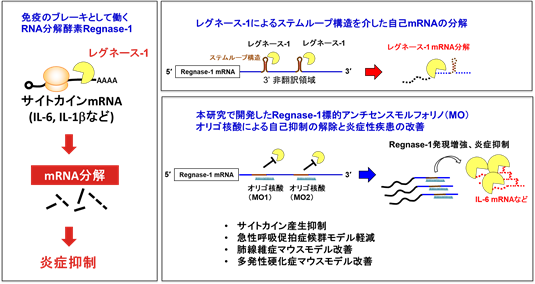
図2 レグネース-1によるRNA分解を通じた炎症抑制メカニズム(左)と、レグネース-1による自己mRNA分解を標的にしたアンチセンスオリゴ核酸による新たな炎症制御法の開発(右)
レグネース-1標的MO核酸は、マウスマクロファージに導入すると、レグネース-1の発現を増強し、これに反比例して、TLR刺激に対するIL-6などの炎症性サイトカイン産生を抑制しました。これに対し、I型インターフェロンなど核酸による副作用と考えられる遺伝子発現には影響を与えませんでした。また、ヘルパーT細胞に導入した際も、感染に対する応答に加えて自己免疫疾患にも関わるTh1やTh17細胞分化*11を抑制しました。すなわち、レグネース-1標的MO核酸は細胞レベルで、レグネース-1の発現を増加させ、免疫細胞活性化のブレーキ能を高めることに成功したと考えました。
2.Regnase-1標的MO核酸の有効性の検証:様々な自己免疫疾患症状の改善、軽減に効果
次に、マウスを用いて個体レベルでレグネース-1標的MO核酸の炎症性疾患に対する有効性を検証しました。その際には、組織導入性を高めたvivoモルフォリノオリゴ核酸を用いました。まず、急性炎症モデルとして、TLR4を刺激する細菌成分であるリポポリサッカライド(LPS)による急性呼吸促拍症候群(ARDS)にレグネース-1標的MO核酸を経気道的に前処置したところ、肺での炎症性サイトカイン発現や免疫細胞浸潤を有意に抑制し、肺障害も改善することが分かりました。ついで、肺線維症のマウスモデルに対するレグネース-1標的MO核酸の効果を検討しました。MO核酸の経気道投与により、炎症が引き金となって誘発される肺の線維化に関わるコラーゲンなどの遺伝子発現や肺への免疫細胞浸潤、肺の線維化の改善を認めました。したがって、レグネース-1標的MO核酸の経気道投与は、肺における急性、慢性炎症性疾患の軽減に効果を示しました。
レグネース-1はさまざまな自己免疫疾患と関連する事から、自己免疫疾患マウスモデルに対するレグネース-1標的MO核酸の効果検証も試みました。これまでに、多発性硬化症のマウスモデルである実験的自己免疫性脳脊髄炎(EAE)*12へのレグネース-1の関与が報告されており、私たちもレグネース-1のヘテロ欠損によりEAEが増悪することを見出しました。そこで野生型マウスにEAEを発症させ、レグネース-1標的MO核酸を疾患発症前に脳室内投与しました。その結果、麻痺などの臨床症状や脊髄への免疫細胞浸潤が有意に改善し、脊髄でのサイトカイン発現の抑制をみとめました。また、発症後の脊髄免疫細胞の1細胞シークエンス解析*13の結果、神経系のマクロファージ様細胞であるマイクログリア細胞が炎症抑制型に変化していることが明らかとなりました。すなわち、レグネース-1標的MO核酸は、自己免疫疾患の改善にも効果を示すことが考えられました。
最後に、ヒト多発性硬化症とレグネース-1の発現に関して検討を加えました。その結果、レグネース-1 mRNAの血液細胞における発現とMRI検査で認められる多発性硬化症患者の病変部位の大きさに逆相関があることが分かりました。
ヒトレグネース-1の3’非翻訳領域に存在するステムループ構造を標的としたアンチセンスMO核酸を合成し検討を行うと、このMO核酸がヒトマクロファージ細胞株や血液由来単球においても、レグネース-1の発現を増強させ、LPS刺激によるサイトカイン産生を抑制する機能を発揮することも示しました。
波及効果、今後の予定
本研究で、レグネース-1の自己制御を標的としたアンチセンスMO核酸が、レグネース-1の発現と免疫応答のブレーキ機能を増強し、これにより、さまざまな炎症性疾患を軽減することを見出しました。この研究では主にマウスを用いて検証していますが、ヒト細胞でもヒト用に設計したレグネース-1標的MO核酸が効果を示しており、将来的には、難治性の炎症性疾患の治療に発展させていく事ができたら良いと考えています。そのためには、オリゴ核酸の最適化やドラッグデリバリーシステムの構築など越えなければならないハードルは多く存在します。今後、さらに本研究開発を続けていきたいと考えています。
研究プロジェクトについて
本研究は、日本医療研究開発機構(AMED)JP21ae0121030、JP20gm4010002、JP20fk0108454(研究開発代表者:竹内 理) 、日本学術振興会19H03488(研究開発代表者:竹内 理)、日本学術振興会Core-to-Core Program(研究開発代表者:竹内 理)の一環で行われました。
用語解説
- *1 急性呼吸促拍症候群(ARDS)
- 重症の肺炎や外傷などにより、免疫細胞が過剰に活性化し、サイトカイン産生などの結果、肺胞や毛細血管に傷害がおこり、肺に水がたまり重度の呼吸不全を呈する疾患。呼吸管理など対症療法が中心で、新たな治療法の開発が求められている。
- *2 肺線維症
- 慢性的な経過で肺の線維化が進行する病気であり、代表的な疾患である特発性肺線維症は発症後の生存期間中央値が3~4年とされている。抗線維化薬などによる治療が行われているが、その効果は限定的であり、新たな治療法が求められている。マウスでは、ブレオマイシンという薬剤をマウスに経気道投与すると数週間後に肺線維症を発症するモデルが頻繁に使用される。
- *3 多発性硬化症
- 中枢神経の自己免疫疾患の一種であり、神経を包む髄鞘の破壊(脱髄)が神経系で多発的に起こり、感覚障害や運動障害などをおこす指定難病である。再発と寛解を繰り返す。MRI検査などで脱髄病変を確認する。治療としてはステロイドに加え、インターフェロンβ、フィンゴリモドなどが用いられる。
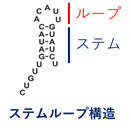
- *4 ステムループ構造
- RNAなどの1本鎖核酸は、GとC、AとU等の塩基で塩基対を形成するが、相補的な配列で塩基対(ステム)を形成し、その末端にそれをつなぐ配列(ループ)が存在する構造(下図)をステムループ(もしくはヘアピン)構造と呼ぶ。
- *5 3’非翻訳領域
- メッセンジャー(m)RNAはコドンによりタンパク質に翻訳されるコーディング領域に加え、その5’側に5’非翻訳領域、3’側に3’非翻訳領域を持つ。3’非翻訳領域には、mRNAの運命決定に関わる配列や構造(メタデータのようなもの)が埋め込まれている。
- *6 アンチセンスオリゴ核酸
- 標的のmRNAやマイクロRNAなどに相補的に結合しその働きを変化させる一般的には20塩基程度のオリゴ核酸。これまでは、mRNAの働きを抑えたり、スプライシングを変化させるように使用されてきた。今回のオリゴ核酸はmRNAを安定化させる逆の発想での使用法である。
- *7 マクロファージ
- 自然免疫に重要な細胞であり、細菌やウイルスなどの病原体を貪食するほか、TLRにより認識し、サイトカインを産生することにより炎症を惹起する。体内の様々な臓器に常在しており、神経系に存在するものはマイクログリア細胞、肺の肺胞領域に存在するものは肺胞マクロファージなどと呼ばれる。
- *8トル様受容体(TLR、Toll-like receptor)
- 病原体の構成成分(例えばグラム陰性菌細胞外膜を構成するリポポリサッカライド;LPSなど)を認識して病原体の侵入を検知するセンサータンパク質。自然免疫に重要であり、2011年にTLRによる病原体認識の概念に対しJules HoffmanとBruce Beutlerにノーベル賞が授与された。
- *9 2型自然リンパ球
- 近年新しく発見されたリンパ球の一種。肺や腸管、脂肪組織など全身の多くの臓器に存在する。インターロイキン(IL)-5やIL-13などのサイトカインを多量に産生する能力を持つ。寄生虫感染に対する防御や、アレルギー性疾患の発症 増悪、肺線維化に寄与することが知られている。
- *10 モルフォリノオリゴ修飾核酸
- モルフォリノ環を付加したオリゴ核酸。RNAに対する親和性が高く、RNAと比較して核酸分解酵素に対する耐性が有り、生体内で安定である。核酸医薬として既に、スプライシング制御薬として臨床応用されている。
- *11 Th1やTh17細胞分化
- ヘルパーT細胞が抗原の刺激を受けて活性化する際、周囲の環境や感染した病原体、サイトカインなどにより、Th1, Th2, Th17などのサブセットへと分化する。Th1は細胞内寄生菌に対する応答、Th2はアレルギーや寄生虫感染、Th17は細胞外細菌や真菌感染に応答する細胞集団であるが、自己免疫疾患へも関与している。
- *12 自己免疫性脳脊髄炎(EAE; Experimental Autoimmune Encephalomyelitis)
- 多発性硬化症の動物モデル。例えば、マウスをミエリンオリゴデンドロサイト糖タンパク質由来ペプチドで免疫することにより、ヒト多発性硬化症と類似した、中枢神経系の炎症や神経細胞の脱髄、軸索損傷、これによる麻痺などをおこす。
- *13 1細胞シークエンス解析
- 1細胞に発現するRNAの配列を網羅的にシークエンサーで決定し、RNAの種類や量(数)を決定する解析法。さまざまな方法が開発されているが、本研究では10XGenomics社の機器を用いた。
参考文献
- Kakiuchi N et al. Nature 2020;https://www.kyoto-u.ac.jp/ja/research-news/2019-12-20
- Nakatsuka Y et al. Eur. Respir J 2020;https://www.kyoto-u.ac.jp/ja/research-news/2020-10-14-2
- Iwasaki H, Takeuchi O et al. Nat Immunol 2011
論文タイトルと著者
- タイトル
- Enhancement of Regnase-1 expression with stem-loop-targeting antisense oligonucleotides alleviates inflammatory diseases(ステムループ標的アンチセンスオリゴ核酸によるRegnase-1の発現増強は炎症性疾患を軽減する)
- 著者
- Ka Man Tse1, Alexis Vandenbon2, Xiaotong Cui1, Takashi Mino1, Takuya Uehata1, Keiko Yasuda1, Ayuko Sato3, Tohru Tsujimura3, Fabian Hia1, Masanori Yoshinaga1, Makoto Kinoshita4, Tatsusada Okuno4, Osamu Takeuchi1(1:京都大学大学院医学研究科、2:京都大学医生物学研究所、3:兵庫医科大学医学部、4:大阪大学大学院医学系研究科)
- 掲載誌
- Science Translational Medicine
- DOI
- 10.1126/scitranslmed.abo2137
お問い合わせ先
竹内 理(たけうち おさむ)
京都大学大学院医学研究科・教授
報道・取材に関するお問い合わせ先
京都大学 総務部広報課国際広報室
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
次世代治療・診断実現のための創薬基盤技術開発事業担当