2022-07-12 スイス連邦工科大学ローザンヌ校(EPFL)
難病の標的に対する薬剤の開発に必要な大環状化合物を大量に合成する方法を発見。 Scientists at EPFL have found a way to synthesize large numbers of macrocyclic compounds, which are needed for developing drugs against difficult disease targets.
製薬会社は、何年もかけて集めた100万〜200万の「低分子化合物」のライブラリを持っている。しかし、多くの場合、古典的な低分子化合物をスクリーニングしても、ターゲットに十分に強く結合する化合物が含まれていないだけで、薬の候補を見つけることはできない。
EPFLの化学者グループが、大環状化合物を大量に生成する方法を発見し、利用可能なライブラリーのサイズを大幅に拡大することに成功した。この画期的な技術は、EPFL基礎科学部のChristian Heinis教授のグループによるものである。
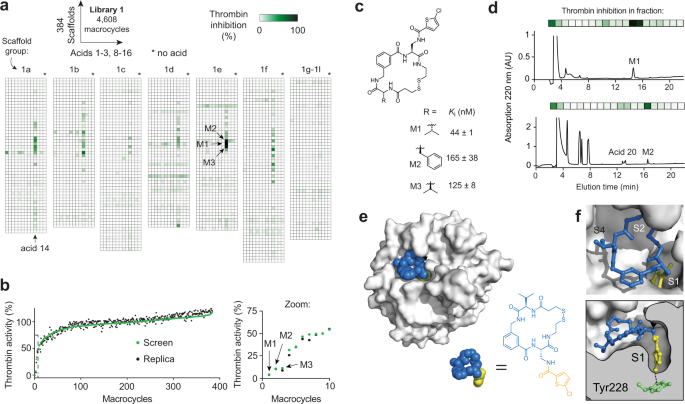
EPFLの生体分子スクリーニング施設の助けを借りて、40ナノリットルという極小の体積で、音響波を使って試薬を移動させることにより、非常に高速な反応を実現した。この小型化と高速化により、19,968種類の大環状化合物のライブラリーが、わずか半日で完成した。
プロジェクトを率いる博士課程の学生Sevan Habeshianは、この方法を用いて、脳卒中やがんの創薬ターゲットであるトロンビンおよびMDM2:p53タンパク質相互作用に対するナノモルの阻害剤を開発しました。
- https://actu.epfl.ch/news/chemistry-boosts-drug-libraries/
- https://www.nature.com/articles/s41467-022-31428-8
ピコモル規模でのコンビナトリアル後期修飾による大量の大環状化合物の合成と直接アッセイ Synthesis and direct assay of large macrocycle diversities by combinatorial late-stage modification at picomole scale
Sevan Habeshian,Manuel Leonardo Merz,Gontran Sangouard,Ganesh Kumar Mothukuri,Mischa Schüttel,Zsolt Bognár,Cristina Díaz-Perlas,Jonathan Vesin,Julien Bortoli Chapalay,Gerardo Turcatti,Laura Cendron,Alessandro Angelini & Christian Heinis
Nature Communications volume 13, Article number: 3823 (2022) Cite this article
Abstract
Macrocycles have excellent potential as therapeutics due to their ability to bind challenging targets. However, generating macrocycles against new targets is hindered by a lack of large macrocycle libraries for high-throughput screening. To overcome this, we herein established a combinatorial approach by tethering a myriad of chemical fragments to peripheral groups of structurally diverse macrocyclic scaffolds in a combinatorial fashion, all at a picomole scale in nanoliter volumes using acoustic droplet ejection technology. In a proof-of-concept, we generate a target-tailored library of 19,968 macrocycles by conjugating 104 carboxylic-acid fragments to 192 macrocyclic scaffolds. The high reaction efficiency and small number of side products of the acylation reactions allowed direct assay without purification and thus a large throughput. In screens, we identify nanomolar inhibitors against thrombin (Ki = 44 ± 1 nM) and the MDM2:p53 protein-protein interaction (Kd MDM2 = 43 ± 18 nM). The increased efficiency of macrocycle synthesis and screening and general applicability of this approach unlocks possibilities for generating leads against any protein target.