2022-08-26 国立循環器病研究センター
■概要
京都大学大学院医学研究科 夜久愛 博士課程学生、竹内理 教授、国立循環器病研究センター血管生理学部 中岡良和 部長らの研究グループは、免疫細胞の活性化や炎症を抑えるブレーキとしての働きをもつRegnase-1(レグネース-1)が、国の指定難病である肺動脈性肺高血圧症の発症・重症化において重要な役割を果たしていることを見出しました。
肺動脈性肺高血圧症(Pulmonary Arterial Hypertension: PAH)は、心臓から肺へ血液を送る血管である肺動脈の血圧が高くなる肺高血圧症の一つであり、肺動脈の血管壁が厚くなり内腔が狭くなる病気です。PAHは進行性で心不全に至る予後不良の病気です。現在、血管拡張薬の発展に伴い予後の改善がみられるも、未だ治療不応性・予後不良の症例が存在し、病態解明と新規治療法が求められています。
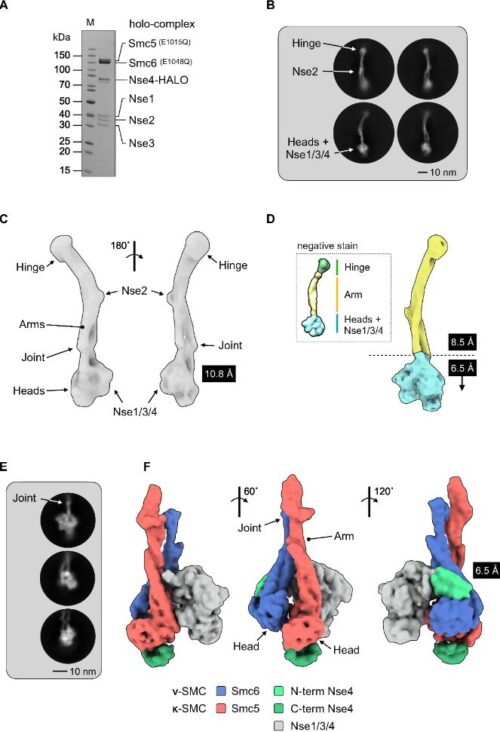
本研究では、炎症に関連する分子をコードするメッセンジャーRNA (mRNA) 1を分解することで炎症反応を抑えるRegnase-1タンパク質に着目し、肺高血圧症患者の血液細胞におけるRegnase-1遺伝子の発現量を解析しました。その結果、Regnase-1が肺高血圧症、特に、自分の免疫細胞が自己を攻撃する病気である膠原病2に合併するPAH(膠原病性PAH)の病態に関与している可能性が示唆されました(図1)。また、マウスを用いた実験により、肺胞マクロファージ3におけるRegnase-1がインターロイキン-6(Interleukin-6: IL-6) 4や血小板由来成長因子(Platelet Derived Growth Factor: PDGF) 5といったタンパク質をコードするメッセンジャーRNA (mRNA)の分解を介してPAH病態を負に制御しているということが明らかになりました(図1)。これらの結果は、今後、Regnase-1の発現量や機能を制御することでPAHの新規治療法につながる可能性があると考えています。
本研究成果は、2022年8月22日(現地時刻)に国際学術誌「Circulation」にオンライン掲載されました。
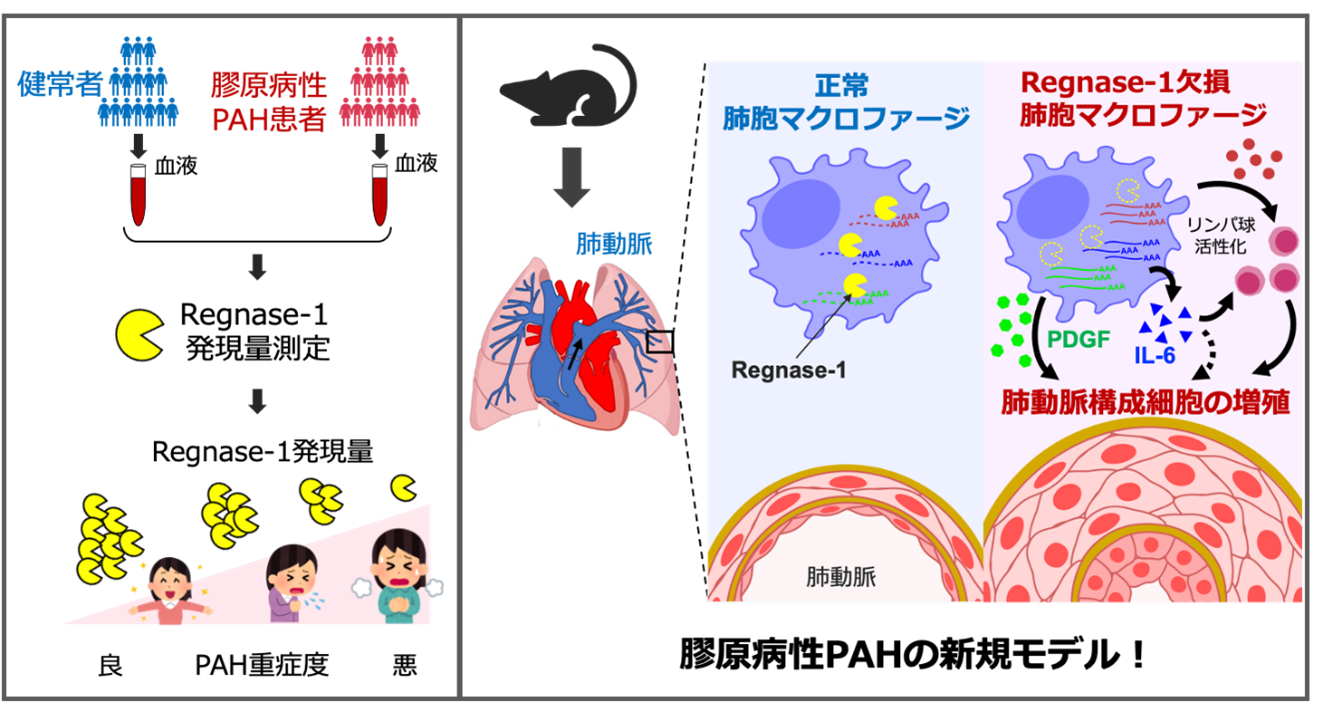
図1. (左) 膠原病性肺動脈性肺高血圧症(PAH)患者の血液細胞におけるRegnase-1遺伝子発現量
(右) Regnase-1によるPAH制御機構
1.背景
肺高血圧症は、心臓から肺へ血液を送る血管である肺動脈の血圧が高くなる病気の総称です。様々な原因で肺高血圧症が引き起こされますが、肺動脈の血管壁が厚くなり内腔が狭くなることが原因で起こる肺高血圧症のことを、肺動脈性肺高血圧症(Pulmonary Arterial Hypertension: PAH)といいます。PAHにはいくつか種類がありますが、代表的なものとして、特発性(原因がわからない)PAHと、免疫細胞が自己を攻撃する病気である膠原病に合併する膠原病性PAHが挙げられます。PAHは進行性の病気で、未治療では大半が死に至る病気です。
近年の血管拡張薬の開発により予後は改善しましたが、治療不応性の症例は未だに予後が不良であり、病態解明が求められています。特に膠原病性PAHは、肺動脈病変のみならず、肺静脈が閉塞する病気である肺静脈閉塞症6や、心臓が固くなって心臓の動きが悪くなる心臓の線維化といった難治性の病態を合併することが多く、他の原因によるPAHと比較して予後不良であることが知られています。しかしながら、重症の膠原病性PAHの病態を模するモデルマウスは存在せず、その病態は未解明のままです。
PAHの本態は、肺動脈を構成する細胞が異常に増殖することで、肺動脈の血管壁が厚くなり、血管の内腔が狭くなることです。現在使用されている血管拡張薬では、これらの異常な細胞増殖を抑えることができません。このような肺動脈構成細胞の異常増殖の発症・進展過程には慢性的な炎症が関与していることが指摘されています。例えば、インターロイキン1 (Interleukin-1, IL-1) 4やIL-6などの炎症性サイトカイン7がPAH患者の血中において高値であることが報告されています。しかしながら、どのような細胞が炎症性サイトカインを産生し、PAH病態に寄与しているのかは分かっていませんでした。そこで我々は、免疫細胞の活性化や炎症を抑えるブレーキとしての働きをもつRegnase-1という分子に着目しました。
Regnase-1は、IL-1やIL-6などの炎症性サイトカインをはじめとした、免疫細胞活性化に関連するタンパク質をコードするmRNAを分解する酵素として機能し、免疫応答を抑制するタンパク質です(図2)。近年の研究で、ヒト潰瘍性大腸炎8の上皮細胞でRegnase-1の機能獲得変異9が見つかっています※1。また、特発性肺線維症10患者さんの気管支肺胞洗浄液中で、線維化に関連する細胞である2型自然リンパ球(ILC2) 11 の数と、Regnase-1の発現量との間に負の相関を認め、ILC2に発現するRegnase-1が肺線維症の増悪を防ぐ機能を持つことも明らかになっています※2。したがって、ヒトの炎症病態や病気にRegnase-1が関与していることが考えられました。
以上より、我々はRegnase-1が炎症を抑制することでPAH病態を制御しているのではないかと考え、次のような手法を用いて研究を行いました。
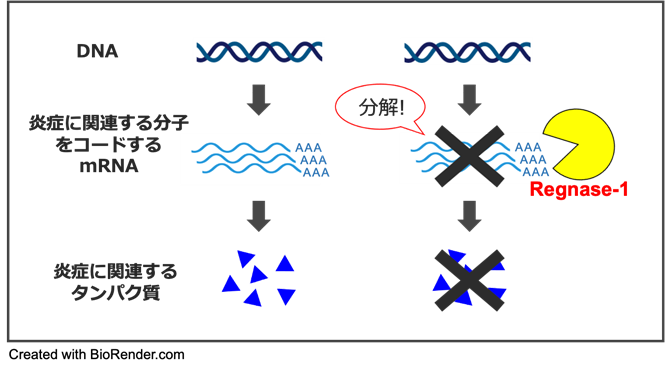
図2. (左) 炎症に関連する遺伝子発現の流れ (右) Regnase-1による炎症に関連する遺伝子発現の抑制
※1 https://www.kyoto-u.ac.jp/ja/research-news/2019-12-20
※2 https://www.kyoto-u.ac.jp/ja/research-news/2020-10-14-2
2.研究手法・成果
本研究手法と成果の主たる内容について、1.肺高血圧症の病態とRegnase-1の関与の検討、2.Regnase-1欠損と膠原病性PAHの関与の検討、3.肺胞マクロファージにおけるRegnase-1欠損とPAH病態への影響、の3点にまとめました。
1.肺高血圧症患者の血液細胞中のRegnase-1発現量は低く、予後と負の相関関係
〜膠原病性PAHでは、疾患重症度とRegnase-1発現量が負に相関〜
まず、肺高血圧症病態にRegnase-1が関与しているかどうか検討するために、肺高血圧症患者と健常者の血液細胞におけるRegase-1遺伝子発現量を比較しました。その結果、肺高血圧症患者ではRegnase-1発現量が健常者と比べて低下していることがわかりました。また、Regnase-1の発現量によって肺高血圧症患者を2群に分けると、Regnase-1発現量が高い群と比較すると低い群の方が疾患の予後が悪いということが明らかになりました。これらの結果よりヒト肺高血圧症の病態にRegnase-1が関与している可能性が考えられました。そこで、肺高血圧症のサブグループであるPAH患者に関して詳細に検討したところ、特に膠原病性PAH患者においてRegnase-1発現量とPAHの重症度が負に相関しており、Regnase-1が肺高血圧症、特に膠原病性PAHの病態に関与している可能性が考えられました。
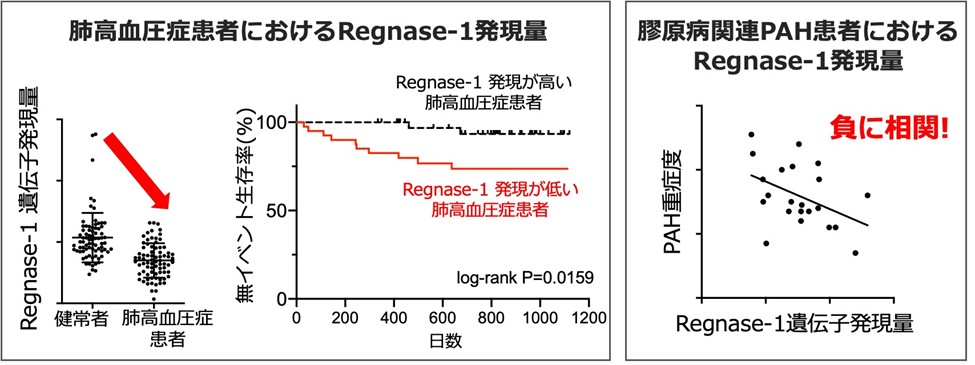
図3. 肺高血圧症患者、膠原病性肺動脈性肺高血圧症(PAH)患者におけるRegnase-1遺伝子の発現量
2.肺胞マクロファージにおけるRegnase-1欠損マウスは膠原病性PAH病態を模する
PAH病態に寄与すると考えられているIL-6やIL-1 などの炎症性サイトカインは免疫細胞の一種である骨髄系細胞で分泌されることが知られています。そこで骨髄系細胞におけるRegnase-1の機能を検討することにしました。
骨髄系細胞においてRegnase-1を欠損する2系統のマウスを作製したところ、両系統のマウスがPAHを自然発症しました。さらに、病理像では、既存のPAHモデルマウスで再現することが困難であった重症PAH患者でみられる肺動脈の叢状病変 (Plexiform lesion)12を呈しました。また、膠原病患者に合併することの多い、肺静脈閉塞症や心臓の線維化も合併しており、重症の膠原病性PAHを再現するモデルマウスと考えられました。2系統のマウスで共通する点は、肺胞マクロファージにおけるRegnase-1欠損であるため、肺胞マクロファージにおけるRegnase-1欠損が膠原病性PAH病態を引き起こしている可能性が考えられました。
3.肺胞マクロファージにおけるRegnase-1はIL-6、PDGF mRNAの分解を介してPAHを制御する
膠原病性PAHでは免疫抑制療法が奏功することがあり、T細胞やB細胞といったリンパ球が病態形成に関与すると考えられています。詳細な検討をすすめたところ、上述のRegnase-1欠損マウスにおいて、リンパ球依存性とリンパ球非依存性の経路がPAH病態形成に寄与していることが明らかになりました。Regnase-1欠損マウスに肺胞マクロファージを除去する薬剤を経気道的に投与するとPAH病態が改善したことから、肺胞マクロファージにおけるRegnase-1がPAH病態を制御していることが明らかになりました。
次に、Regnase-1欠損マウスから肺胞マクロファージと肺動脈を取り出し、両者の遺伝子発現を網羅的に解析し組み合わせることで、Regnase-1を欠損した肺胞マクロファージがどのような因子を介して肺動脈構成細胞の異常な増殖を引き起こしているのかを検討しました。そして、同定された因子の中からRegnase-1によって直接制御される遺伝子を絞り込みました。その結果、IL-1、IL-6、PDGFなどの遺伝子がRegnase-1によって分解制御されることが分かりました。PDGFは血管平滑筋細胞を増殖させることが知られています。そこで、Regnase-1欠損マウスを用いて、これらの因子を阻害する実験をしたところ、IL-6やPDGFを阻害することでPAH病態の改善でみられました。以上の結果より肺胞マクロファージにおけるRegnase-1はIL-6、PDGFのmRNA分解を介してPAH病態を負に制御しているということが明らかになりました。
3.波及効果、今後の予定
本研究で作製したRegnase-1欠損マウスは、既存のPAHモデルマウスで再現することのできなかった重症PAH患者の肺動脈病理像を再現し、膠原病性PAH患者に合併することの多い肺静脈閉塞症や心臓の線維化を合併しており、重症PAH、特に膠原病性PAHの病態解明に有用な新規モデルマウスと考えられます。今後、このマウスを用いて膠原病性PAHの病態がさらに解明されると考えています。
既存の血管拡張薬では、肺動脈構成細胞の異常な細胞増殖を制御することはできず、新しい治療薬の開発が望まれています。今回、炎症とPAHの関係に着目し、Regnase-1が炎症を抑制する中核となりPAH病態を制御するということを基礎実験と臨床データの両方を用いて示しました。今後はRegnase-1の発現量や機能を薬剤的に制御する手法を開発するとともに、PAHの新規治療につなげていきたいと考えています。
4.研究プロジェクトについて
本研究は、日本学術振興会特別研究員科学研究費補助金 (研究代表者:夜久 愛)、GSKジャパン研究助成2019 (研究代表者:夜久 愛)、藤原記念財団奨励金 (研究代表者:夜久 愛)、日本医療研究開発機構(AMED) JP19gm4010002, JP21ae0121030 (研究開発代表者:竹内 理)、日本学術振興会科学研究費補助金基盤 (S) 18H05278 (研究開発代表者:竹内 理)、公益財団法人かなえ医薬振興財団(研究代表者:正木 豪)、公益財団法人先進医薬研究振興財団(研究代表者:正木 豪)、公益財団法人金原一郎記念医学医療振興財団(研究代表者:正木 豪)、公益社団法人大阪ハートクラブ(研究代表者:正木 豪)、日本医療研究開発機構(AMED) JP22ek0109592 (研究開発代表者:中岡 良和)、武田科学振興財団(研究開発代表者:中岡 良和)の一環で行われました。
また、本研究は、兵庫医科大学と共同で行ったものです。
<用語解説>
*1 メッセンジャーRNA (mRNA):DNAの遺伝子情報をタンパク質に変換する際に合成される、遺伝情報のコピーとなる物質。
*2 膠原病 : 自分の免疫細胞が自己の細胞を攻撃する病気の総称。結合組織病や自己免疫疾患とも呼ばれる。
*3 肺胞マクロファージ:免疫細胞の1種で肺胞領域に存在するマクロファージ。肺の感染防御の第一線として機能し、病原体を捕食しサイトカインを産生することで炎症などを誘導する。
*4 インターロイキン-6、インターロイキン-1:炎症性サイトカインの一種で、マクロファージなど自然免疫細胞から特に多く産生され、発熱やリンパ球活性化など多彩な機能を持つ。IL-1やIL-6のシグナルを阻害する薬剤は自己免疫疾患に対する治療薬として使用されている。
*5 血小板由来成長因子(Platelet derived growth factor: PDGF):血小板由来成分から発見されたが、血小板以外にも様々な細胞で産生され、血管平滑筋を含む間葉系細胞を増殖させる作用を持つ。
*6 肺静脈閉塞症:肺静脈が閉塞し肺動脈の血圧が上昇し肺高血圧症をきたす難病。
*7 炎症性サイトカイン:生体内の様々な炎症症状を引き起こすサイトカイン(サイトカイン:細胞が産生する細胞間の情報伝達に関与するタンパク質)のこと。
*8 潰瘍性大腸炎:大腸の粘膜にびらんや潰瘍を形成する原因不明の大腸の炎症性疾患。
*9 機能獲得変異:遺伝子情報(遺伝子の塩基配列)が変化することで、その遺伝子から作られるタンパク質の本来の機能がさらに強くなる、もしくは、新しい機能を獲得する遺伝子変異のこと。
*10 特発性肺線維症:慢性的な経過で肺の線維化が進行する予後不良な難病。
*11 2型自然リンパ球(ILC2):近年新しく発見されたリンパ球の一種。肺や腸管、脂肪組織など全身の多くの臓器に存在し、寄生虫感染に対する防御や、アレルギー性疾患の発症 増悪、肺線維化に寄与することが知られている。
*12 叢状病変 (Plexiform lesion):重症PAH患者でみられる肺動脈病理像の一つ。瘤状となった肺動脈内に腎臓の糸球体類似の毛細血管の増生が認められ、肺動静脈シャントと考えられている。
<研究者のコメント>
京都大学大学院医学研究科 博士課程学生 夜久 愛:PAHは難治性・進行性の疾患で、既存の治療が奏功せず苦しんでおられる患者さんが多くいらっしゃいます。本研究は、難治性疾患であるPAHに関して、RNA分解による炎症の制御と、肺胞マクロファージによるIL-6, PDGFを介した肺動脈リモデリング機構という新しい2つの切り口で病態の一端を示したものです。重症PAHや膠原病性PAHの病態が明らかになり、既存の血管拡張薬と異なる機序を標的にした治療薬の開発につながる可能性があると考えています。最後に、これまでご協力、応援いただいた方々に改めて御礼申し上げます。
国立循環器病研究センター肺循環科 非常勤研究員 浅野 遼太郎:PAHは希少疾患であり、厚生労働省の指定難病です。肺血管拡張薬によって予後は改善しつつありますが、根本治療でないために治療が奏効しない患者さんも多く、病態解明が強く求められています。本研究は、肺胞マクロファージを中心とした過剰な炎症応答が、PAHの発症や重症化に寄与することを示しています。動物実験だけでなく、患者さんの血液細胞でも、炎症を制御するRegnase-1の発現が低下していることを明らかにしており、新しい治療薬開発にもつながる成果と考えております。研究にご協力いただいた患者さん達の期待に添えるよう、さらに研究を推進して参ります。
<論文タイトルと著者>
タイトル:Regnase-1 Prevents Pulmonary Arterial Hypertension via mRNA Degradation of IL-6 and PDGF in Alveolar Macrophages(Regnase-1は、肺胞マクロファージにおいてIL-6及びPDGF mRNAの分解を介して肺動脈性肺高血圧症を制御する)
著 者:Ai Yaku, Tadakatsu Inagaki, Ryotaro Asano, Makoto Okazawa, Hiroyoshi Mori, Ayuko Sato, Fabian Hia, Takeshi Masaki, Yusuke Manabe, Tomohiko Ishibashi, Alexis Vandenbon, Yoshinari Nakatsuka, Kotaro Akaki, Masanori Yoshinaga, Takuya Uehata, Takashi Mino, Hatsue Ishibashi-Ueda, Akio Morinobu, Tohru Tsujimura, Takeshi Ogo, Yoshikazu Nakaoka, and Osamu Takeuchi
掲 載 誌:Circulation DOI:10.1161/CIRCULATIONAHA.122.059435