2022-09-22 京都大学iPS細胞研究所
ポイント
- 新型コロナウイルスはClaudin-5の発現を抑制し、呼吸器の血管内皮バリアを破壊する。
- 気道チップを用いて新型コロナウイルスによる呼吸器の血管内皮バリア破壊の機序を解明した。
- フルバスタチンにより、新型コロナウイルスによる呼吸器の血管内皮バリア破壊を治療できる。
1. 要旨
橋本 里菜 研究員(CiRA増殖分化機構研究部門)、高橋 潤也 大学院生(大阪大学大学院薬学研究科 臨床薬効解析学分野)、高山 和雄 講師(CiRA同部門)、岡田 欣晃 准教授(大阪大学同分野)らの研究グループは、新型コロナウイルス(SARS-CoV-2)注1が、血管内皮細胞間の密着結合に関わるClaudin-5(CLDN5)注2の発現を抑制することで血管内皮バリアを破壊し、血管内へと侵入することを明らかにしました。
SARS-CoV-2は、呼吸器上皮細胞に感染したのち、血管を介して他の臓器に伝播します。このとき、SARS-CoV-2は呼吸器から血管の壁(血管内皮細胞注3のバリア)をこえて血管内に侵入しますが、そのメカニズムは不明でした。研究グループは、気道上皮細胞と血管内皮細胞で構成された気道チップ注4を使用して、SARS-CoV-2が血管内皮細胞間の密着結合に関わるCLDN5の発現を抑制し、Vascular endothelial-cadherin(VE-cadherin)による血管内皮細胞間の接着結合を減弱させることで、血管内皮バリアを破壊することを見出しました。実際、新型コロナウイルス感染症(COVID-19) 患者さんの肺においてCLDN5の遺伝子およびタンパク質発現量が減少していることを確認しました。また、血管内皮細胞のCLDN5の発現量を、遺伝子導入や低分子薬(フルバスタチン注5)で増加させることで、SARS-CoV-2による血管内皮バリア破壊を抑止することができました。これらの結果から、CLDN5の発現抑制は、SARS-CoV-2による血管内皮バリア破壊による呼吸器病態の進展と重症化に重要なメカニズムであり、CLDN5の発現促進がCOVID-19の新しい治療戦略となることが示されました。また、COVID-19 患者さんの呼吸器病態の再現と治療薬の探索ができる気道チップ技術は、今後COVID-19を含む重症呼吸器感染症の病態解明と治療薬開発のための優れたツールとなることが期待されます。
この研究成果は2022年9月22日(日本時間)に「Science Advances」でオンライン公開されました。
2. 研究の背景
血管内皮細胞はSARS-CoV-2感染受容体であるアンジオテンシン変換酵素2(ACE2)注6の発現量が少ないため、SARS-CoV-2にほとんど感染しません。しかし、COVID-19患者さんでは、血管炎や血管内皮バリア破壊が観察されます。血管内皮バリアが破壊されると、SARS-CoV-2が血管を介して、呼吸器から他臓器へ移動するのを促進するだけでなく、肺の血管外への免疫細胞や血液成分の浸潤を促し、肺炎や急性呼吸窮迫症候群(ARDS)注7などの重症病態を誘発します。SARS-CoV-2による血管内皮バリア破壊は、COVID-19患者さんにおいて阻止すべき重大な問題ですが、そのメカニズムはほとんど解明されていません。
本研究では、SARS-CoV-2に感染させた気道チップのヒト肺血管内皮細胞(HMVEC-L)の包括的な遺伝子発現を解析し、SARS-CoV-2による血管内皮バリア破壊に寄与する遺伝子としてCLDN5を特定しました。さらに、CLDN5の機能解析を進めるとともに、CLDN5がCOVID-19の創薬ターゲットになりうるか検討しました。
3. 研究結果
1) 気道チップによるSARS-CoV-2による血管内皮バリア破壊の再現
SARS-CoV-2による血管内皮バリアの破壊および呼吸器から血管への移行を模倣するために、気道チップを使用しました。気道チップは、気道上皮細胞(線毛細胞、クラブ細胞、杯細胞、基底細胞)とHMVEC-Lで構成され、気道チャネルおよび血管チャネルにそれぞれ空気および培地を流すことにより、気道における微小環境を再現できます(図1A)。気道チャネルにおけるウイルスゲノム量は感染4日目にピークに達する一方で、血管チャネルでは3日目に増加し始め感染7 日目でピークに達しました(図1B)。以上のように気道チップを用いることにより、SARS-CoV-2が気道から血管へ漏出する様子を再現することに成功しました。
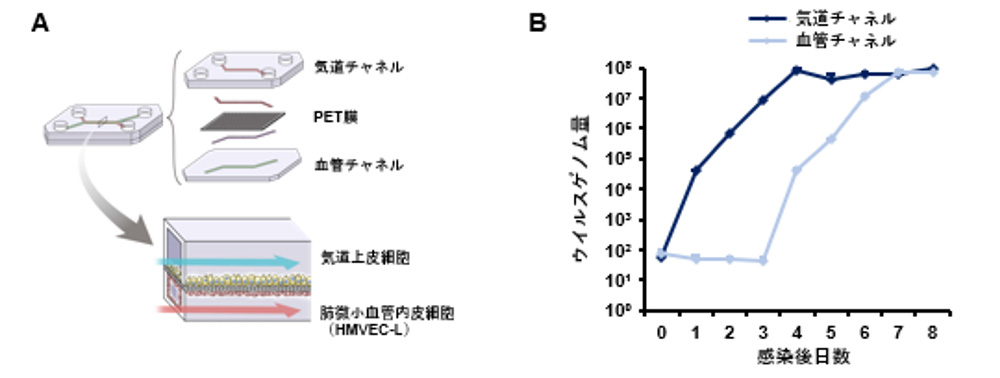
図1:気道チップを用いたSARS-CoV-2による血管内皮バリア破壊の再現
(A) 気道チップの概略図。SARS-CoV-2を気道チャネルに感染させ8日間解析した。
(B) 気道および血管チャネルにおけるウイルスゲノム量の経時変化。
2) SARS-CoV-2による血管内皮バリア破壊の原因遺伝子の探索
遺伝子発現を包括的に調べたところ、感染した気道チップのHMVEC-Lにおいては、細胞接着関連遺伝子発現が減少していました。特定した細胞接着関連遺伝子のうち、CLDN3、CLDN5、PCDHB1、PCDHB8、IGSF9Bの遺伝子発現が顕著に減少していました(図2A)。さらに、これらのうち、CLDN5の内因性遺伝子発現量が最も高いことが示されました(図2B)。以上のことから、CLDN5はSARS-CoV-2による血管内皮バリア破壊の原因遺伝子である可能性が示唆されました。
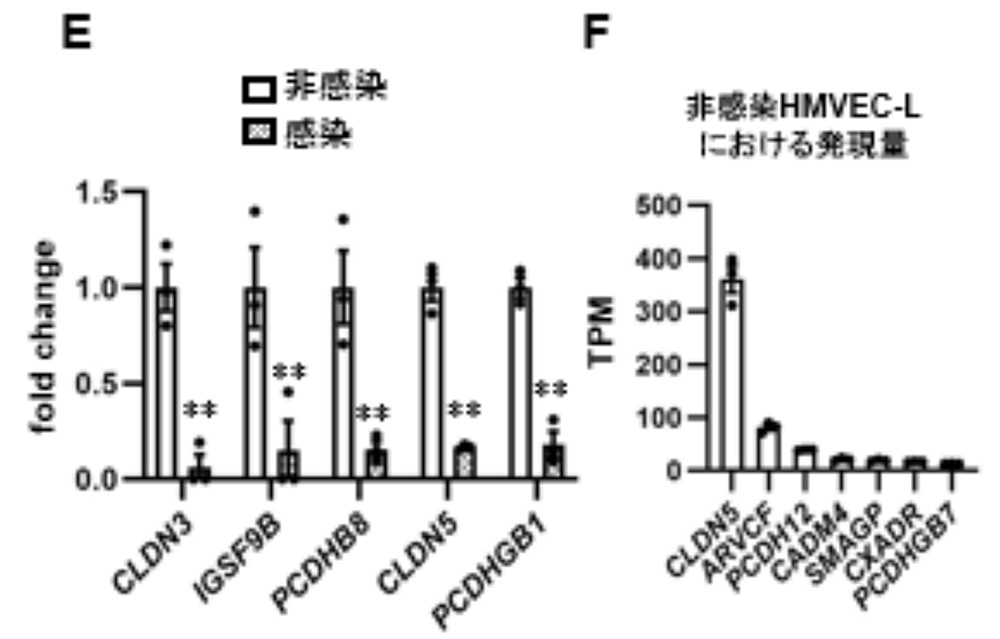
図2:SARS-CoV-2による血管内皮バリア破壊の原因遺伝子の探索
(A) 特定した細胞接着関連遺伝子遺伝子のうち、減少が顕著な上位5つの遺伝子
*:p <0.05の有意差を示す。
(B) 非感染HMVEC-Lにおける内因性遺伝子発現量が高い上位7つの遺伝子。
3) SARS-CoV-2は気道チップ上のHMVEC-LにおけるCLDN5の発現を抑制する
感染した気道チップ上のHMVEC-L間の結合部でのCLDN5タンパク質の減少も観察されました(図3)。VE-cadherinタンパク質の発現量は感染により変化しませんでしたが、接着結合が破壊され、細胞間に隙間が確認されました。以上のことから、SARS-CoV-2がHMVEC-LにおいてCLDN5の発現を抑制し、VE-cadherinの局在を変化させることで、血管内皮バリアを破壊することが示されました。
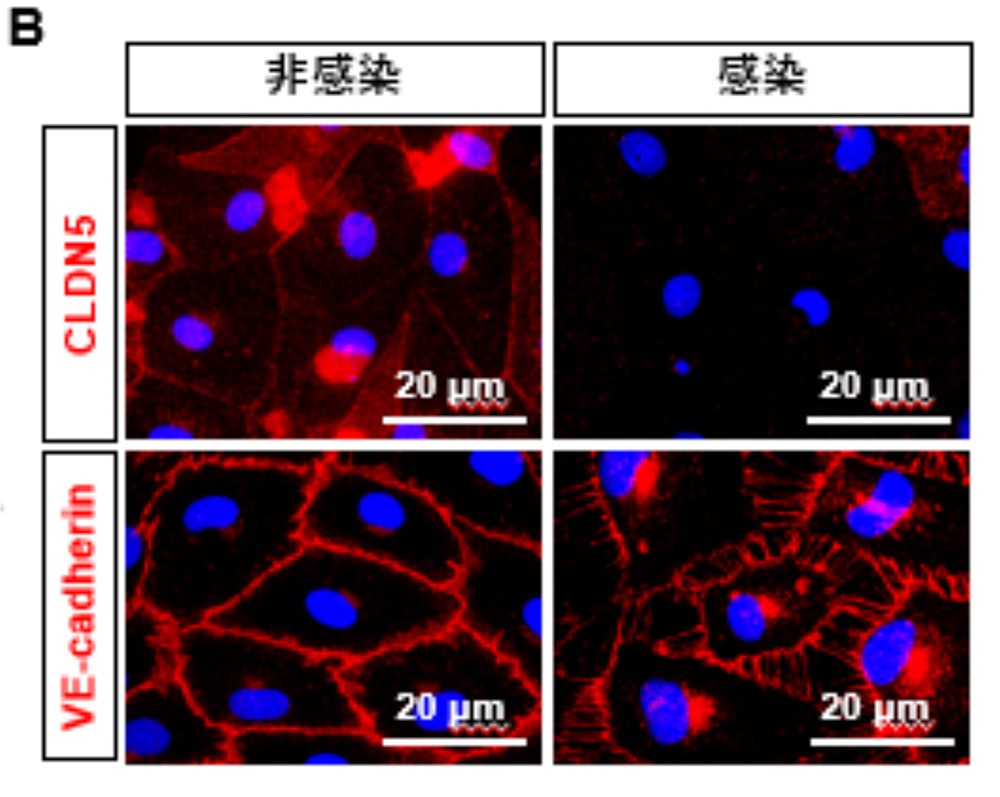
図3:気道チップのHMVEC-LにおけるCLDN5とVE-cadherin発現解析
非感染、感染時のHMVEC-LにおけるCLDN5およびVE-cadherinタンパク質の局在
**:p <0.01の有意差を示す。
4) CLDN5の過剰発現がSARS-CoV-2による血管内皮バリア破壊を抑止した
ドキシサイクリン(DOX)作用により、CLDN5の発現量が上昇するHMVEC-Lを作製しました(図4A)。CLDN5の過剰発現は、SARS-CoV-2の血管チャネルへの侵入およびVE-cadherinを介した細胞間接着の減弱を防止しました(図4B, 4C)。以上の結果から、HMVEC-LにおけるCLDN5の過剰発現が、SARS-CoV-2による血管内皮バリア破壊を抑止することが示されました。
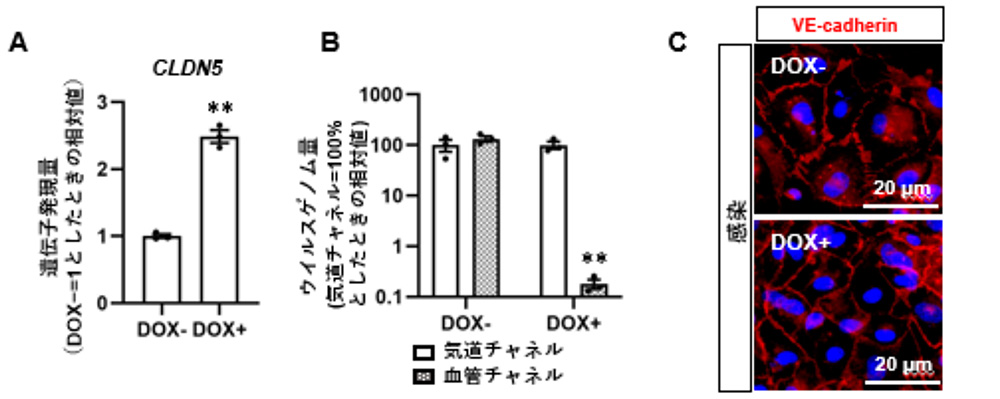
図4:CLDN5過剰発現HMVEC-Lを用いたSARS-CoV-2感染実験
(A) CLDN5発現誘導可能なHMVEC-L にDOXを作用させた際のCLDN5の遺伝子発現量
(B) DOX作用による気道および血管チャネル中のウイルスゲノム量の変化
(C) DOX作用によるVE-cadherinの局在変化 *:p <0.05, **:p 0.01の有意差を示す。
5) フルバスタチン誘導性のCLDN5の発現上昇がSARS-CoV-2による血管内皮バリア破壊を抑止した
スタチン治療によりCOVID-19 患者さんの死亡率が低下することが報告されています。スタチンの一種であるシンバスタチンは、肺動脈内皮細胞におけるCLDN5発現を増加させることにより急性肺損傷を軽減することも報告されています。
本研究では、HMVEC-Lにフルバスタチンを作用させたところ、CLDN5の遺伝子発現量を増加できることを確認しました(図5A)。また、SARS-CoV-2の血管チャネルへの侵入およびVE-cadherinを介した細胞間接着の減弱を部分的に防止しました(図5B, 5C)。以上の結果から、フルバスタチンはCLDN5の発現を増加させ、SARS-CoV-2による血管内皮バリア破壊を抑止することが示唆されました。
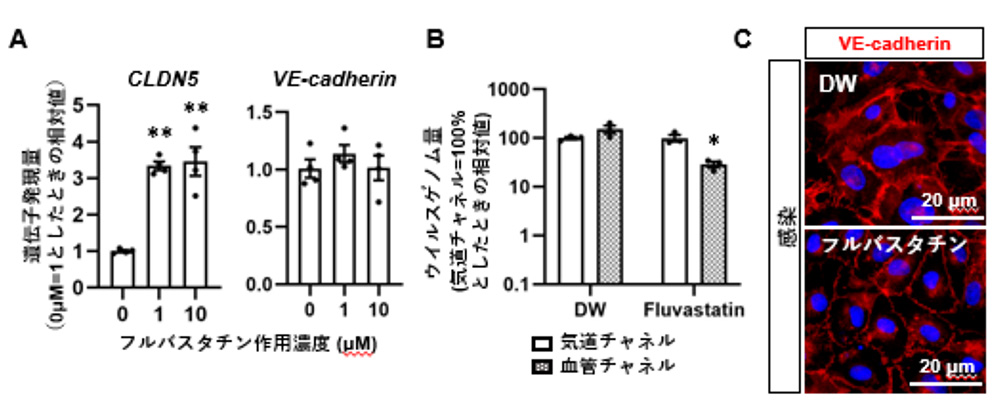
図5:フルバスタチンを作用させたHMVEC-Lを用いたSARS-CoV-2感染実験
(A) フルバスタチン作用時のHMVEC-LにおけるCLDN5、VE-cadherin遺伝子発現量。
(B) フルバスタチン作用による気道および血管チャネル中のウイルスゲノム量の変化
(C) フルバスタチン作用によるVE-cadherinの局在変化 *:p <0.05, **:p <0.01の有意差を示す。
6) COVID-19 患者さんにおけるCLDN5発現
COVID-19とCLDN5の関係を調べるために、健常人およびCOVID-19 患者さんの肺の検体を用いてCLDN5の発現を解析しました。COVID-19 患者さんの肺において、CLDN5の遺伝子発現量が低下していました。また、CLDN5タンパク質がほとんど消失していしました(図6A)。さらに、重症度の異なるCOVID-19 患者さんの血清中のCLDN5濃度を測定したところ、重症患者さんの血清CLDN5濃度(180 pg / mL)は、軽症・中等症患者の血清CLDN5濃度(484 pg / mL)よりも低いことが分かりました。(図6B)。CLDN5の主な供給源は血管内皮細胞であるため、血清中のCLDN5の量は、血管内皮細胞におけるCLDN5の発現量と相関していると考えられます。以上のことから、CLDN5の発現低下は、感染した気道チップだけでなく、COVID-19 患者さんの肺においても確認できました。
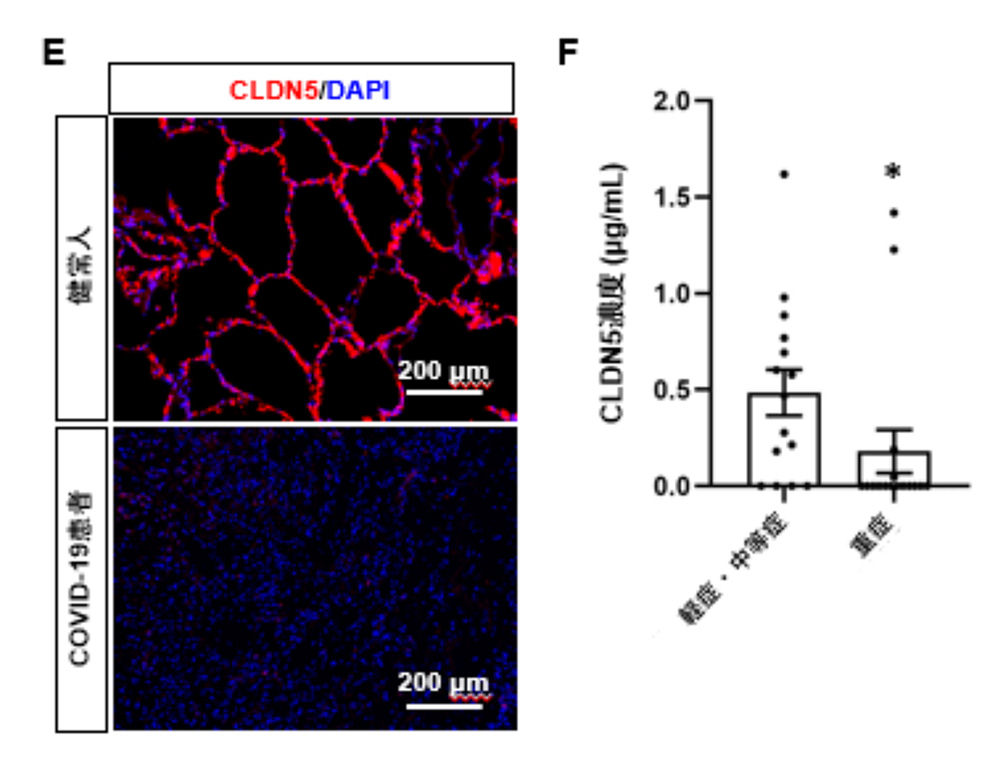
図6:COVID-19 患者さん肺の検体を用いた解析
(A) 健常人とCOVID-19患者の肺切片のCLDN5の免疫染色画像
(B) 軽症/中等症、重症のCOVID-19患者血清中のCLDN5濃度比較(ELISA)
*:p <0.05の有意差を示す。
4. まとめ
本研究では、気道チップを用いて、SARS-CoV-2感染が血管内皮細胞におけるCLDN5の発現を抑制することで、血管内皮バリア破壊を誘発することを発見しました。この現象はCOVID-19患者さんの肺でも確認することができました。また、CLDN5の過剰発現とフルバスタチンの作用により、SARS-CoV-2によるバリア破綻を抑制できることを明らかにしました。以上の研究を通して、呼吸器におけるSARS-CoV-2による血管内皮バリア破壊のメカニズムを発見し、COVID-19に対する新しい治療戦略を提案しました。
5. 論文名と著者
- 論文名
SARS-CoV-2 disrupts respiratory vascular barriers by suppressing Claudin-5 expression - ジャーナル名
Science Advances - 著者
Rina Hashimoto1#, Junya Takahashi2#, Keisuke Shirakura2, Risa Funatsu2, Kaori Kosugi1, Sayaka Deguchi1, Masaki Yamamoto3, Yugo Tsunoda4,5, Maaya Morita2, Kosuke Muraoka2, Masato Tanaka2, Tomoaki Kanbara2, Shota Tanaka2, Shigeyuki Tamiya6, Nagisa Tokunoh6,7, Atsushi Kawai2,6, Masahito Ikawa2,6,8, Chikako Ono6,8, Keisuke Tachibana2, Masuo Kondoh2, Masanori Obana2,9,10, Yoshiharu Matsuura6,8, Akihiro Ohsumi11, Takeshi Noda4,5, Takuya Yamamoto1,12,13, Yasuo Yoshioka2,6,7,8,9,10,
Yu-suke Torisawa14, Hiroshi Date11, Yasushi Fujio2,8,9, Miki Nagao3, Kazuo Takayama1,15*,
Yoshiaki Okada2,8*
#筆頭著者 *責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 大阪大学大学院薬学研究科
- 京都大学大学院医学研究科臨床病態検査学
- 京都大学医生物学研究所微細構造ウイルス学分野
- 京都大学大学院生命科学研究科微細構造ウイルス学分野
- 大阪大学微生物病研究所
- 一般財団法人阪大微生物病研究会
- 大阪大学感染症総合教育研究拠点 (CiDER)
- 大阪大学先導的学際研究機構 (OTRI)
- 大阪大学国際医工情報センター (MEI)
- 京都大学医学部附属病院呼吸器外科
- 理化学研究所革新知能統合研究センター iPS細胞連携医学的リスク回避チーム
- 京都大学高等研究院ヒト生物学高等研究拠点(WPI-ASHBi)
- 京都大学大学院工学研究科 マイクロエンジニアリング専攻
- 日本医療研究開発機構革新的先端研究開発支援事業(AMED-CREST)
6. 本研究への支援
本研究は、主に以下の支援を受けて実施されました。
- 京都大学基金 iPS細胞研究基金
- 公益財団法人 三菱財団
- 公益財団法人 千里ライフサイエンス振興財団
- 国立研究開発法人日本医療研究開発機構(20fk0108533h0001, 22gm1610005h0002, JP21am0101084, JP21am0101123)
- 日本学術振興会 科学研究費助成事業(20H03382, 20K21481)
- 公益財団法人 武田科学振興財団
7. 用語説明
注1) SARS-CoV-2
新型コロナウイルス(severe acute respiratory syndrome coronavirus 2)。新型コロナウイルス感染症(COVID-19)の原因ウイルス。
注2)Claudin-5
肺や脳に発現する約23 kDaの4回膜貫通タンパク質であり、肺の血管内皮バリアや脳の血液脳関門バリアの制御に関与。
注3) 血管内皮細胞
血管の内側をおおう細胞。この細胞どうしが接着することにより血管内皮のバリア機能が生み出され、物質や免疫細胞の通過が制御される。
注4) 気道チップ
気道における上皮―内皮構造を再現できる培養モデル。マイクロ流体デバイス上に細胞を播種し、気道上皮細胞と血管内皮細胞を動的な環境で培養することで、機能的な気道様構造を作製できる。
注5) フルバスタチン
血液中のコレステロールを低下させる作用を持ち、高コレステロール血症の治療と心血管疾患の予防に使用されるスタチン系薬剤の一種。
注6) アンジオテンシン変換酵素2(ACE2)
SARS-CoV-2の感染受容体。細胞表面に存在するタンパク質。心臓の保護、血管の拡張、炎症の抑制などの役割がある。SARS-CoV-2が感染する際に、細胞内にウイルスとともに取り込まれることも知られている。
注7) 急性呼吸窮迫症候群(ARDS)
肺に液体がたまり、血液中の酸素量が低下することが原因で発生する疾患。重症COVID-19でよく見られる症状。