2022-09-30 京都大学iPS細胞研究所
1. 要旨
京都大学医学部附属病院は、京都大学iPS細胞研究所と連携し、血小板輸血不応症注1)を合併した再生不良性貧血注2)の患者さんを対象とするiPS細胞由来血小板の自己輸血に関する臨床研究を実施していました。 本研究において予定していた投与を終了してから一年を経過し、特に問題がないことが確認されました。本成果をまとめ、米国血液学会等の発表を経て、Blood 誌(9月16日掲載)およびBlood Advances 誌(9月23日掲載)に論文発表したことを報告します。
2. 背景
再生不良性貧血などで血小板が不足すると、血小板の輸血が行われます。しかし、輸血後も血液中の血小板数が上昇しない、血小板輸血不応になる場合があります。その原因の一つに、輸血された血小板が異物として認識され、自身の免疫細胞が輸血された血小板を破壊することがあります。このような場合、患者さんの型と適合する血小板製剤が必要となりますが、稀な型の場合はそれが困難となります。患者さん自身の細胞から作製した血小板であれば、自身の免疫細胞に破壊されず輸血の効果が得られると期待できます。
3. 経過
平成25年
被験者のiPS細胞作製
平成29年
被験者の巨核球マスターセル樹立
平成30年5月28日
京都大学特定認定再生医療等委員会より適合性確認
平成30年7月20日
厚生労働大臣に再生医療等提供計画を提出
平成30年8月29日
厚生科学審議会 再生医療等評価部会にて初回審議
平成30年9月21日
厚生科学審議会 再生医療等評価部会にて第2回審議
平成30年10月19日
厚生労働大臣より適合性確認通知
平成31年3月25日
臨床研究開始
令和元年5月
用量コホート(1)実施
令和元年8月
用量コホート(2)実施
令和2年1月
用量コホート(3)実施
令和3年1月
最終投与後1年の観察期間終了
令和4年9月
Blood 誌およびBlood Advances 誌に成果公表
4. 臨床研究の計画の概要と結果
(1)試験名
「血小板減少症に対するiPS細胞由来血小板の自己輸血に関する臨床研究」
(2)目的
再生不良性貧血で、かつ抗HPA-1a抗体注3)による血小板輸血不応症を併発しているHPA-1b/1b型注3)の患者さんの血液細胞から作製するiPS細胞を経由して誘導される血小板を、当該患者さんに投与してiPS細胞由来の血小板製剤の安全性について検証を行う。
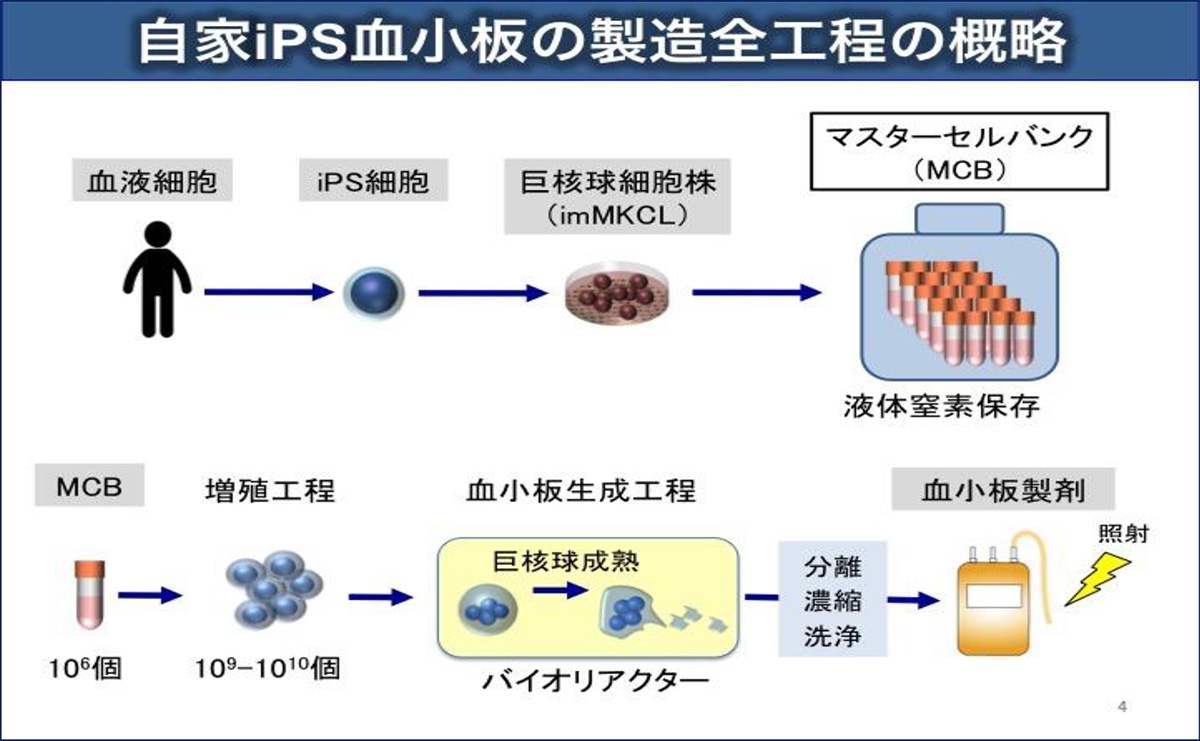
(3)iPS血小板の製造と非臨床試験
患者さんから採取した血液細胞からiPS細胞を作製します。その細胞から、巨核球細胞株注4)を作り出し、品質が良く安全性に問題がない株をマスターセル注5)として凍結保存します。このマスターセルを解凍し、培養液中で巨核球を増殖させた後、”乱流型”のバイオリアクターや新規薬剤を用いて血小板の産生を行います。血小板を分離・濃縮・洗浄した後、放射線照射により増殖できる細胞を根絶させます。
この血小板製剤について、製造法とともに安全性、品質、有効性の検証を規制当局(PMDA)との戦略相談を行った上で(Blood Advances 誌に発表)、大学の特定認定再生医療等委員会および厚労省の了承(適合性確認)を経て臨床試験を行いました(Blood 誌に発表)。
(4)試験デザイン
単施設非盲検非対照試験/単回投与用量漸増試験
用量コホート(1):0.5単位(血小板 1×10^10個)
用量コホート(2):1.5単位(血小板 3×10^10個)
用量コホート(3):5単位(血小板 1×10^11個)
(5)対象疾患
抗HPA-1a抗体による血小板輸血不応症を合併した再生不良性貧血
(6)対象被験者数
1例
(7)追跡調査期間
iPS細胞由来の血小板製剤の輸血後1年間
(8)主要評価項目:安全性(有害事象の発生頻度と程度)
(結果)
臨床的に問題となる有害事象は観察されませんでした。
副次評価項目:有効性(補正血小板増加数注6))
(結果)
用量コホート(3)でも明らかな輸血後の血小板数の増加は認めませんでしたが、iPS血小板と考えられるやや大型の血小板が血液中にあることがフローサイトメトリー解析法によって確認できました。
(9)まとめ
本研究によって、適合する血小板ドナーが存在しない患者さんに対し、輸血可能な品質良好な自己のiPS血小板を十分量製造することに成功し、3つの用量投与を経て安全性が確認されました。この成果により、将来必要となった場合に拒絶されない血小板を製造できることが可能となったことが示されました。
(10)雑誌発表情報
【臨床試験の結果】
Sugimoto N, Kanda J, Nakamura S, Kitano T, Hishizawa M, Kondo T, Shimizu S, Shigemasa A, Hirai H, Arai Y, Minami M, Tada H, Momose D, Koh KR, Nogawa M, Watanabe N, Okamoto S, Handa M, Sawaguchi A, Matsuyama N, Tanaka M, Hayashi T, Fuchizaki A, Tani Y, Takaori-Kondo A, Eto K.
iPLAT1: The first-in-human clinical trial of iPSC-derived platelets as a phase 1 autologous transfusion study.
Blood. 2022 Sep 16:blood.2022017296.
doi: 10.1182/blood.2022017296.
Epub ahead of print.
【製造法と非臨床試験(品質、安全性、有効性)】
Sugimoto N, Nakamura S, Shimizu S, Shigemasa A, Kanda J, Matsuyama N, Tanaka M, Hayashi T, Fuchizaki A, Nogawa M, Watanabe N, Okamoto S, Handa M, Sawaguchi A, Momose D, Koh KR, Tani Y, Takaori-Kondo A, Eto K.
Production and nonclinical evaluation of an autologous iPSC-derived platelet product for the iPLAT1 clinical trial.
Blood Adv. 2022 Sep 23:bloodadvances.2022008512.
doi: 10.1182/bloodadvances.2022008512.
Epub ahead of print.
5. 用語説明
注1) 血小板輸血不応症
血小板を輸血しても、血小板数が想定よりも増えない状態。原因には非自己の血小板に対する免疫学的機序がある。
注2) 再生不良性貧血
何らかの原因で造血機能が傷害され、血液中の白血球、赤血球、血小板のすべてが減少する疾患。罹患率は8.2(/100万人年)。
参考 https://www.nanbyou.or.jp/entry/106 (難病情報センター)
注3)抗HPA-1a抗体とHPA-1b/1b型
ヒトの血小板型であるHPA-1には一般的なa型とまれなb型がある。日本人の0.002%しかいないHPA-1b/1bの人は、妊娠や血小板輸血によってHPA-1aに対する抗体(抗HPA-1a抗体)ができやすく、一般的なHPA-1aを持つ血小板を拒絶する血小板輸血不応症となる。
注4)巨核球細胞株
巨核球は造血幹細胞から作られ、血小板を生み出す細胞。巨核球は成熟すると核分裂はするが細胞分裂はしないという特殊な分裂を行い、大型で多核の細胞になる。巨核球細胞株(imMKCL)は、iPS細胞から出来る巨核球に遺伝子導入をすることにより樹立された、増幅と成熟の切り替えが可能な細胞株。
注5)マスターセル
製品を製造するためのもととしてストックされる出発細胞。
注6)補正血小板増加数
体格(体表面積)で補正した輸血で増加した血小板数の値。血小板輸血の効果の指標として用いられる。
6. 臨床研究の実施体制
- 研究開発(製造)責任者
京都大学iPS細胞研究所 臨床応用研究部門 江藤浩之 教授 - 実施責任医師
京都大学医学部附属病院 血液内科 髙折晃史 教授 - 実施診療科/部門
京都大学医学部附属病院 血液内科、検査部(旧輸血細胞治療部) - 臨床研究協力機関
- 京都大学iPS細胞研究所(CiRA)
(iPS細胞由来の血小板の製造、品質管理) - 京都大学医学部附属病院 臨床研究総合センター(iACT)
(臨床研究の準備と実施の支援) - 日本赤十字社 近畿ブロック血液センター
- 慶應義塾大学医学部 血液内科
- 宮崎大学医学部 解剖学講座
- JR大阪鉄道病院 血液内科
- 京都大学iPS細胞研究所(CiRA)
7. 本研究への支援
- 国立研究開発法人 日本医療研究開発機構(AMED)
再生医療実現拠点ネットワークプログラム 再生医療の実現化ハイウェイ
「iPS細胞技術を基盤とする血小板製剤の開発と臨床試験」 - 国立研究開発法人 日本医療研究開発機構(AMED)
再生医療実用化研究事業「自家iPS細胞由来血小板製剤の安全性有効性検証臨床研究」
8. 実施責任医師/研究開発責任者のコメント
京都大学医学部附属病院 血液内科 髙折晃史 教授
「本研究では、臨床的に問題となる有害事象は観察されませんでした。研究にご協力いただいた患者さんをはじめ、関係者の皆様に改めて感謝いたします。今後も新たな治療法を開発してより多くの患者さんに役立てることを目指し、研究開発を進めてまいります」
京都大学iPS細胞研究所 臨床応用研究部門 江藤浩之 教授
「本臨床研究はiPS細胞から作製した血小板を輸血する初めての臨床研究でした。適合する血小板ドナーが存在しない患者さんであっても、拒絶されない血小板を製造できることが示され、嬉しく思います。引き続き、献血に依存しない輸血システムの実現を目指して、基礎研究・技術改良を推進してまいります。」