ミトコンドリアを標的にした新たな加齢性疾患の治療戦略を提唱
2019-06-13 東京薬科大学,日本医療研究開発機構
ポイント
- 小胞体に局在する分子IRE1α注1が異常タンパク質の蓄積を感知して細胞を生存あるいは細胞死を誘導するスイッチ機構をはじめて明らかにしました。
- ミトコンドリアと小胞体の接着部位において、ミトコンドリアに局在する分子MITOL注2が、小胞体上のIRE1αを制御して細胞死を抑制することを見出しました。
- 神経変性疾患など小胞体ストレス注3に関連する加齢性疾患において、ミトコンドリアを標的にした新たな治療法の開発が期待されます。
概要
小胞体で異常なタンパク質が蓄積することによって引き起こされる現象は、小胞体ストレスと呼ばれ、アルツハイマー病等の神経変性疾患、炎症や癌等の加齢性疾患に関与することが報告されています。東京薬科大学生命科学部の武田啓佑研究員、柳茂教授らのグループは、小胞体ストレスにおいて、ミトコンドリアと小胞体の連携的なシグナル調節が細胞の生と死を決定することを解明しました。小胞体でのタンパク質合成に異常が生じると、細胞はそのストレスを解消しようと試みますが、あるポイントを境に、自発的な細胞死を選択します。老化はこのストレス感受性を高めてしまうので、小胞体ストレスによる細胞死が高頻度で発生し、老化関連疾患の発症へ至ると考えられます。これまでに、小胞体ストレス時の細胞死スイッチが小胞体センサー分子であるIRE1αによって行われることは知られていましたが、そのメカニズムは不明でした。
本研究では、IRE1αに、制御シグナルであるユビキチン鎖注4を付加することでその細胞死スイッチを回避していること、さらにユビキチン鎖が直接ストレスを受けている小胞体ではなく、ミトコンドリアを介して発信されることを明らかにしました。その中心的な役割を担うのがミトコンドリア膜上の酵素MITOLです。MITOLはミトコンドリアと小胞体の膜接触を足場として、IRE1αと結合し、細胞死スイッチを抑制するユビキチン鎖シグナルを付加します。そのため、小胞体が急なストレス状態に転じても、細胞死は起こりません。しかしながら、ストレスが慢性化すると、MITOLによるIRE1αの抑制がはずれて、細胞死へと移行してしまいます。今回発見されたこの仕組みは、神経変性疾患をはじめとした老化疾患において、ミトコンドリア活性化を基盤とした新しい治療戦略につながる大きな発見です。
本成果は欧州科学誌「EMBO Journal」に電子版で掲載されます。本研究は日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」、文部科学省科学研究費補助金および私立大学戦略的研究基盤形成支援事業の支援を受けて行われました。
背景・経緯
アルツハイマー病などの神経変性疾患では、小胞体によるタンパク質合成の渋滞や異常なタンパク質の蓄積が観察され、これが病態進行に関わる重大な細胞内ストレスであることが知られています。また老化の早期段階においても、小胞体に異常タンパク質の蓄積が確認されます。小胞体でのストレスは、軽度な段階では、多様な品質管理機能によって正常化されますが、ある閾値を超えると、細胞内では処理不可能な問題であると判断され、自発的な細胞死を引き起こします。このような細胞死が臓器内にて蓄積することによって臓器機能は低下し、加齢性疾患の発症へと繋がっていきます。そのため、小胞体ストレスとその応答の仕組みの解明は、なぜ加齢性疾患では小胞体ストレスによって細胞死が起きるのか、それはどのようなアプローチによって予防できるのか、という疑問を解消するための重要な研究課題です。
最近では、タンパク質合成やフォールディングに特化した細胞小器官である小胞体のホメオスタシスに、他の、全く別に機能化された細胞小器官たちが関与することが明らかとなりました。この細胞小器官ネットワーク注5は多面的な細胞内の機能管理システムとして注目されています。エネルギー工場として有名なミトコンドリアもまたこの細胞小器官ネットワークを構築する一つです。実際に、ミトコンドリアは小胞体と積極的に近接・膜接触場を形成することで、お互いのもつ物質を効率よく補充しています。
内容
私たちはこれまでにミトコンドリア外膜に存在するMitochondrial Ubiquitin Ligase (MITOL)というタンパク質を同定し、これがユビキチン鎖という制御シグナルを使うことで、ミトコンドリア膜での多様な細胞応答を支配していることを明らかにしてきました。本研究では、MITOLがミトコンドリア膜の中でも、小胞体と近接した膜領域において豊富に存在したことに着目し「MITOLはミトコンドリアのみならず、小胞体から惹起されるシグナル応答にも関与できる」と仮説立て解析を試みました。最初に、MITOLを欠損した細胞を用いて、小胞体でのストレス応答性を調べました。その結果、MITOL欠損細胞では、ミトコンドリアのみならず、小胞体のストレスに対しても過敏な応答を示し、早期から細胞死スイッチが認められました。この時、小胞体でのストレス感知を担うIRE1αというセンサータンパク質が、非常に強く活性化していることに気が付きました。特に重要なことに、MITOLが欠損すると、小胞体ストレスを排除しても、IRE1αの活性化が長く保持されました。つまり、MITOLのない状態でIRE1αがストレスを感知すると、そのストレス応答がいつまでも終息しないということです。そして私たちは、このIRE1αの過度で持続的な活性化が、小胞体ストレスにおいて細胞死を引き起こすことを見出しました。
さらに私たちは、MITOLが直接IRE1αと結合することを発見しました。小胞体-ミトコンドリア間の膜接触領域を破壊すると、その結合が失われたことから、MITOLとIRE1αは両細胞小器官の膜接触を足場として、結合することが示されました。この時、MITOLは、IRE1αによる細胞死シグナルが誘導されないよう、IRE1αにK63型ユビキチン鎖注6という制御シグナルを付加していることが分かりました。これによりIRE1αは、小胞体ストレスを感知しても、一定時間でその活性を終息させるため、細胞死シグナルが誘導されないと考えられます。それを証明するために、私たちは、MITOLによるユビキチン鎖を付加できないIRE1α変異体を作製し、細胞に導入しました。その結果、細胞は小胞体ストレスに対して早期からの細胞死スイッチを示し、過剰な細胞死へと至りました。また重要なことに、MITOLによるIRE1αの制御は、小胞体ストレスの長期化に伴い、消失しました。
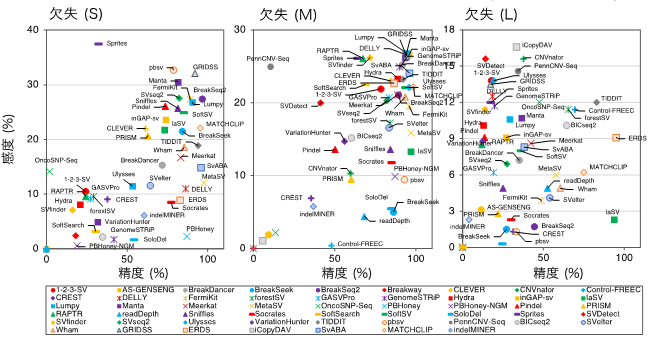
これらの発見は、小胞体ストレスにおいて細胞運命が決定される仕組みを説明できます。私たちのモデルでは、細胞は、IRE1αの活性が一定時間で終息するようにとMITOLによる制御シグナルを付加し、急激な小胞体ストレスに事前に準備しています。そのため、小胞体に変性タンパク質が蓄積しても、それが軽度のストレスであれば、即座にストレスは解消され、IRE1αによるストレス応答も無事終息します。しかしながら、小胞体におけるストレスが解消できないと、MITOLによるIRE1αの抑制効果は次第に減弱してしまいます。その結果、IRE1αが過剰に活性化してしまうことで細胞死シグナルのスイッチが押されてしまいます(図1)。MITOL欠損細胞では、IRE1αの過剰活性化を終息させる機構が最初から欠失しているため、小胞体ストレスの早期より細胞死スイッチが観察され、過剰な細胞死を引き起こしたものと考えられます。
図1.小胞体ストレス時における細胞死スイッチのモデル図
今後の展望
これまでに神経変性疾患の治療標的の一つとして、小胞体の活性化を基盤とした研究開発がされてきました。今回の発見は、小胞体ストレスにおける細胞死の回避へとつながる新しい治療標的として、全く別の細胞小器官ミトコンドリアの活性化が利用できる可能性を示しています。またこのような細胞小器官ネットワークによる相補的・連携的なシグナル制御の理解が進めば、特定の細胞小器官の異常を回復するために、異なった細胞小器官の制御系を含めた広域な標的分子を利用可能となり、これからの治療実現性をより高めることが期待できます。現在、私たちはMITOLを活性化する薬剤をスクリーニングしており、すでに複数の化合物を同定しています。まだ予備的な実験段階ですが、マウスを用いた実験系においてもこれらの化合物の抗老化作用が確かめられています。今後、MITOL活性化薬は小胞体ストレスが関与する様々な加齢性疾患の治療薬になる可能性が期待されます。
用語説明
- 注1:IRE1α
- 小胞体に存在する3種類のストレスセンサーの一つ。ストレス感知後は細胞生存に関するシグナルを誘導するが、特定状況下では細胞死のシグナルへとシグナルスイッチする。
- 注2:MITOL
- ミトコンドリア外膜上に存在する基質ユビキチン化酵素の一つ。多臓器内において、老化に伴い発現減少する。ミトコンドリア近傍のシグナル制御を担う。
- 注3:小胞体ストレス
- 細胞要求性と小胞体における機能のバランスが破綻した時に生じる不和。タンパク質合成の要求性が高い時に起こるタンパク質合成の渋滞であったり、フォールディング不全による変性タンパク質の蓄積、内腔カルシウム濃度の異常、膜成分の不飽和/飽和脂肪酸バランスの破綻など。
- 注4:ユビキチン鎖
- ユビキチン鎖とは76残基のアミノ酸からなるユビキチン同士がイソペプチド結合を介して連結したポリマー鎖の形態。ユビキチンリガーゼを介してユビキチン鎖が基質タンパク質と結合することにより、基質タンパク質の分解や機能が調節される。
- 注5:細胞小器官ネットワーク
- 細胞小器官同士のコミュニケーション。以前より、膜成分を輸送するメンブレントラフィッキングが知られていたが、近年では直接的な膜接触によるメンブレンコンタクトが発見され、さらに多様な形態をとることが明らかとなっている。
- 注6:K63型ユビキチン鎖
- ユビキチン鎖の結合様式には多様性が存在し,ユビキチンの63番目のアミノ酸 のリシン残基(K63)を介したポリユビキチン鎖をK63型ユビキチン鎖と呼び、基質タンパク質の局在や活性の制御など分解以外のシグナルを伝える。
論文題目
- 題目:
- MITOL prevents ER stress-induced apoptosis by IRE1a ubiquitylation at ER-mitochondria contact sites
- 著者:
- Keisuke Takeda, Shun Nagashima, Isshin Shiiba, Aoi Uda, Takeshi Tokuyama, Naoki Ito, Toshifumi Fukuda, Nobuko Matsushita, Satoshi Ishido, Takao Iwawaki, Takashi Uehara, Ryoko Inatome & Shigeru Yanagi
- 日本語題目:
- 「MITOLは小胞体-ミトコンドリア接触部位においてIRE1αのユビキチン化を介して小胞体ストレス誘導性のアポトーシスを防ぐ」
- 著者名:
- 武田啓佑、長島駿、椎葉一心、宇田葵、徳山剛士、伊藤直樹、福田敏史、松下暢子、石戸聡、岩脇隆夫、上原孝、稲留涼子、柳茂
- 掲載誌:
- EMBO Journal
お問い合わせ先
内容に関するお問い合せ
東京薬科大学 生命科学部 分子生化学研究室
教授 柳 茂(やなぎ しげる)
報道に関するお問い合せ(機関窓口)
学校法人東京薬科大学 総務部 広報課
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
基盤研究事業部 研究企画課