2022-10-08 国立がん研究センター,名古屋大学
発表のポイント
- 制御性T細胞(注1)は、がんの進展やPD-1/PD-L1阻害薬の治療抵抗性に関与していることが分かっていますが、がん組織内で活性化する詳細なメカニズムはこれまで分かっていませんでした。
- 本研究では、生検組織などの微量ながん組織を用いて1細胞レベルで遺伝子発現とその制御機構を解析する新規手法を開発して、ヒトの血液、正常肺組織、肺がん組織に存在する免疫抑制性の制御性T細胞を詳細に解析することに成功しました。
- 転写因子(注2)のBATFが、肺がん組織内の制御性T細胞の遺伝子発現制御機構を再構築することにより、制御性T細胞ががん組織に適合して活性化するためのプログラムの中核として働いていることを発見しました。
- 本研究成果により、開発が難しいとされてきた制御性T細胞を標的とした新規免疫治療開発につながることが期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区、以下国立がん研究センター)と名古屋大学の研究チームは、がんの進展やPD-1/PD-L1阻害薬の治療抵抗性に関与しているものの、がん組織内での活性化のメカニズム等の詳細が解明されていない制御性T細胞について、微量な組織で解析できる新たな手法を開発し、肺がん組織内の制御性T細胞を1細胞レベルで詳細に解析した結果、がんの組織内の制御性T細胞の多様性と、がん組織内で制御性T細胞が活性化していくプログラムを解明しました。今後、制御性T細胞を標的とした、新規のがん免疫治療の開発につながることが期待されます。
PD-1/PD-L1(注3)阻害薬を始めとした免疫チェックポイント阻害薬は、2014年に悪性黒色腫で保険適用されて以降、肺がんや胃がんなどの多様ながん種の治療に用いられています。一方で、PD-1/PD-L1阻害薬の治療効果の認められる患者さんは全体の2割程度と少なく、治療が奏効しないメカニズムの探求と、そのメカニズムに基づく新たな治療法の開発が求められています。
本研究では、解析が難しいとされてきた生検組織などの微量ながん組織を用いた1細胞レベルの解析手法を開発しました。本手法を用いて、血液や正常肺組織、非小細胞肺がんの組織に存在する制御性T細胞の網羅的解析を行い、がんの組織に存在する制御性T細胞が特徴的なクロマチン(注4)構造と遺伝子発現制御機構を持っていることを見出しました。さらに、転写因子のBATFが、クロマチン構造をリモデリング(注5)する機能を介して、がん組織における制御性T細胞の活性化プログラムの中核を担っていることを発見しました。
本研究は、国立がん研究センター 研究所 腫瘍免疫研究分野 板橋 耕太 研究員、西川博嘉 分野長(名古屋大学大学院医学系研究科 微生物・免疫学講座 分子細胞免疫学 教授併任)の研究チームで実施しました。研究の一部は小野薬品工業株式会社との共同研究として実施され、研究の一部はMSD株式会社の支援により実施されました。
本研究成果は、米国科学雑誌「Science Immunology」に、2022年10月7日付け(日本時間2022年10月8日)に掲載されました。
背景
免疫系は生体内に生じた異常細胞(がん細胞)を異物として認識して、免疫応答を誘導して、攻撃・排除することが知られています。とりわけCD8陽性T細胞は、がんに対する抗腫瘍免疫応答で主要な役割を担っており、がん細胞に提示されるがん抗原を認識して、がん細胞を攻撃・排除します。しかしながら、免疫抑制的ながん組織では、CD8陽性T細胞は、「疲弊」と呼ばれる状態に陥っており、十分に機能を発揮することができません。CD8陽性T細胞が疲弊するメカニズムに関しては詳しく研究されてきており、PD-1などの免疫チェックポイント分子と呼ばれる免疫抑制分子が中心的役割を担っていることが明らかになってきています。現在、CD8陽性T細胞の疲弊の解除を目的としたPD-1/PD-L1阻害薬を始めとした免疫チェックポイント阻害薬の開発が多く進められています。
一方で、がん組織には、抑制性の免疫細胞である制御性T細胞が豊富に存在しており、CD8陽性T細胞の働きを妨害することも知られています。本研究チームは、がん組織内で制御性T細胞が活性化して増殖し、がんの進展やPD-1/PD-L1阻害薬の治療抵抗性に関与していることを解明して報告してきました(Saito T, et al. Nat Med 2016; Kumagai S, et al. Nat Immunol 2020, Sugiyama E, et al. Sci Immunol 2020, Kumagai S, et al. Cancer Cell 2022)。しかしながら、がん組織における制御性T細胞の活性化メカニズム、特に詳細なクロマチンの状態に関しては、多くの点が未解明のままでした。
研究方法
がん組織内の制御性T細胞の特徴を明らかにするために、肺がん組織から制御性T細胞と制御性T細胞以外のCD4陽性T細胞、CD8陽性T細胞を採取し、ATACシーケンス(注6)とRNAシーケンス法を用いて、各々のT細胞のクロマチンの状態(クロマチンアクセシビリティ:注7)と遺伝子発現の詳細な解析を実施しました。その結果、肺がん組織内の制御性T細胞は、がん組織内の他のT細胞や肺がん患者の血液中の制御性T細胞のいずれとも全く異なるクロマチン構造と遺伝子発現のプロファイルを有していることが明らかになりました(図1)。この結果から、がんの微小環境下に適応するために、制御性T細胞のクロマチンは特徴的な構造にリモデリングされていることが示唆されました。
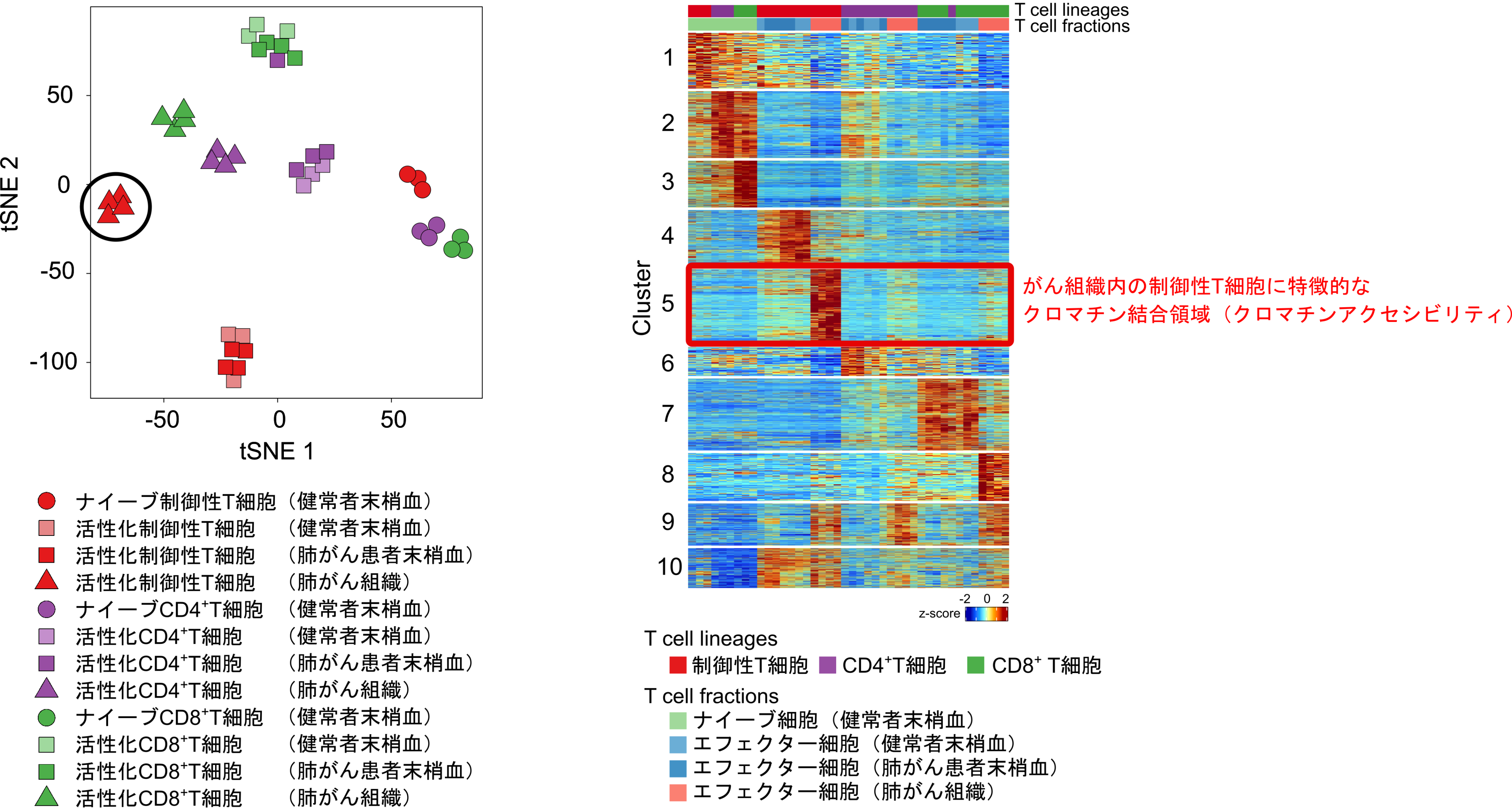
図1. 各T細胞のクロマチンアクセシビリティの評価
血液中やがん組織内の制御性T細胞と制御性T細胞以外のCD4陽性T細胞、CD8陽性T細胞を採取し、ATACシーケンスの解析を行いました。がん組織内の制御性T細胞は、他のT細胞や血液中の制御性T細胞と異なるクロマチン(クロマチンアクセシビリティ)の構造を有することが分かりました。
網羅的な解析データから、がん組織内での制御性T細胞の分化と活性化のキーとなる分子を探索したところ、転写因子のBATFが候補として同定されました。BATFは、免疫細胞においてはTh17細胞(注8)で、その結合領域のクロマチンを緩め、他の転写因子などをその結合領域にリクルートする機能を持っていることが知られていました。BATF発現は、がん組織内の制御性T細胞で非常に高いことが示されました(図2)。さらにBATFの結合するクロマチン領域を検討したところ、がん組織内の制御性T細胞ではBATF結合クロマチン領域が緩んでいることが分かりました(図3)。これらの解析結果から、がん組織内の制御性T細胞のクロマチン構造のリモデリングにBATFが関与している可能性が示唆されました。特にBATFがプロモーター/エンハンサー(注9)に結合してクロマチンアクセシビリティを変化させ、転写が促進される遺伝子には、制御性T細胞の抑制活性に重要なCTLA-4や、がん組織内の制御性T細胞に特徴的な分子であるCCR8などが含まれていました。
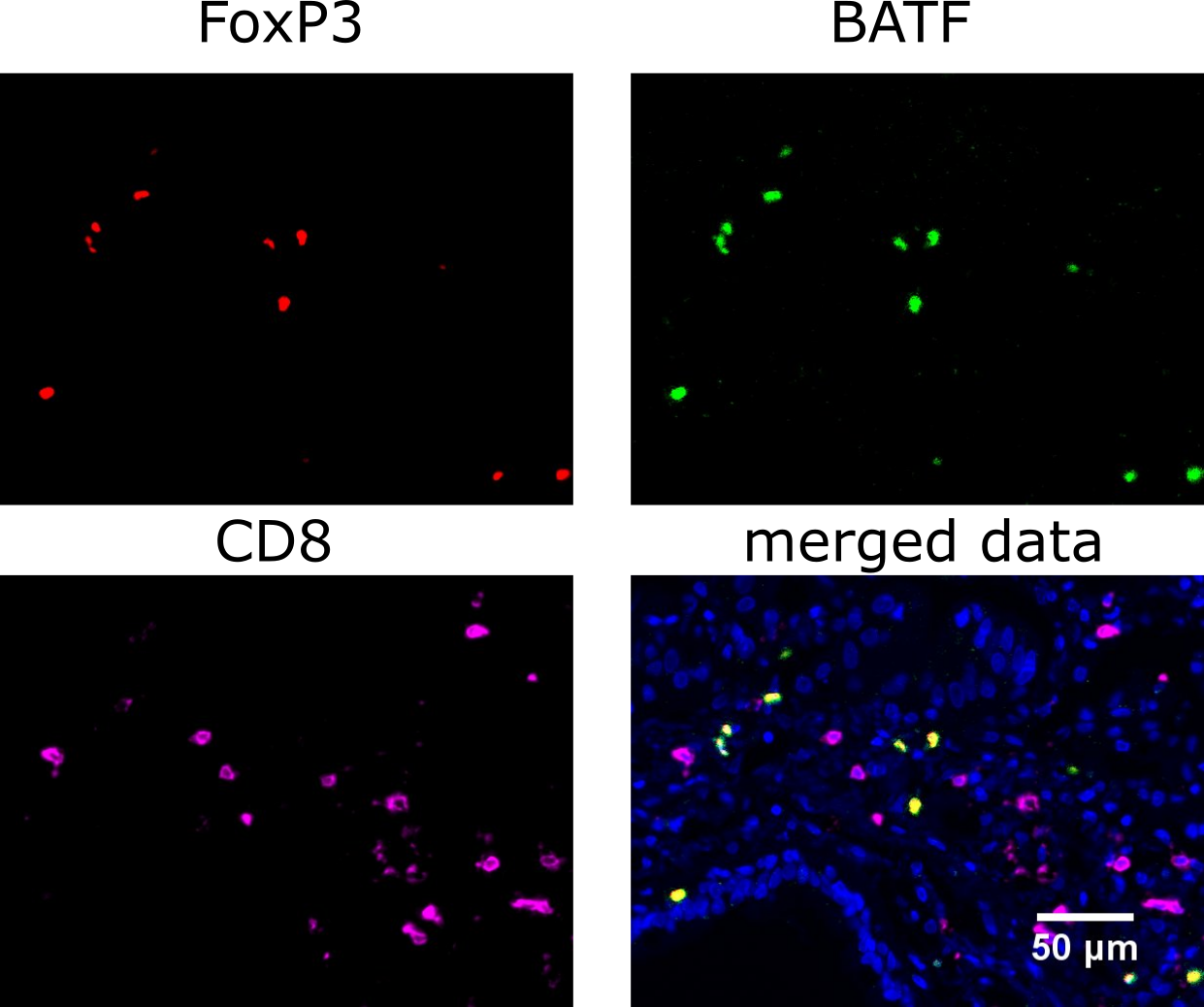
図2. 多重免疫染色による、がん微小環境のBATFの発現の評価
肺がんの組織の多重免疫染色を実施しました。FoxP3陽性の制御性T細胞で、BATFのタンパク発現が非常に高いことが明らかになりました。
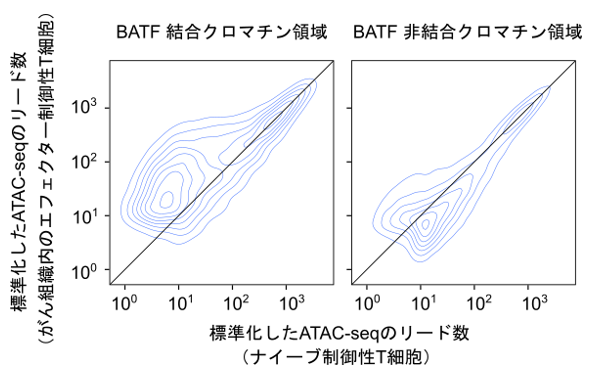
図3. 制御性T細胞における、BATFの結合とクロマチンアクセシビリティの関連
BATFの結合によって、がん組織内の制御性T細胞のクロマチンアクセシビリティが上昇することが示唆されました。
次に、シングルRNAシーケンスとシングルセルATACシーケンス手法を用いて、血液、正常肺組織、がん組織内の制御性T細胞の1細胞解析(注10)を実施しました。シングルセルシーケンスで得られたデータを用いて制御性T細胞のクラスタリング(注11)を行い、その結果を次元圧縮法[Uniform Manifold Approximation and Projection (UMAP)]を用いて、二次元上に描出しました(図4)。その結果、がん組織内の制御性T細胞は、複数の特徴的な制御性T細胞集団に分類することができ、多様な細胞集団の集合であることが明らかになりました。擬似時間解析(注12)を用いて、ナイーブ制御性T細胞からがん組織内で最も活性化している制御性T細胞への擬似的な時間軸を作成し、制御性T細胞の分化における転写因子の発現変動を解析しました。すると、制御性T細胞の活性化に寄与することが報告されている他の転写因子と比較して、制御性T細胞の活性化の早期から転写因子BATFの発現上昇が認められました。以上より、がん組織内の制御性T細胞の分化でBATFが早期相から働いていると考えられました。
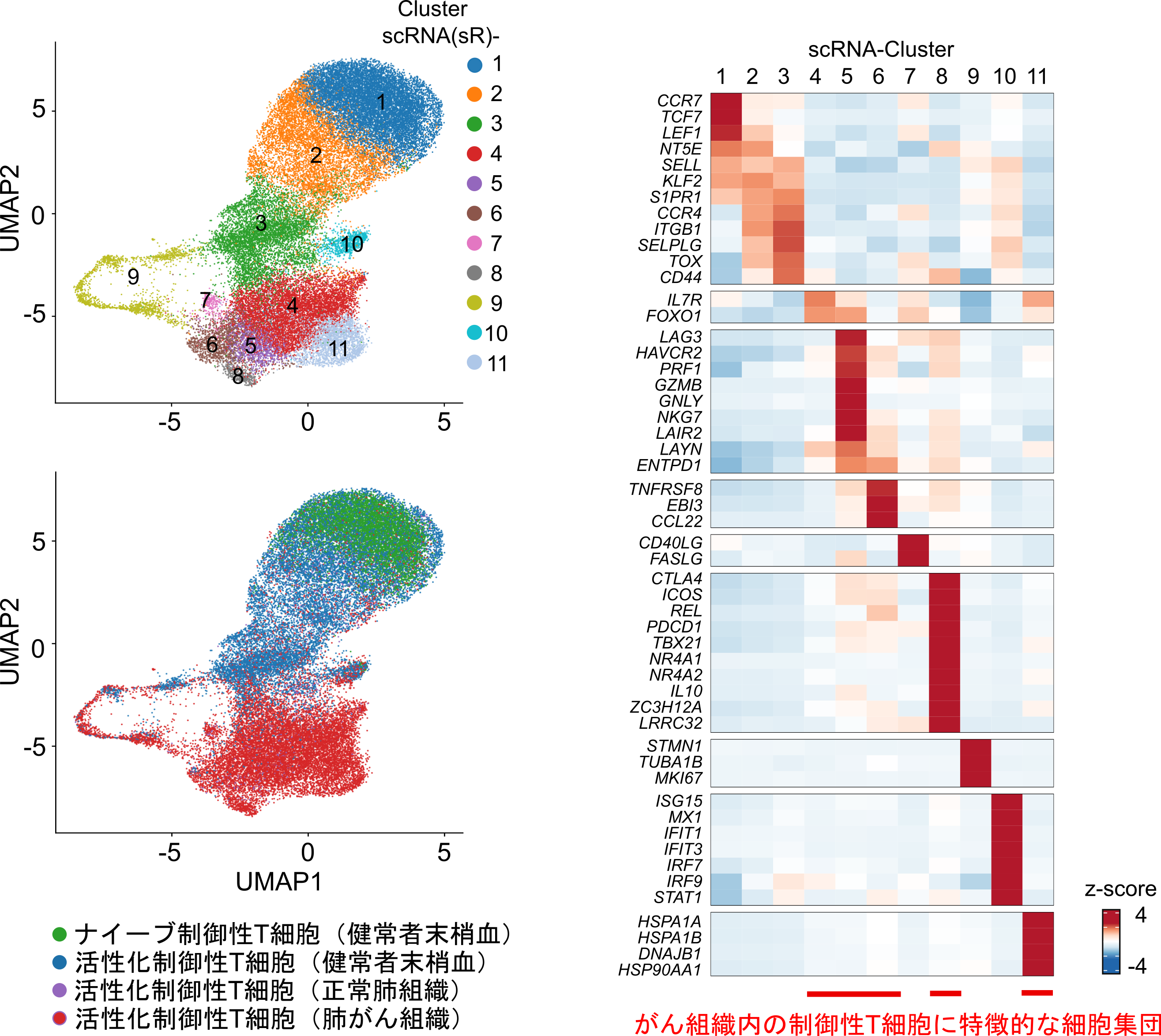
図4.制御性T細胞のシングルセルRNAシーケンス
血液、正常肺組織、肺がん組織内の制御性T細胞のシングルセルRNAシーケンスを実施し、その遺伝子発現のプロファイルから、がん組織内の制御性T細胞がさらに細分化できることを見出しました
BATFの制御性T細胞活性化における重要性が示されたことから、BATF遺伝子をノックアウト(注13)したマウスを用いて、がん組織内の制御性T細胞におけるBATFの機能をさらに検討しました。BATF遺伝子のノックアウトによって、マウスのがん組織中の制御性T細胞の数や、制御性T細胞/CD8陽性T細胞の比は著減し(図5)、その抑制活性も有意に低下しました。さらに、Ctla4、Icos、Il10、Ccr8、Tnfrsf8を始めとして、がん組織内の制御性T細胞で特に発現が上昇している遺伝子の特徴的なオープンクロマチン領域が、BATFのノックアウトによって失われることが明らかになりました。以上より、BATFは、がん組織内で制御性T細胞がその特徴的なクロマチン構造を構築し、増殖、活性化するために必須であることが解明されました。最後に、制御性T細胞のみでBATFの発現がノックアウトされるコンディショナルノックアウトマウス(注14)のBatffl/fl Foxp3EGFP-cre-ERT2マウスを作成して、がん細胞の増殖への影響を検討しました。制御性T細胞特異的にBATFがノックアウトされたマウスでは、がんの増殖が著明に低下し(図6)、がん組織内で制御性T細胞が十分に活性化して抗腫瘍免疫応答を抑制するためには、BATFが必須であることが証明され、制御性T細胞を標的としたがん免疫療法の新たな可能性が示されました。
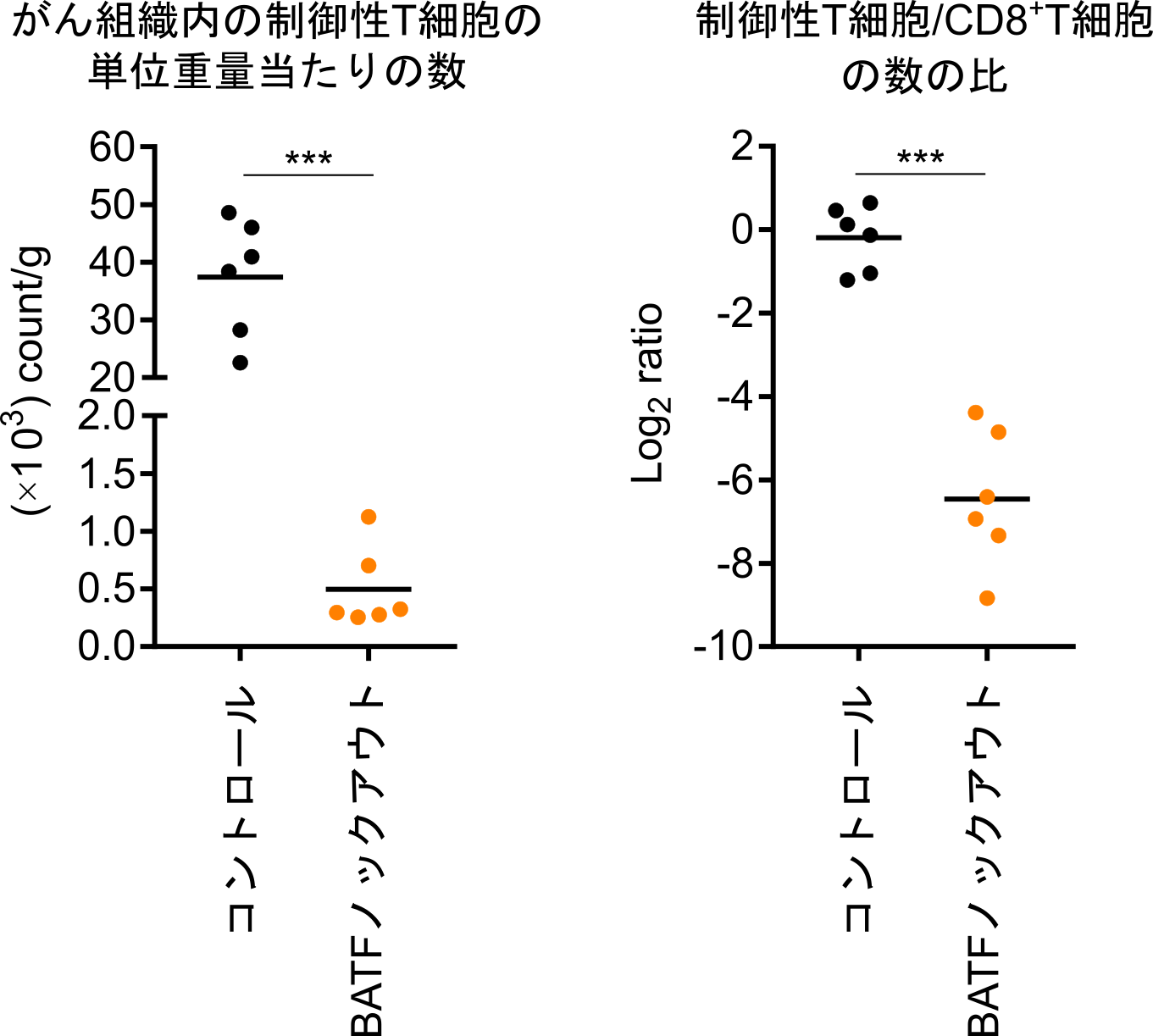
図5.BATFノックアウトの、がん組織内の制御性T細胞とCD8陽性T細胞に与える影響の評価
BATFノックアウトマウスにがん細胞を皮下移植して、がんに浸潤する免疫細胞を評価した所、制御性T細胞が著減することが確認されました。
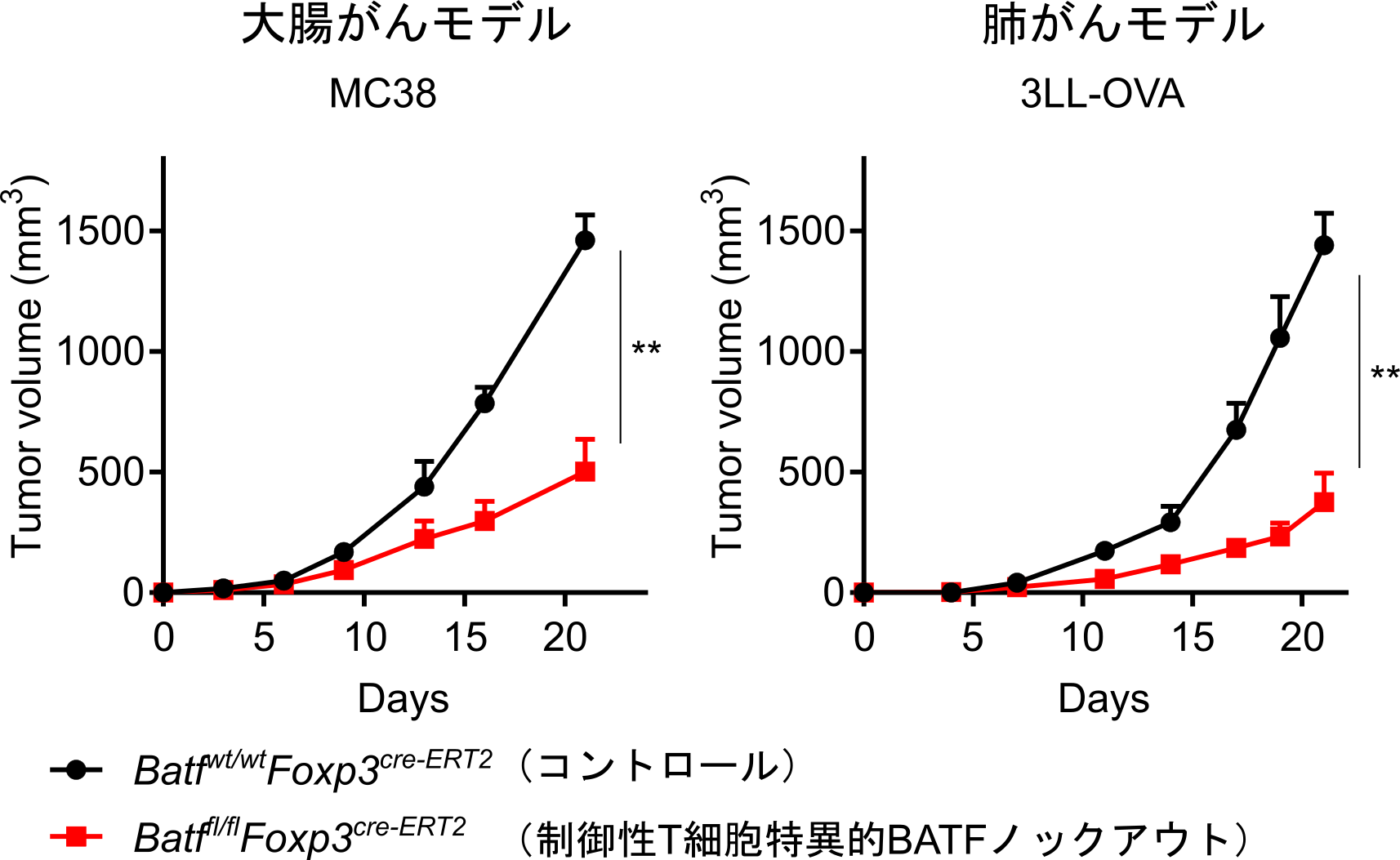
図6.制御性T細胞特異的なBATFのノックアウトの腫瘍増殖への影響
タモキシフェンという薬剤を投与すると、制御性T細胞で特異的にBATFをノックアウトできるコンディショナルノックアウトマウスを作成しました。制御性T細胞特異的にBATFをノックアウトすることにより、がん局所の抗腫瘍免疫応答が回復し、がんの増殖が抑制されました。
展望
本研究では、転写因子のBATFが、がん組織内の制御性T細胞のクロマチンのリモデリングに重要であり、 制御性T細胞の活性化プログラムのコアを担っていることを発見しました。血液、正常組織、がん組織内の制御性T細胞を詳細に解析して得られた結果は、がん組織内の制御性T細胞を標的とする免疫治療開発のみならず、制御性T細胞が発症に関わる自己免疫性疾患の理解などを始めとして、様々な医学研究に応用されることが期待されます。
発表論文
雑誌名
Science Immunology
タイトル
BATF epigenetically and transcriptionally controls the activation program of regulatory T cells in human tumors
著者
Kota Itahashi1, Takuma Irie 1, Junichiro Yuda 1,2, Shogo Kumagai1,3, Tokiyoshi Tanegashima1, Yi-Tzu Lin1,3, Sho Watanabe1, Yasushi Goto4, Jun Suzuki5, Keiju Aokage5, Masahiro Tsuboi5, Yosuke Minami2, Genichiro Ishii6, Yuichiro Ohe4, Wataru Ise7,8, Tomohiro Kurosaki8,9,10, Yutaka Suzuki11, Shohei Koyama1, and Hiroyoshi Nishikawa1,3
所属
- Division of Cancer Immunology, Research Institute/Exploratory Oncology Research & Clinical Trial Center (EPOC), National Cancer Center, Tokyo 104-0045/Chiba 277-8577, Japan
- Department of Hematology, National Cancer Center Hospital East, Chiba 277-8577, Japan
- Department of Immunology, Nagoya University Graduate School of Medicine, Nagoya 466–8550, Japan
- Department of Thoracic Oncology, National Cancer Center Hospital, Tokyo 104-0045, Japan
- Department of Thoracic Surgery, National Cancer Center Hospital East, Chiba 277-8577, Japan
- Division of Pathology, National Cancer Center Hospital East, Chiba 277-8577, Japan
- Regulation of host defense team, Division of Microbiology and Immunology, Center for Infectious Disease Education and Research, Osaka University, Osaka 565-0871, Japan
- Laboratory of Lymphocyte Differentiation, WPI Immunology Frontier Research Center, Osaka University, Osaka 565-0871, Japan
- Division of Microbiology and Immunology, Center for Infectious Disease Education and Research, Osaka University, Osaka 565-0871, Japan
- Laboratory for Lymphocyte Differentiation, RIKEN Center for Integrative Medical Sciences (IMS), Kanagawa 230-0045, Japan
- Graduate School of Frontier Sciences, The University of Tokyo, Chiba 277-8562, Japan.
掲載日
2022年10月7日(日本時間2022年10月8日)
DOI
10.1126/sciimmunol.abk0957.
URL
http://www.science.org/doi/10.1126/sciimmunol.abk0957
研究費
- 文部科学省
科学研究費助成事業 基盤研究(S)
「発がんの人種差と免疫応答の関わりの解明」
科学研究費助成事業 基盤研究(A)
「がん組織の空間的マルチスケール解析による免疫監視と免疫寛容制御機構の解明」 - 国立研究開発法人日本医療研究開発機構(AMED)
次世代がん医療創生研究事業
「がん細胞および免疫応答解析に基づくがん免疫療法効果予測診断法の確立」
次世代治療・診断実現のための創薬基盤技術開発事業
「患者層別化マーカー探索技術の開発/がん免疫モニタリングによる患者層別化を行う基盤技術の開発」
革新的先端研究開発支援事業
「腸内細菌叢のがん免疫応答への関わりの解明によるがん治療への展開」
次世代がん医療加速化研究事業
「腫瘍浸潤細胞の時間的空間的変化に基づく免疫抑制機構の解明と治療への展開 」 - 国立がん研究センターがん研究開発費
28-A-7「先端的がん免疫モニタリング法開発体制に関する研究」
31-A-7「がん免疫療法抵抗性を解除する新規治療法の臨床展開に向けた開発研究」
用語解説
注1) 制御性T細胞:
制御性T細胞は、CD4陽性T細胞の一種で、転写因子のFoxP3がマスターレギュレーターとして知られています。本来は、自己に対する免疫応答を抑制(免疫寛容)し、自己免疫疾患などにならないように働いています。がんにおいては、がんを攻撃する免疫細胞の働きを阻害することで、がんに対する免疫応答を抑制しています。
注2) 転写因子:
特定のDNA配列に結合して、遺伝子の発現を制御するタンパク質。T細胞の分化の運命決定にも寄与することがあります。
注3) PD-1/PD-L1阻害薬:
PD-1は免疫細胞上に発現する免疫チェックポイント分子であり、樹状細胞やがん細胞に発現するPD-L1やPD-L2と結合することで、免疫細胞の働きを抑制します。PD-1/PD-L1阻害薬治療によりPD-1がPD-L1と結合しなくなることで、免疫細胞が本来の働きを取り戻し、がん細胞を攻撃するようになると考えられています。
注4) クロマチン:
細胞核内の、ヒストンなどの様々なタンパク質とDNAの複合体。
注5) (クロマチン)リモデリング
クロマチン構造が変化すること。
注6) ATACシーケンス:
高活性改変型Tn5 transposaseがアクセスできるゲノム領域を選択的に濃縮、シーケンスをすることで、ゲノムワイドにクロマチンアクセシビリティを評価する手法。
注7) クロマチンアクセシビリティ:
クロマチンへの転写因子やDNA結合タンパク質のアクセスしやすさ。クロマチンアクセシビリティが高い場合、転写因子などがDNAに結合しやすい。
注8) Th17細胞:
サイトカインのIL-17 を主に産生するCD4陽性ヘルパーT細胞。
注9) プロモーター/エンハンサー
遺伝子の発現を制御するゲノム領域。プロモーターは遺伝子の上流に位置し、転写開始複合体が結合して転写が開始されるゲノム領域。エンハンサーはプロモーターに働きかけて、遺伝子の発現を調節するゲノム領域。
注10) 1細胞解析:
個々の細胞レベルで解析をすること。1細胞RNAシーケンスと1細胞ATACシーケンスでは、メッセンジャーRNAの発現とクロマチンアクセシビリティを、個々の細胞で評価・解析することで、細胞の多様性の解明や分化追跡などが可能となります。
注11) クラスタリング:
類似性の高いデータをグループ化する手法。
注12) 擬似時間解析:
遺伝子発現やクロマチンアクセシビリティなどのパターンから、擬似的な時間軸を設定し、細胞分化の軌跡を推測する方法。
注13) ノックアウトマウス:
遺伝子操作によって、特定の遺伝子を破壊し、その遺伝子の働きをなくした(ノックアウト)マウスのこと。
注14) コンディショナルノックアウトマウス:
特定の遺伝子を発現する細胞でのみ標的遺伝子のノックアウトを起こすことができる。今回は、タモキシフェン投与時にFoxP3発現細胞でのみBATF遺伝子がノックアウトされるマウスを作成しました。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター
研究所 腫瘍免疫研究分野/先端医療開発センター 免疫TR分野 西川 博嘉
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
名古屋大学医学部・医学系研究科 総務課総務係
AMED事業に関すること
日本医療研究開発機構(AMED)
次世代がん医療創生研究事業 (P-PROMOTE)
創薬事業部 医薬品研究開発課