広範な病原体のウイルス株と戦うための知見を提供する研究 Study provides insights into fighting broad range of pathogen’s viral strains
2022-11-28 カリフォルニア大学リバーサイド校(UCR)
CCHFは、感染拡大の傾向がある新興の人獣共通感染症で、世界保健機関(WHO)が優先的に取り扱う病原体とされている。CCHFが発生した場合の死亡率は最大で40%に達する。もともとは1944年から1945年にかけてクリミアで、そしてその数十年後にコンゴで報告されたこのウイルスは、最近になって渡り鳥が運ぶマダニを通じて西ヨーロッパに広がった。この病気は、アフリカ、バルカン半島、中東、アジアのいくつかの国ですでに流行している。CCHFVはバイオセーフティ・レベル4の病原体(生物学的封じ込めの最高レベル)に指定されており、カテゴリーAのバイオテロリズム/生物兵器に該当します。感染予防に役立つワクチンはなく、治療薬も不足している。
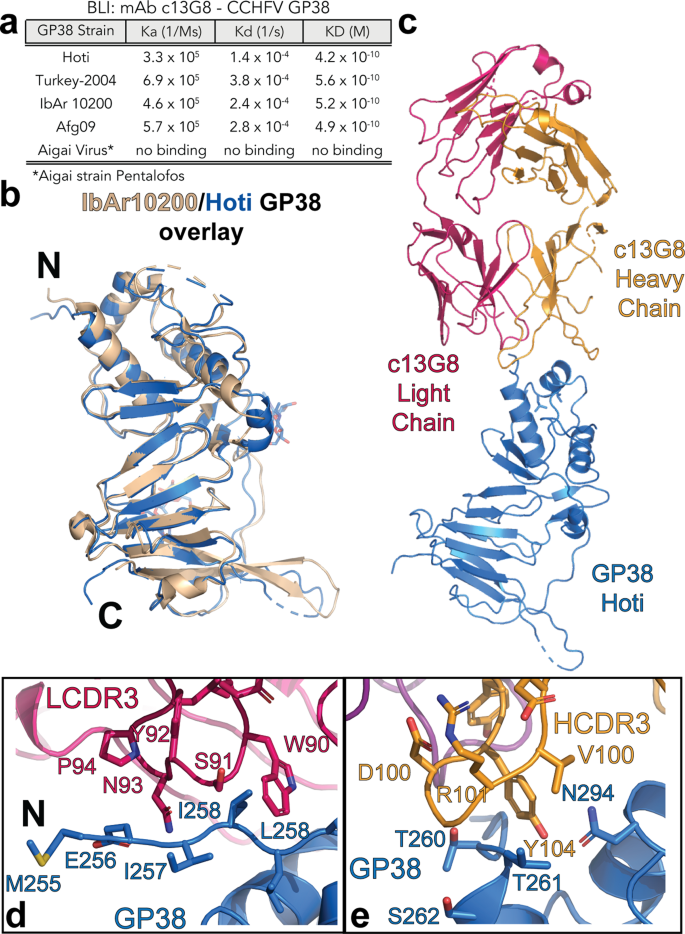
13G8がGP38と呼ばれるウイルスの糖タンパク質に結合することは分かっていましたが、その結合がどこで行われるかは明らかではありませんでした。そこで私たちは、13G8の構造を解析してその働きを理解し、結合する場所を正確に特定した。この知見は、このmAbが幅広い種類のCCHFウイルス株に有効である可能性に光を当てるものである。
研究者らは、CCHFVの生存者から7つのmAbを単離し、GP38上の2つの新しい抗原部位を特定しました。そして、13G8に加えて、7つの非中和ヒト抗体のうちの1つとGP38が結合した構造を解いた。この複合体の構造を知ることは、臨床的な利益ももたらすと著者らは述べている。
<関連情報>
- https://news.ucr.edu/articles/2022/11/28/discovery-antibody-structure-could-lead-treatment-crimean-congo-hemorrhagic
- https://www.nature.com/articles/s41467-022-34923-0
クリミア・コンゴ出血熱ウイルスに対する防御的非中和抗体の構造解析。 Structural characterization of protective non-neutralizing antibodies targeting Crimean-Congo hemorrhagic fever virus
Ian A. Durie,Zahra R. Tehrani,Elif Karaaslan,Teresa E. Sorvillo,Jack McGuire,Joseph W. Golden,Stephen R. Welch,Markus H. Kainulainen,Jessica R. Harmon,Jarrod J. Mousa,David Gonzalez,Suzanne Enos,Iftihar Koksal,Gurdal Yilmaz,Hanife Nur Karakoc,Sanaz Hamidi,Cansu Albay,Jessica R. Spengler,Christina F. Spiropoulou,Aura R. Garrison,Mohammad M. Sajadi,Éric Bergeron & Scott D. Pegan
Nature Communications Published:26 November 2022
DOI:https://doi.org/10.1038/s41467-022-34923-0
Abstract
Crimean-Congo Hemorrhagic Fever Virus (CCHFV) causes a life-threatening disease with up to a 40% mortality rate. With no approved medical countermeasures, CCHFV is considered a public health priority agent. The non-neutralizing mouse monoclonal antibody (mAb) 13G8 targets CCHFV glycoprotein GP38 and protects mice from lethal CCHFV challenge when administered prophylactically or therapeutically. Here, we reveal the structures of GP38 bound with a human chimeric 13G8 mAb and a newly isolated CC5-17 mAb from a human survivor. These mAbs bind overlapping epitopes with a shifted angle. The broad-spectrum potential of c13G8 and CC5-17 and the practicality of using them against Aigai virus, a closely related nairovirus were examined. Binding studies demonstrate that the presence of non-conserved amino acids in Aigai virus corresponding region prevent CCHFV mAbs from binding Aigai virus GP38. This information, coupled with in vivo efficacy, paves the way for future mAb therapeutics effective against a wide swath of CCHFV strains.