カリフォルニア大学サンディエゴ校の研究により、PKCαがアルツハイマー病の治療標的となる可能性があることが判明 UC San Diego study identifies PKCα as a potential therapeutic target in Alzheimer’s disease
2022-11-28 カリフォルニア大学サンディエゴ校(UCSD)
M489V変異はその後、PKCαの活性を30%程度増加させることが明らかになったが、この変異がADの神経病理に寄与しているかどうか、またどのように寄与しているかは不明なままであった。
このたび、研究者らは、PKCαのわずかな増加が、ヒトのADで観察されるのと同様の生化学的、細胞的、認知機能障害をマウスに生じさせるのに十分であることを明らかにした。
PKCαは、特に脳において、他の多くのタンパク質の機能を調節している。この酵素は、他のタンパク質にリン酸基を付加する化学反応を促進し、その活性や他の分子と結合する能力を形成している。シナプス環境におけるタンパク質のリン酸化状態を調整することで、PKCαはシナプスの機能や神経細胞のシグナル伝達に重要な役割を果たすと考えられている。
ADにおけるPKCαの役割を評価するため、複数の研究チームが共同で、まずPKCα M489V変異を持つマウスモデルを作成し、その後1年半(人間の加齢では約55年に相当)、生化学と行動の評価を行った。
3ヵ月後、変異マウスの脳は、野生型の対照マウスの脳と比較して、タンパク質のリン酸化レベルが著しく変化しており、神経系タンパク質が誤って制御されていることがわかった。4カ月半までに、このマウスの海馬の神経細胞は、シナプスの抑制や樹状突起スパインの密度低下など、いくつかの細胞変化を示した。12カ月目には、空間学習や記憶に関する行動テストの成績が低下しており、明らかに認知機能が低下していることが確認された。
研究者たちは、同様の酵素的変化がヒトの患者でも観察されるかどうかを確認するために、亡くなったAD患者と対照者のヒトの脳の前頭葉皮質におけるタンパク質レベルも測定している。その結果、AD患者の脳では、PKCαが20%増加していることがわかった。さらに、これらの脳では、既知のPKCαの基質のリン酸化が約4倍増加しており、ヒトのAD脳ではPKCαの活性が高まっていることがさらに示唆された。
著者達は、PKCαの薬理学的阻害剤が、既に、癌に使用するために開発されており、ADの治療に再利用できる可能性があることを指摘している。今後の薬剤開発では、シナプスにおけるPKCαを選択的に阻害する方法が注目されるかもしれない。
<関連情報>
- https://today.ucsd.edu/story/enzyme-drives-cognitive-decline-in-mice-provides-new-target-for-alzheimers
- https://www.nature.com/articles/s41467-022-34679-7
アルツハイマー病関連変異型プロテインキナーゼCαの活性亢進は、マウスモデルにおける認知機能低下を促進する Enhanced activity of Alzheimer disease-associated variant of protein kinase Cα drives cognitive decline in a mouse model
Gema Lordén,Jacob M. Wozniak,Kim Doré,Lara E. Dozier,Chelsea Cates-Gatto,Gentry N. Patrick,David J. Gonzalez,Amanda J. Roberts,Rudolph E. Tanzi & Alexandra C. Newton
Nature Communications Published:23 November 2022
DOI:https://doi.org/10.1038/s41467-022-34679-7
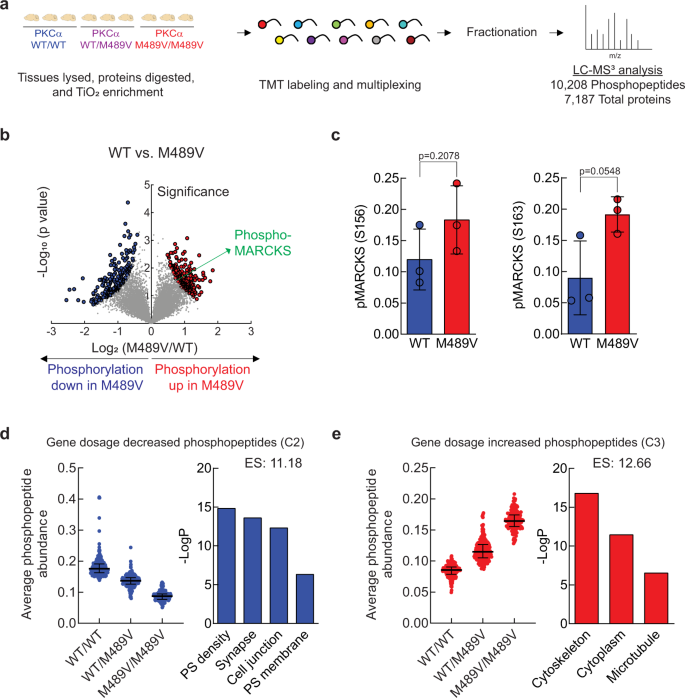
Abstract
Exquisitely tuned activity of protein kinase C (PKC) isozymes is essential to maintaining cellular homeostasis. Whereas loss-of-function mutations are generally associated with cancer, gain-of-function variants in one isozyme, PKCα, are associated with Alzheimer’s disease (AD). Here we show that the enhanced activity of one variant, PKCα M489V, is sufficient to rewire the brain phosphoproteome, drive synaptic degeneration, and impair cognition in a mouse model. This variant causes a modest 30% increase in catalytic activity without altering on/off activation dynamics or stability, underscoring that enhanced catalytic activity is sufficient to drive the biochemical, cellular, and ultimately cognitive effects observed. Analysis of hippocampal neurons from PKCα M489V mice reveals enhanced amyloid-β-induced synaptic depression and reduced spine density compared to wild-type mice. Behavioral studies reveal that this mutation alone is sufficient to impair cognition, and, when coupled to a mouse model of AD, further accelerates cognitive decline. The druggability of protein kinases positions PKCα as a promising therapeutic target in AD.