2022-12-07 慶應義塾大学,東京医科大学,国立がん研究センター,国立長寿医療研究センター
慶應義塾大学薬学部 松崎潤太郎准教授、東京医科大学医学総合研究所 落谷孝広教授らを中心とした、国立がん研究センター、国立長寿医療研究センター、東レ株式会社、株式会社Preferred Networksなどの共同研究グループは、がん患者の血清中に含まれるマイクロRNA(注1)の網羅的解析データから、「がんの種類」を高い精度で区別できることを世界に先駆けて実証しました。
本研究は、国立研究開発法人日本医療研究開発機構の次世代治療・診断実現のための創薬基盤技術開発事業の支援を受け、『体液中マイクロRNA測定技術基盤開発プロジェクト』(プロジェクトリーダー:落谷孝広教授)として国立がん研究センターを拠点に実施されたものです。国立がん研究センターバイオバンク、国立長寿医療センターバイオバンク等を活用し、膵がんや卵巣がんなどを含む13種類の固形がん9,921例と非がん対照5,643例、および各種良性疾患626例の血清マイクロRNAプロファイルを一斉に解析しました。
全体の5分の4に相当するサンプル数で機械学習モデルにマイクロRNAデータを学習させ、残りの5分の1のデータによってがんの種類を予測したところ、診断予測精度は全ステージで0.88(95%信頼区間:0.87-0.90)、特に早期診断の意義が高いステージ0からIIに限っても精度0.90(95%信頼区間:0.88-0.91)と高い性能が得られました。なお、この性能は機械学習アルゴリズムによって大きなばらつきがあり、本研究で構築した機械学習アルゴリズムの優位性も明らかとなりました。
近年、新たながん検診の戦略としてMCED(Multi-cancer Early Detection)検査(注2)への期待が高まっていますが、本研究成果より、血中マイクロRNA検査がそのひとつの戦略として有望であることが示されました。またこれを期に、本研究で得られたマイクロRNAデータと、解析に用いた機械学習コードをすべて公開しており、この研究領域のさらなる活性化を促進するためのリソースとしての活用が期待されます。
本研究成果は、2022年11月25日(米国東部時間)に米国国立癌研究所(NCI)の学術誌『JNCI Cancer Spectrum』 オンライン版に掲載されました。
本研究のポイント
- 世界で最も大規模なヒト血清マイクロRNAデータベースを公開
- 13種類のがん患者の血清マイクロRNAデータの機械学習によって、血液でがんの種類を予測できることを実証
- がんの種類を予測するために重要な複数のマイクロRNAを同定
- 重要なマイクロRNAが必ずしもがん細胞から分泌されるものではないことを示唆
研究の背景
悪性新生物(がん)は本邦の死因順位の第1位であり、全死亡者の25%以上を占めています。がん死亡を減少させるために、簡便ながんの早期診断技術の開発が待望されています。各臓器に特化した様々な診断技術が着実に進歩している一方、単一の低侵襲検査システムによって多種の悪性腫瘍を一度にスクリーニングできる「多がん早期検出(multi-cancer early detection: MCED)」技術の実用化が現実味を帯びつつあります。MCEDの検出対象物として最も有望なのは血液であり、そこに含まれる細胞外DNA(cell-free DNA:cfDNA)、細胞外RNA、エクソソームなど細胞外小胞(注3)、血小板(tumor-educated platelet)中のRNAなどによる検査技術開発が進行しています。
血中の細胞外RNAのうち、最も量が多く含まれているものがマイクロRNA (miRNA)です。miRNAは細胞外小胞に包含されるなどの様式で細胞外へ分泌され、他の細胞に取り込まれることによって、細胞間コミュニケーションツールとしての役割を担うことがあります。腫瘍サイズが小さい段階から、腫瘍細胞やその周辺の細胞などが通常とは異なるmiRNAの分泌を自律的に開始することから、従来の腫瘍マーカーよりもその変化が早く血中に現れやすく、がん早期診断に適しているのではないかと考えられています (図1)。
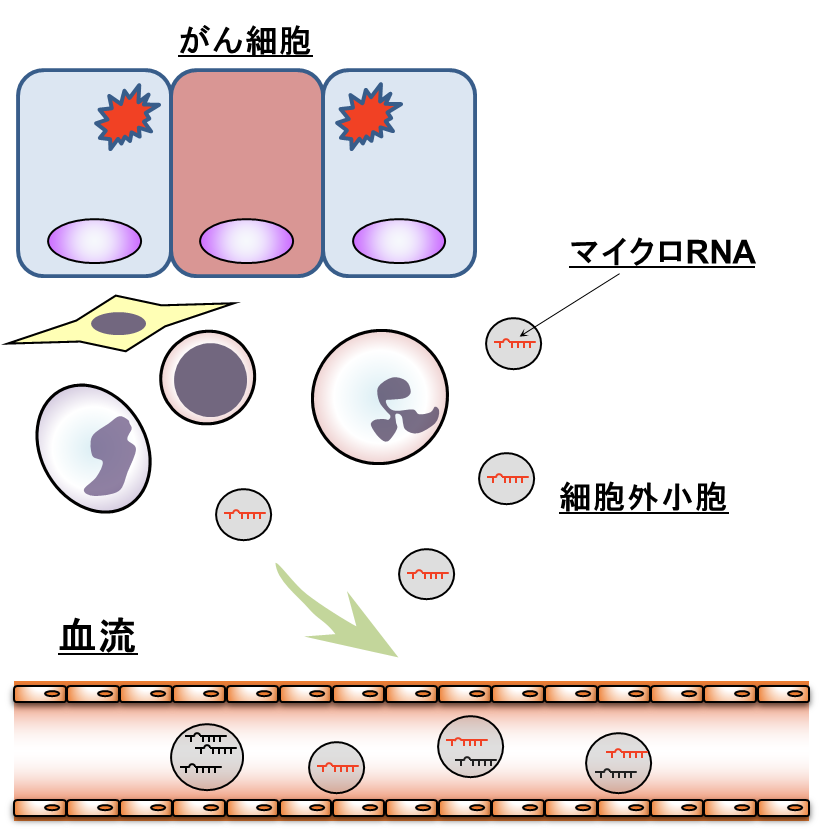
図1. がん患者における血中miRNA変化の模式図
がん細胞自身や、その存在を感知した周辺細胞などが、健常時とは異なるmiRNAを分泌することにより、血中miRNAパターンに変化が生じる。
研究の内容・成果
血中miRNA診断の実用化への取り組みを加速させるため、2014年より国立研究開発法人日本医療研究開発機構の次世代治療・診断実現のための創薬基盤技術開発事業の支援を受け、『体液中マイクロRNA測定技術基盤開発プロジェクト』が実施されました。国立がん研究センターバイオバンク、国立長寿医療研究センターバイオバンク等を活用し、固形がん9,921例[乳がん675例、膀胱がん399例、胆道がん402例、大腸がん1,596例、食道扁平上皮がん566例、肺がん1,699例、胃がん1,418例、肝細胞がん348例、膵がん851例、前立腺がん1,027例、卵巣がん400例、骨軟部肉腫299例、脳腫瘍241例]と非がん対照5,643例、および各種良性疾患626例の血清miRNAプロファイルを一斉に解析しました。
全体の5分の4に相当するサンプル数で機械学習モデルにmiRNAデータを学習させ、残りの5分の1のデータによってがんの種類を予測したところ、診断予測精度は全ステージで0.88(95%信頼区間:0.87-0.90)、特に早期診断の意義が高いステージ0からIIに限っても精度0.90(95%信頼区間:0.88-0.91)と高い性能が得られました。(図2)
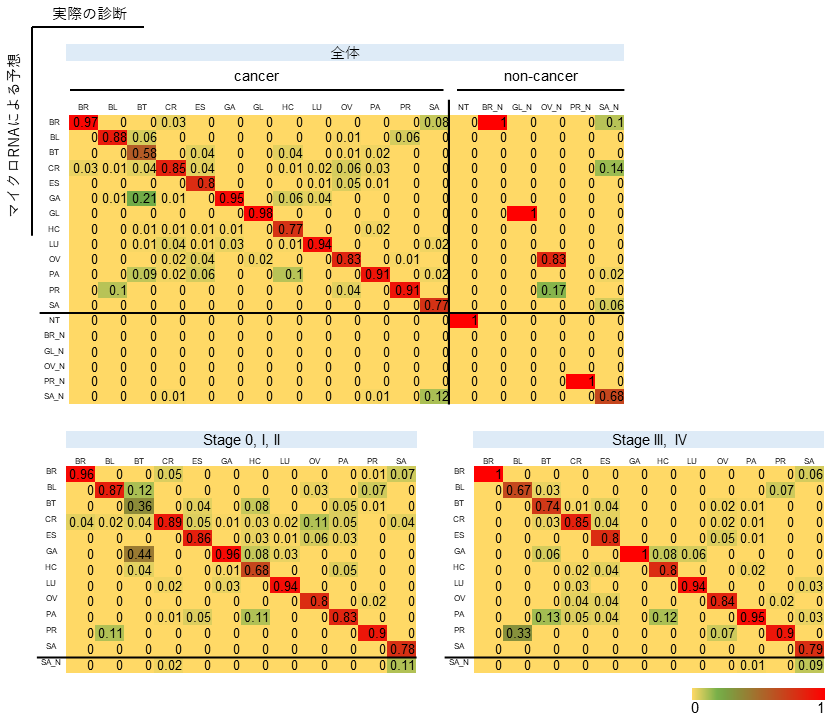
図2. 13種類の固形がんの診断予測精度
数字は正しく診断された割合(%)を示す。診断ステージ0からIIにおいても、ステージIII~IVと同等の性能がみられ、早期診断ツールとしての活用が期待できる。胆道がんは他がんに比べて診断難易度が高いことも判明した。
(BR: 乳がん、BL: 膀胱がん、BT: 胆道がん、CR: 大腸がん、ES: 食道扁平上皮がん、GA: 胃がん、GL: 脳腫瘍、HC: 肝細胞がん、LU: 肺がん、OV: 卵巣がん、PA: 膵がん、PR: 前立腺がん、SA: 骨軟部肉腫)
なお、この性能は機械学習アルゴリズムによって大きな差異があり、機械学習の最適化の重要性も明らかとなりました。研究グループでは、血中miRNA診断に最適なアルゴリズムとして、深層学習を含む階層的アンサンブルアルゴリズム (the Hierarchical Ensemble Algorithm with Deep learning: HEADモデルと命名)を構築し、上記の診断予測精度を達成しました。(図3)

図3. 機械学習の種類による診断精度の差異
用いる機械学習アルゴリズムによっては、HEADモデルよりも診断性能が大きく劣っていた。
さらに本研究で作成したデータベースに加えて、公開されているmiRNA情報も活用することで予測精度を向上させる「転移学習」が活用できることや、この統合情報より、がんの種類を予測するために重要なmiRNAの絞り込みを行った結果も報告しました。(図4)
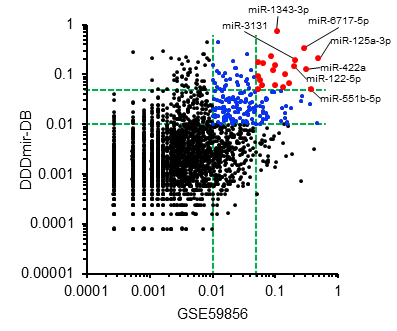
図4. がん種診断への寄与度が高いmiRNA
横軸、縦軸はそれぞれ公開データ、今回構築したデータベースでのがん種判別の寄与度を示す。
今後の展開
本研究の成果は、バイオバンクに保管された血清を用いて得られたものです。新たに収集した血清検体でもこの結果が再現されるかどうか、検証を進めています。また本研究で見出した、特に注目すべきmiRNAの血中での含有量が、どのようなメカニズムで調節されているのかを引き続き追究しています。本研究で得られたmiRNAデータと、解析に用いた機械学習コードはすべて公開しており、この研究領域のさらなる活性化を促進するためのリソースとしての活用が期待されます。
なお、研究に使用した血清は、国立がん研究センターバイオバンク、国立長寿医療研究センターバイオバンク等から提供いただきました。試料提供にご協力・ご賛同してくださった患者・家族の皆様へも深く御礼を申し上げます。引き続き、生体試料を用いた研究に対するご理解とご支援をお願いいたします。
論文情報
タイトル
Prediction of tissue-of-origin of early-stage cancers using serum miRNomes
著者名
Juntaro Matsuzaki, Ken Kato, Kenta Oono, Naoto Tsuchiya, Kazuki Sudo, Akihiko Shimomura, Kenji Tamura, Sho Shiino, Takayuki Kinoshita, Hiroyuki Daiko, Takeyuki Wada, Hitoshi Katai, Hiroki Ochiai, Yukihide Kanemitsu, Hiroyuki Takamaru, Seiichiro Abe, Yutaka Saito, Narikazu Boku, Shunsuke Kondo, Hideki Ueno, Takuji Okusaka, Kazuaki Shimada, Yuichiro Ohe, Keisuke Asakura, Yukihiro Yoshida, Shun-ichi Watanabe, Naofumi Asano, Akira Kawai, Makoto Ohno, Yoshitaka Narita, Mitsuya Ishikawa, Tomoyasu Kato, Hiroyuki Fujimoto, Shumpei Niida, Hiromi Sakamoto, Satoko Takizawa, Takuya Akiba, Daisuke Okanohara, Kouya Shiraishi, Takashi Kohno, Fumitaka Takeshita, Hitoshi Nakagama, Nobuyuki Ota, Takahiro Ochiya, and the Project Team for Development and Diagnostic Technology for Detection of miRNA in Body Fluids
雑誌
JNCI Cancer Spectrum
DOI
10.1093/jncics/pkac080
miRNAデータ
https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE211692
機械学習コード
https://github.com/pfnet-research/head_model
用語説明
(注1)血中マイクロRNA
ヒトの細胞に存在する22塩基長程度の小さなRNAのことで、血液や唾液、尿などの体液にも含まれます。近年の研究で、がん等の疾患にともなって患者の血液中でその種類や量が変動することが明らかになっています。さらに、こうした血液中のマイクロRNA量は、抗がん剤の感受性の変化や転移、がんの消失等の病態の変化に相関するため、新しい診断マーカーとして期待されています。
(注2)MCED検査
多がん早期検出検査。血液など採取が容易な単一サンプルから複数の種類のがんを発見する手法です。がん患者の血液には、特徴的なDNAやRNA、蛋白質の断片などが含まれていることが明らかになっており、これらを網羅的にチェックすることで、その人ががんにかかっているかどうか、また、どの臓器からがんが発生したかを予測可能であると示唆されています。MCED検査が陽性であれば、診断を確定させるための画像検査など他の検査も必要になります。
(注3)細胞外小胞
細胞と同様に脂質二重膜で形作られた小胞であり、膜表面やその内部に多様な蛋白質、DNA、RNAを抱合しています。全身のすべての細胞が細胞外小胞を分泌すると考えられており、放出された細胞外小胞が他の細胞に取り込まれることによって、細胞間コミュニケーションツールとしての役割を担っています。
問い合わせ
研究内容についての問い合わせ先
慶應義塾大学薬学部 薬物治療学講座
准教授 松崎 潤太郎 (まつざき じゅんたろう)
東京医科大学 医学総合研究所 分子細胞治療研究部門
教授 落谷 孝広 (おちや たかひろ)
国立研究開発法人 国立長寿医療研究センター
研究推進基盤センター長 新飯田 俊平 (にいだ しゅんぺい)
報道窓口
慶應義塾広報室(澤野)
学校法人東京医科大学 企画部 広報・社会連携推進室
国立がん研究センター 企画戦略局 広報企画室
国立研究開発法人 国立長寿医療研究センター
総務係長(広報係長 併任) 伊藤 大佑 (いとう だいすけ)