2022-12-19 理化学研究所,慶應義塾大学,科学技術振興機構
理化学研究所(理研)生命医科学研究センター メタボローム研究チームの内野 春希 大学院生リサーチ・アソシエイト(慶應義塾大学大学院 薬学研究科 博士課程4年)、津川 裕司 客員研究員(東京農工大学 グローバルイノベーション研究院 テニュアトラック准教授)、有田 誠 チームリーダー(慶應義塾大学 薬学部・薬学研究科 教授)らの共同研究チームは、脂質の生理機能を理解するうえで重要な炭素間二重結合(C=C)位置をアンバイアスかつ網羅的に決定できる新しいノンターゲットリピドミクス[1]技術を開発しました。
本研究成果は、従来法では解析が困難であったオメガ3[2]、オメガ6[2]などに代表される脂肪酸側鎖情報を明確に識別するものであり、脂質の持つ構造多様性の解明、さらには脂質代謝の異常を伴う病態メカニズムの理解に貢献すると期待できます。
今回、共同研究チームは、質量分析によるC=C位置の解析を可能にするため、C=C位置に特異的な解離を引き起こすフラグメンテーション法[3]「Oxygen Attachment Dissociation: OAD」を利用した解析技術を確立しました。次に、この技術を用いて得られた85種の脂質標準品のタンデム質量分析(MS/MS)[4]のデータ(OAD-MS/MSスペクトル[5])を詳細に解析し、その解離機構をルール化することで、複雑なOAD-MS/MSデータを解析するソフトウェア「MS-RIDD」を開発しました。この技術をヒトやマウス組織等の実際の生体試料への脂質解析へ適応したところ、合計648分子種のC=C位置を含めた脂質構造の決定に成功しました。これらの脂質構造には、従来法では決定できなかったC=C位置が多数含まれており、本開発技術の有効性が示されました。
本研究は、科学雑誌『Communications Chemistry』オンライン版(12月19日付)に掲載されました。
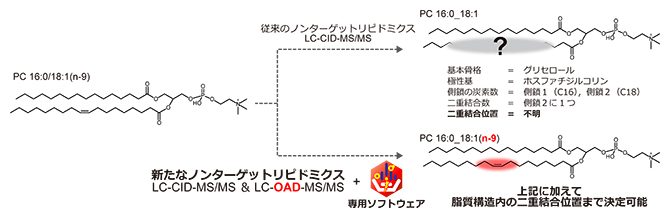
新たなフラグメンテーション法(OAD)と情報科学によって脂質の二重結合位置を特定
背景
脂質は、細胞膜を構成する以外に、シグナル分子やエネルギー源、皮膚バリアなどの機能を持つ必須の生体分子です。これらの多彩な生理機能は、脂質の持つ構造多様性に支えられています。脂質の構造は、基本骨格(グリセロールやアミノ酸など)、極性基(ホスファチジルコリンなど)、アシル基(アラキドン酸やドコサヘキサエン酸などの脂肪酸)の組み合わせから成り(図1)、その多様性はデータベースに登録されているもので4万種以上、さらに微細な構造の違いを含めると10万種以上とも推定されています(図2)。特に、脂質構造内の炭素間二重結合(C=C)の位置は、生体膜の物性、代謝反応などの基質選択性、シグナル伝達物質の生理機能を左右する重要な因子です。
脂質の構造解析には、液体クロマトグラフィータンデム質量分析(LC-MS/MS)[6]に衝突誘起解離法(Collision Induced Dissociation: CID)と呼ばれるフラグメンテーション法を利用する手法(LC-CID-MS/MS)が頻用されます(図2)。CIDでは、イオン化した分子に衝突エネルギーを加え、アルゴンなどの不活性ガス中へ通過させることで、分子構造を解離します。LC-CID-MS/MSによって、脂質構造の基本骨格、極性基、側鎖の炭素組成(炭素数とC=C数)までが把握できます。
一方、CIDではC=C位置に依存する解離が起こらず、その位置を示す断片化イオン(フラグメントイオン)を含むデータを取得することは困難でした。こうした背景から、C=Cを解離する新たなフラグメンテーション法が開発されてきました。それらの内、共同研究チームは、C=Cを特異的に解離するフラグメンテーション法「Oxygen Attachment Dissociation: OAD」に着目しました。OADは、質量分析装置内の衝突セルへヒドロキシラジカル(・OH)や酸素原子(O)を導入し、ラジカル反応[7]を起こさせることで、C=C位置特異的な断片化イオンを計測する方法です。
この手法は、誘導体化などの特別な前処理を必要とせず、LC-CID-MS/MSと同じ生体試料を分析できます。一方、幅広い脂質種を捉えるノンターゲットリピドミクスへの応用や、CIDとOADで得られるマススペクトルを統合解析するためのソフトウェアは存在せず、得られたデータを十分に生かすことができていませんでした。
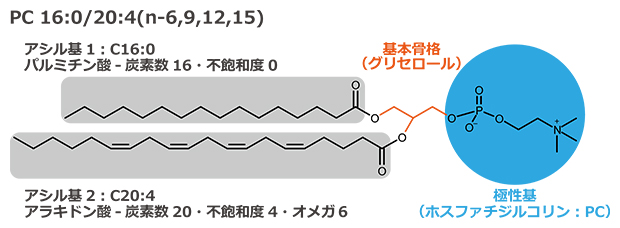
図1 脂質の分子構造
脂質は基本骨格(グリセロールやアミノ酸など)、極性基(ホスファチジルコリンなど)、アシル基(アラキドン酸やドコサヘキサエン酸などの脂肪酸)の組み合わせから構成される。
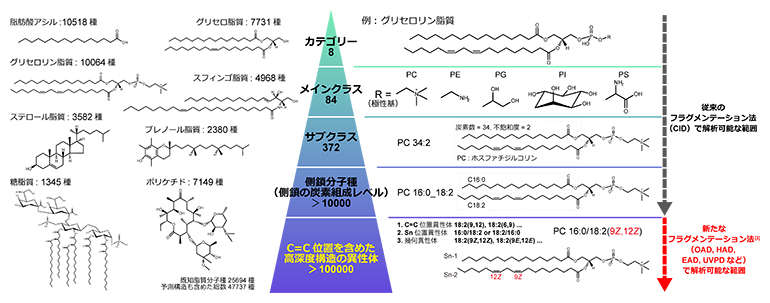
図2 脂質の構造多様性とそれらを捉える質量分析法
研究手法と成果
共同研究チームはまず、85種の脂質標準品を分析し、脂質構造とOADスペクトルの関連性を検証しました。その結果、OADはさまざまな脂質クラス(リン脂質、スフィンゴ脂質、グリセロ脂質、脂肪酸アシル)と側鎖タイプ(O-アシル基、N-アシル基、スフィンゴ塩基骨格)内のC=C位置を解析できることが分かりました。さらに、得られたOAD-MS/MSスペクトル(OADで得られるC=C位置の情報を含んだスペクトルデータ)に基づき、脂質分子中のC=C位置からフラグメントイオンが解離する仕組みをルール化しました(図3)。
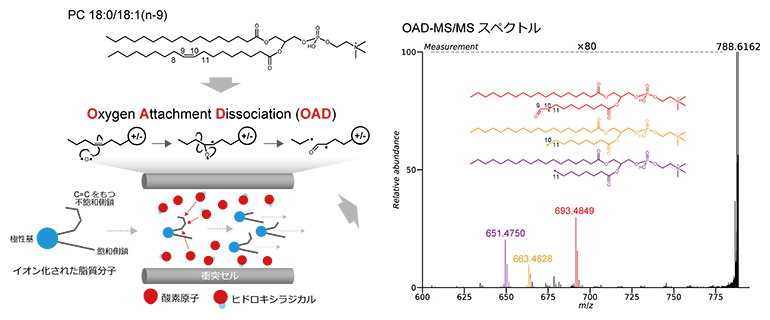
図3 脂質標準品より得たOAD-MS/MSスペクトル
標準品を分析したマススペクトルより、OADでは、C=C構造の前後の炭素間結合を含めた3カ所でフラグメンテーション(解離)が生じることが分かった。
脂質標準品の分析結果から、基本骨格、極性基、側鎖の炭素組成を捉えるLC-CID-MS/MSとC=C位置を捉えるLC-OAD-MS/MSの二つを併用することで、構造解析の確かさが高まることが予想されました。そこで、CIDとOADの両方を行う新たなノンターゲットリピドミクスプラットフォームを構築しました(図4)。
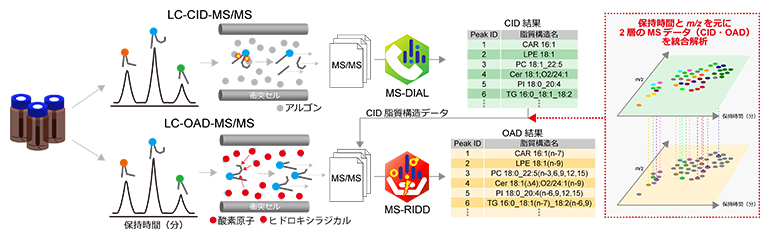
図4 本研究で構築した新しいノンターゲットリピドミクスの流れ
簡便な脂質抽出法(一層抽出)で得た検体に対して、LC-CID-MS/MSとLC-OAD-MS/MSを行う。LCの分析条件は共通しているので、同じ溶出時間と質量情報(m/z)に基づき、両データの統合解析が可能である。
データの解析には、二つのソフトウェアを使用しました。一つはこれまでに共同研究チームが開発した「MS-DIAL(Mass Spectrometry-Data Independent AnaLysis)」注1~4)で、これによってCID-MS/MSデータの解析およびOAD-MS/MSデータのピーク検出を行います。次に、今回新たに開発した「MS-RIDD(Mass Spectrometry-Radical Induced Dissociation Decipherer)」により、OADスペクトルから脂質構造情報を抽出しました(図5)。このソフトウェアの精度を、標準品および培養細胞に作らせた答えの分かっている脂質構造のスペクトルを用いて検証した結果、最適なパラメータ条件下で97%以上の正解率を出力できることが分かりました。
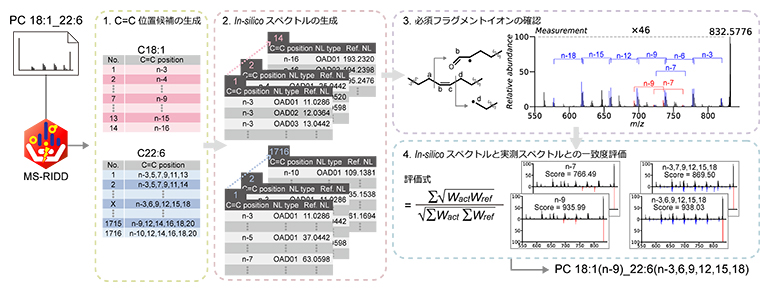
図5 OAD-MS/MS解析ソフトウェア「MS-RIDD」の構造決定アルゴリズム
CIDデータに由来する脂質構造情報とOAD-MS/MSスペクトルに基づいて、C=C位置の理論上可能な候補を網羅的に想定し、対応するインシリコスペクトルと実測スペクトルとの評価を通じて、C=Cを含めた構造情報を出力する。
最後に、今回構築した解析基盤を用いて、ヒト血漿やマウス組織のノンターゲットリピドミクスを行いました。その結果、合計648分子種の脂質について、C=C位置も含めた構造決定に成功しました。本手法により、これまで困難だった複合脂質中のC=C位置を、酵素的処理や化学的処理を行うことなく解析できるようになりました。
マウスの眼・精巣・脳では、炭素数28以上の超長鎖多価不飽和脂肪酸を側鎖に持つ脂質が多く存在しており、それらが組織ごとの特殊な脂質環境を形成し、恒常性を維持していると考えられています。今回の解析により、オメガ3/オメガ6の両方が構造として成立する不飽和度5(C=Cが5個)の超長鎖側鎖について、脳ではオメガ3/オメガ6の両方、眼ではオメガ3、精巣ではオメガ6が存在し、組織間で明確に異性体組成が異なることが判明しました(図6)。本技術は、このような違いがなぜ生まれ、どのように機能しているのかといった新たな生命科学の疑問・仮説を生み出す基盤となり得ます。
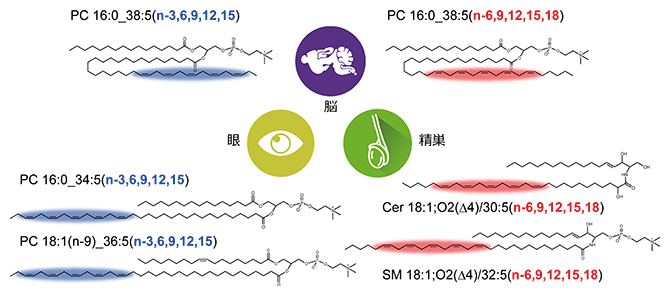
図6 本技術基盤で高深度に捉えた組織特徴的な脂質構造
本分析系の検出感度範囲において、不飽和度5(C=Cが五つ)の超長鎖側鎖のC=C位置は、マウスの脳ではオメガ3/オメガ6の両方、眼ではオメガ3、精巣ではオメガ6が存在することが判明した。青色はオメガ3を、赤色PCはオメガ6のC=C位置を表している。PCはホスファチジルコリン、Cerはセラミド、SMはスフィンゴミエリンという脂質サブクラスを示す。
注1)2015年5月5日プレスリリース「生体内の低分子化合物を網羅的に捉える解析プログラムを開発」
注2)2017年11月28日プレスリリース「未開拓の代謝物を次世代メタボローム解析により発見」
注3)2019年3月29日プレスリリース「情報科学で生体内の多様なメタボロームを包括的に解明」
注4)2020年6月16日プレスリリース「生命の脂質多様性を解明」
今後の期待
本研究成果は、脂質の代謝や生理機能に寄与する微細な構造差異であるC=C位置を明確に捉える高深度構造解析を可能とし、脂質が関わるさまざまな病態メカニズムの解明に大きく貢献すると期待できます。
本研究で使用したOADは、原理上、ラジカル源[7]を衝突セルへ導入することでさまざまな質量分析装置への適応が可能です。今後はこの汎用性を生かして、脂質の空間分布を捉える質量分析イメージングと高深度構造解析の融合も視野に研究を進めたいと考えています。一方、本解析技術には、改善の余地も残されています。分析化学と情報科学の両方の研究開発を継続することで、今後も新たなリピドミクス解析技術を発信し続けたいと考えています。
補足説明
1.ノンターゲットリピドミクス
分析対象をあらかじめ限定せずに、質量分析装置に導入された全分子を分析する脂質解析法。一方、分析対象をあらかじめ設定して解析するものをターゲットリピドミクスと呼ぶ。ノンターゲットリピドミクスには、取得できる情報が多いという利点と、データが複雑になるという難点がある。そのため、計測系を構築・改良する分析化学とソフトウェア開発を含めた情報科学の両分野の研究開発が必要となる。
2.オメガ3、オメガ6
脂肪酸や複合脂質の側鎖構造において、メチル鎖末端から数えた3位に最初のC=Cを持つ分子をオメガ3、6位にC=Cを持つ分子をオメガ6と呼ぶ。オメガ3はn-3、オメガ6はn-6とも表記される。オメガ3やオメガ6の脂肪酸は、ヒトやマウスにおいて全合成できないため、食事から摂取されるα-リノレン酸(オメガ3)やリノール酸(オメガ6)は必須脂肪酸とされている。その他の代表的な例として、オメガ3のエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)、オメガ6のアラキドン酸が存在する。
3.フラグメンテーション法
タンデム質量分析(MS/MS)において、分析物の詳細な構造情報(断片化イオン、フラグメントイオン)を得るためにイオンを解離する手法のこと。頻用される衝突誘起解離法(CID)が従来法と位置づけられる一方で、CIDでは構造情報を取得できない二重結合位置や二重結合の幾何異性、Sn位置などが解析できる手法も研究開発が近年進んでおり、これらは新しいフラグメンテーション法と位置づけられる。本研究で用いたOAD以外にも、新しいフラグメンテーション法として水素ラジカル誘起解離法(HAD)、紫外光解離法(UVPD)、電子励起解離法(EAD)などが考案・研究されている。
4.タンデム質量分析(MS/MS)
質量分析(Mass spectrometry: MS)は、分子や原子を各種のイオン化法でイオン化し、検出することで分析物の「質量」を計測する分析法。タンデム質量分析(MS/MS)では、一つのイオンに対して2回の質量分析を行う。1回目はイオン化された全分子の質量を計測し(MS1)、2回目は詳細な構造情報を取得するためにイオンにエネルギーや反応を加え、生じた断片化イオンを計測する(MS2)。イオン量が多いものに絞ってMS/MSを取得するData dependent acquisition法と、全イオンのMS/MSを取得するData independent acquisition法がある。
5.MS/MSスペクトル
タンデム質量分析(MS/MS)によって得られるマススペクトル。MS/MSスペクトルには、分析対象となった分子の部分構造の情報(フラグメントイオン)が含まれ、解析することで分子の詳細な構造決定ができる。タンデム質量分析と組み合わせるフラグメンテーション法の情報を含めて、CID-MS/MSスペクトルやOAD-MS/MSスペクトルのようにも表される。
6.液体クロマトグラフィータンデム質量分析(LC-MS/MS)
液体クロマトグラフィーとタンデム質量分析を組み合わせた分析手法。まず、液体クロマトグラフィーで脂質分子の物性の違いに応じて分子を分離し、次いで質量分析装置へと導入する。質量分析装置では、分子がイオン化され、イオン全体の質量と、イオンを断片化した部分構造の質量を計測する。組み合わせるフラグメンテーション法の情報を含めて、LC-CID-MS/MSやLC-OAD-MS/MSのようにも表される。
7.ラジカル反応、ラジカル源
不対電子を持つ分子やイオンが引き起こす化学反応とその生成源。本研究の分析条件では、2.45GHzのマイクロ波を水に放電して不対電子を持つヒドロキシラジカル(・OH)と酸素原子(O)を生成し、それらを質量分析装置内の衝突セルへ導入し、電子密度の高いC=C構造と反応させて解離を引き起こした。
共同研究チーム
理化学研究所 生命医科学研究センター メタボローム研究チーム
大学院生リサーチ・アソシエイト 内野 春希(ウチノ・ハルキ)
(慶應義塾大学大学院 薬学研究科 博士課程4年)
客員研究員 津川 裕司(ツガワ・ヒロシ)
(東京農工大学 グローバルイノベーション研究院 テニュアトラック准教授)
チームリーダー 有田 誠(アリタ・マコト)
(慶應義塾大学 薬学部・薬学研究科 教授)
株式会社島津製作所
課長 高橋 秀典(タカハシ・ヒデノリ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究「脂質クオリティが解き明かす生命現象(領域代表者:有田誠)」、同基盤研究(B)「統合オミクス研究に資する質量分析インフォマティクスによる新規代謝制御機構の解明(研究代表者:津川裕司)」、科学技術振興機構(JST)ライフサイエンスデータベース統合推進事業 統合化推進プログラム「物質循環を考慮したメタボロミクス情報基盤(研究代表者:有田正規)」、同戦略的創造推進事業ERATO「有田リピドームアトラスプロジェクト(研究総括:有田誠)」の助成を受けて行われました。
原論文情報
Haruki Uchino, Hiroshi Tsugawa, Hidenori Takahashi, Makoto Arita, “Computational mass spectrometry accelerates C=C position-resolved untargeted lipidomics using oxygen attachment dissociation”, Communications Chemistry, 10.1038/s42004-022-00778-1![]()
発表者
理化学研究所
生命医科学研究センター メタボローム研究チーム
大学院生リサーチ・アソシエイト 内野 春希(ウチノ・ハルキ)
(慶應義塾大学大学院 薬学研究科 博士課程4年)
客員研究員 津川 裕司(ツガワ・ヒロシ)
(東京農工大学 グローバルイノベーション研究院 テニュアトラック准教授)
チームリーダー 有田 誠(アリタ・マコト)
(慶應義塾大学 薬学部・薬学研究科 教授)
JST事業に関すること
今林文枝(イマバヤシ・フミエ)
科学技術振興機構 研究プロジェクト推進部 ICT / ライフイノベーショングループ
報道担当
理化学研究所 広報室 報道担当
慶應義塾広報室
科学技術振興機構 広報課