ハイドロゲルを用いた足場は、より優れたブレイン・コンピュータ・インターフェイスに利用できる可能性がある Hydrogel-based scaffolds could be used for better brain-computer interfaces
2023-01-09 ハーバード大学
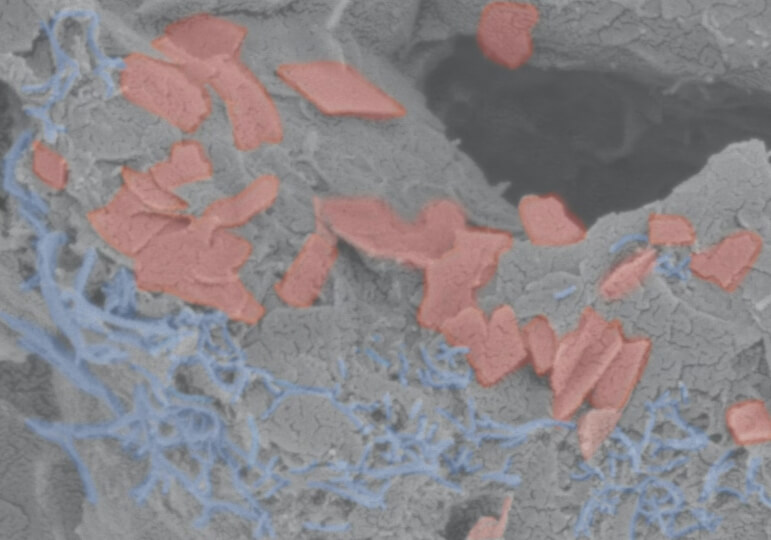
The scaffold consists of a soft hydrogel (gray) that contains carbon nanotubes (blue) and graphene flakes (red) as conductive materials to transmit electrical impulses throughout the scaffold. (Wyss Institute at Harvard University)
この問題は、ハーバード大学John A. Paulson School of Engineering and Applied Sciences(SEAS)、ハーバード大学Wyss Institute、MITで開発された新しいタイプの導電性ハイドロゲルの足場によって解決されました。この足場は、脳組織の柔らかく多孔質の状態を模倣するだけでなく、ヒト神経前駆細胞(NPC)の成長と複数の異なる脳細胞タイプへの分化を最大12週間までサポートします。この成果は、Advanced Healthcare Materials誌で報告されています。
「この導電性ハイドロゲルを用いた足場は、大きな可能性を秘めています。この足場は、試験管内でヒトの神経ネットワークの形成を研究するために使用できるだけでなく、患者の脳組織とよりシームレスに統合し、その性能を向上させ、損傷のリスクを低減する埋め込み型バイオハイブリッドBCIの作成を可能にするかもしれません」と、筆頭著者のクリスティーナ・トリンジデス博士(22)は語っている。
トリンギデス教授と彼女のチームは、脳の自然なカーブやくぼみに沿うように「流れる」ことができる、より柔らかい電極を作ろうと考え、2021年に最初のハイドロゲルを用いた電極を開発した。この電極が脳組織と高い親和性を持つことを実証した一方で、生きた細胞にとって最も親和性の高い物質は他の細胞であることもわかっていた。そこで研究チームは、電極自体に生きた脳細胞を組み込んでみることにした。そうすれば、電極を埋め込んだ患者の脳に、より自然な細胞同士の接触によって電気信号を伝達できる可能性がある。
そこで、導電性ハイドロゲルの製造工程に凍結乾燥の工程を加え、細胞がより住みやすい環境を整えた。凍結乾燥でできた氷の結晶の周囲に、ハイドロゲルの材料が集中するようにしたのだ。氷の結晶が蒸発すると、導電性ハイドロゲルに囲まれた孔が残り、多孔質の足場が形成された。この構造により、細胞が成長するための十分な表面積が確保され、導電性成分がハイドロゲル内で連続した経路を形成し、すべての細胞にインパルスが伝達されるようになった。
研究チームは、ハイドロゲルの配合を変えて、粘弾性(ゼリーのような)、弾性(輪ゴムのような)、軟質、硬質の足場材を作成した。そして、これらの足場上でヒト神経前駆細胞(NPC)を培養し、どの物性の組み合わせが神経細胞の成長と発達を最もよくサポートするかを調べたのである。
粘弾性のある柔らかいゲル上で培養したNPGは、足場上に格子状のネットワークを形成し、5週間後には特定の特徴を持つ複数の細胞型に分化した。一方、弾性ゲル上で培養した細胞は、大部分が未分化なNPCで構成される塊を形成していた。研究チームはまた、ハイドロゲル材料内の導電性材料の量を変化させ、それが神経の成長と発達にどのような影響を及ぼすかを確認した。その結果、導電性の高い足場ほど、細胞は塊ではなく、(生体内で見られるような)枝分かれしたネットワークを形成していた。
次に研究チームは、ハイドロゲルの足場内で発生したさまざまな種類の細胞を分析した。その結果、物理的にも代謝的にもニューロンを支えるアストロサイトは、粘弾性ゲル上で培養した場合と弾性ゲル上で培養した場合では、特徴的な長い突起を形成し、粘弾性ゲルに導電性物質が多く含まれている場合には、より多くの突起が形成されていることが判明した。神経細胞の軸索を絶縁するミエリン鞘を形成するオリゴデンドロサイトも、足場材中に存在した。粘弾性ゲルでは、弾性ゲルよりもミエリンの総量が多く、ミエリン層が長くなっており、ゲル中の導電性物質が多いほどミエリンの厚さが増していた。
最後に研究チームは、ハイドロゲル足場内の導電性物質を介して生きたヒト細胞に電気刺激を与え、それが細胞増殖にどのような影響を与えるかを調べた。細胞は、毎日または1日おきに、1回15分間電気刺激を受けた。8日後、毎日パルスを当てた足場には生きている細胞がほとんどなかったが、1日おきにパルスを当てた足場には、足場全体に生きている細胞があふれていた。
この刺激期間の後、細胞は足場内に合計51日間放置された。毎日刺激を与えた足場には、他の種類の細胞に分化しない細胞がわずかに残っていたが、1日おきに刺激を与えた足場には、神経細胞とアストロサイトが高度に分化し、長い突起を持つようになった。また、電気刺激の違いは、ゲル内のミエリンの量に影響しないようであった。
<関連情報>
- https://seas.harvard.edu/news/2023/01/soft-stimulating-scaffold-supports-brain-cell-development-ex-vivo
- https://onlinelibrary.wiley.com/doi/10.1002/adhm.202202221
神経細胞分化のためのチューナブルな導電性ハイドロゲル足場 Tunable Conductive Hydrogel Scaffolds for Neural Cell Differentiation
Christina M. Tringides, Marjolaine Boulingre, Andrew Khalil, Tenzin Lungjangwa, Rudolf Jaenisch, David J. Mooney
Advanced Healthcare Materials Published: 10 December 2022
DOI:https://doi.org/10.1002/adhm.202202221
Abstract
Multielectrode arrays would benefit from intimate engagement with neural cells, but typical arrays do not present a physical environment that mimics that of neural tissues. It is hypothesized that a porous, conductive hydrogel scaffold with appropriate mechanical and conductive properties could support neural cells in 3D, while tunable electrical and mechanical properties could modulate the growth and differentiation of the cellular networks. By incorporating carbon nanomaterials into an alginate hydrogel matrix, and then freeze-drying the formulations, scaffolds which mimic neural tissue properties are formed. Neural progenitor cells (NPCs) incorporated in the scaffolds form neurite networks which span the material in 3D and differentiate into astrocytes and myelinating oligodendrocytes. Viscoelastic and more conductive scaffolds produce more dense neurite networks, with an increased percentage of astrocytes and higher myelination. Application of exogenous electrical stimulation to the scaffolds increases the percentage of astrocytes and the supporting cells localize differently with the surrounding neurons. The tunable biomaterial scaffolds can support neural cocultures for over 12 weeks, and enable a physiologically mimicking in vitro platform to study the formation of neuronal networks. As these materials have sufficient electrical properties to be used as electrodes in implantable arrays, they may allow for the creation of biohybrid neural interfaces and living electrodes.