2023-07-06 国立長寿医療研究センター,筑波大学
研究成果のポイント
- ヒトやマウスの痛覚制御に重要な「下行性痛覚抑制」をショウジョウバエに発見した。
- ハエの下行性痛覚抑制に哺乳類と共通の分子経路が関わることも明らかにした。
- 哺乳類以外の動物種に下行性痛覚抑制の存在を示した世界初の報告。
- 今後、非哺乳動物を利用した新たな鎮痛創薬研究や痛覚の進化の解明へとつながる成果。
概要
国立研究開発法人国立長寿医療研究センター(理事長:荒井秀典。以下、国立長寿医療研究センター)ジェロサイエンス研究センターの本庄賢研究員(研究当時:筑波大学生命環境系特任助教または国立長寿医療研究センター認知症先進医療開発センター研究員)、筑波大学生命環境系の古久保-徳永克男教授(研究当時)、東京理科大学先進工学部生命システム工学科の近藤周准教授、東北大学生命科学研究科の谷本拓教授らの共同研究グループは、哺乳類で痛覚制御に重要な「下行性痛覚抑制」呼ばれる制御メカニズムが、キイロショウジョウバエにも存在することを明らかにしました。
脳からのシグナルにより脊髄で痛覚を調節する下行性痛覚抑制の存在は、ヒトやマウスでは知られており、慢性疼痛の原因究明や鎮痛治療法開発の観点からも注目されてきました。一方、昆虫や魚など哺乳類以外の動物においては、このような痛覚制御システムは、これまで見つかっていませんでした。
本研究ではショウジョウバエの幼虫を用いて、幼虫の脳で発現している神経ぺプチドDSK[1]が、腹髄(脊椎動物の脊髄に相当)の痛覚神経細胞へと作用して痛覚応答を抑制する下行性痛覚抑制機構として働くことを明らかにしました。DSKの哺乳類ホモログ[2]であるCCK[3]もまた、哺乳類で脳からの下行性痛覚抑制に機能していることがわかっており、昆虫と哺乳類の下行性痛覚抑制に分子レベルでの共通性が見られることも示されました。本研究は非哺乳動物種に脳からの下行性痛覚抑制の存在を発見した初めての研究報告であり、ショウジョウバエなど非哺乳動物の利点を活用した痛覚メカニズムの研究や鎮痛創薬研究への発展、さらには痛覚の進化の解明へとつながっていくことが期待されます。
本研究論文の最終版は、2023年6月13日に「eLife」にて公開されました。
*本研究は国立長寿医療研究センター長寿医療研究開発費、科研費(日本学術振興会科学研究費助成事業)、上原記念生命科学財団、持田記念医学薬学振興財団の研究助成を受けて行われました。
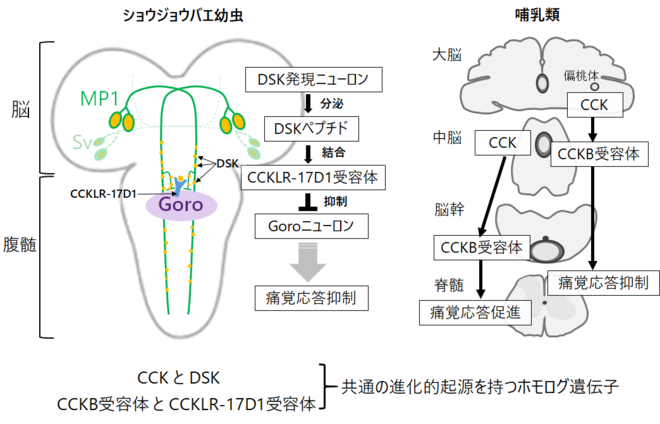
図1. 本研究で明らかになったショウジョウバエ幼虫の下行性痛覚抑制経路および哺乳類との比較。
(左側)幼虫のDSKシグナルによる脳から腹髄への下行性痛覚抑制経路。幼虫のDSKは脳に局在するMP1とSvニューロンで発現している。MP1ニューロンは下行性軸索を伸ばしており、腹髄で痛覚応答を促進する介在ニューロンであるGoroニューロンと連絡している。DSK受容体の一つCCKLR-17D1はGoroニューロンで発現し、Goroニューロンの活動抑制を通じて幼虫の痛覚応答の抑制に機能する。
(右側)哺乳類のCCKシグナルによる脳から脊髄への下行性痛覚制御経路。哺乳類では、CCKによるCCKB受容体を介したシグナル伝達が、偏桃体-中脳-脊髄経路を通じて痛覚応答抑制に働くことがわかっている。一方、中脳で発現するCCKが、脳幹-脊髄へのシグナル伝達を介して痛覚応答を促進する別の下行性制御経路の存在も知られている。
研究の背景
数か月に渡って持続する慢性的な痛みに苦しむ人は、世界人口の20%以上に上ると推定されています。特に高齢者では慢性疼痛を抱える人の割合が増加し、痛みが日常生活に及ぼす影響も大きくなることが知られており、より良い鎮痛治療法の開発は、高齢化の進む我が国で健康寿命を延伸し、明るい長寿社会を実現していくために重要な課題と言えます。
ヒトやマウスなど哺乳動物の研究から、哺乳類には脳からのシグナルにより脊髄で痛覚を抑制する下行性痛覚抑制系の存在が示されてきました。先行研究により、この下行性痛覚抑制系を刺激すると麻酔と似たレベルの鎮痛効果が得られること、逆にその機能阻害では痛覚過敏が引き起こされること、そして慢性疼痛の患者さんで下行性痛覚抑制系の機能異常がみられることが繰り返し示唆されてきており、この下行性痛覚抑制系は我々ヒトの痛みの調節に重要な生体内のメカニズムとして、慢性疼痛疾患の発症原因究明と新規の治療法開発の観点から注目を集めてきました。
一方、昆虫や魚など哺乳類以外の動物においては、末梢で侵害性の刺激を感知する一次痛覚神経レベルでは哺乳類との高い共通性が確認されてきたものの、中枢神経系の痛覚制御システムレベルでの共通性はこれまでほとんど見つかっていませんでした。脳からの下行性痛覚抑制経路についても哺乳類以外の動物ではこれまで一切報告が無く、哺乳類以外でその研究を行うことも不可能でした。
研究の内容と成果
我々はショウジョウバエの幼虫を用いて痛覚制御機能を持つ神経ぺプチドの研究を進める中で、CCK(コレシストキニン)ファミリーの神経ぺプチドであるDSK(Drosulfakinin, ドロサルファキニン)の変異体が、熱痛覚過敏の表現型を示すことを見出しました。さらにDSK受容体の変異体も同様の熱痛覚過敏を示すことがわかり、DSKシグナルが幼虫の痛覚抑制に関わることが強く示唆されました。神経細胞特異的な遺伝子発現制御、神経機能操作を容易に実施できるショウジョウバエの優れた遺伝学実験ツールを用いてDSKによる痛覚抑制の生体内メカニズムを詳細に解析したところ、幼虫の脳のMP1、Svという2種類の神経細胞のみで発現するDSKが、CCKLR-17D1受容体を介し、痛覚応答促進性の介在ニューロンの活動を腹髄で抑制することで幼虫の痛覚応答を抑制する、下行性の痛覚抑制経路の存在が示唆されました(図1)。そこで、実際に脳のDSK発現ニューロンを人為的に刺激する実験を行ったところ、腹髄の痛覚介在ニューロンの活動と幼虫の痛覚応答が実際に抑制されることがわかり(図2)、DSKシグナルが実際に下行性痛覚抑制経路として働いているということを直接的に確かめることができました。
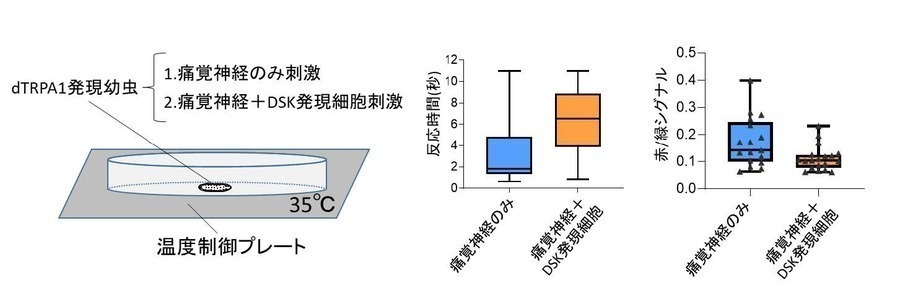
図2.dTRPA1によるDSK発現細胞の人為発火実験。
(左)dTRPA1を用いた幼虫の神経発火実験の模式図。dTRPA1は29℃以上の温度で開く温度感受性チャネルであり、温度による神経刺激を可能にするツールである。本研究ではdTRPAを痛覚神経のみ、または痛覚神経に加えてDSK発現細胞に発現させた幼虫を35℃の温度プレート上に乗せ、人為発火実験を行った。
(中)先行研究で既に知られる通り、dTRPA1を用いて痛覚神経を発火させると幼虫の痛覚応答が誘導された。そこで痛覚神経に加えてDSK発現細胞も同時に発火させると、痛覚応答が見られるまでの時間が有意に遅延し、DSK発現細胞の活動で痛覚応答が抑制されることがわかった(*** p < 0.001, Mann-Whitney U-test)。
(右)神経興奮により発する蛍光波長が緑から赤に変化するCaMPARIを用いてGoroニューロンの神経活動レベルを調べたところ、痛覚神経のみを発火させた場合に比べてDSK発現細胞を同時に発火させた場合には、Goroニューロンの活動上昇が抑制されることがわかった(*p < 0.05, Mann-Whitney U-test)。
これまでに哺乳類以外の生物で脳からの下行性痛覚抑制系を持つことが示された例はなく、今回の成果は、非哺乳動物に下行性痛覚抑制系の存在を世界で初めて見出した報告となります。また、CCKはヒトとげっ歯類で下行性痛覚制御(促進と抑制両方)に関わることが知られており、今回の我々の研究結果からは、ショウジョウバエと哺乳類の下行性痛覚抑制に、CCKという進化的に共通の神経ぺプチドが関わることも明らかになりました。
昆虫の中枢神経系に哺乳類と共通の分子による下行性痛覚抑制系を見出した今回の我々の発見は、ヒトと昆虫の痛覚系の共通性についての我々の理解を大きく進展させ、下行性痛覚抑制系が先カンブリア時代に生息していたとされる哺乳類と昆虫の共通祖先に既に見られたかもしれないという痛覚の進化に関する新たな仮説を示すものです。
今後の展開
今回の研究では、ショウジョウバエ幼虫の中枢神経系において、DSKシグナルが下行性痛覚抑制系として機能することを示すことができました。しかし、このDSKによる下行性痛覚抑制系がどのようなシチュエーションで活性化し痛覚制御を行うのか等、その詳細な動作メカニズムとその動作に関わる分子機構についてはまだ十分に明らかにできておらず、今後の課題と言えます。また今回の研究では、DSKシグナル系がCCKLR-17D1受容体以外の受容体を介し、今回見出した腹髄の痛覚介在ニューロンに作用する下行性経路以外のメカニズムでも並行して幼虫の痛覚制御を行う可能性が示唆されており、DSKシグナル系による痛覚制御メカニズムの全容解明に向けては、今後さらに詳しい解析が必要です。
下行性痛覚抑制系の機能異常は、慢性疼痛疾患の発症過程に関与するものと考えられています。今後ショウジョウバエの強力な遺伝学を生かした新しいアプローチによる研究で、その動作メカニズムに異常が生じる要因や過程が詳細に明らかになれば、その知見を応用した慢性疼痛の治療薬や、発症予防法の開発が可能になるかもしれません。
また、本研究からは昆虫と哺乳類の痛覚系の間に、これまで知られていた以上の共通性が認められることがわかりました。今後動物種間での痛覚系の共通点と相違点がさらに明らかとなり、痛覚の進化過程の理解が進んだ暁には、「昆虫がヒトのように痛みを感じ得るか?」という長年の疑問への科学的な回答も可能になっていくことが期待できます。
用語解説
- DSK
Drosulfakinin(ドロサルファキニン)の略称。神経細胞で合成、分泌されるアミノ酸短鎖である神経ぺプチドの一種。神経ぺプチドはメッセンジャー分子として機能し、神経細胞間のシナプスを介したシグナル伝達で機能する他、ホルモンとして分泌細胞から離れた場所の神経細胞や非神経組織へのシグナル伝達を担うこともある。 - ホモログ
同じ共通祖先から派生したと考えられる、塩基配列の類似した遺伝子。 - CCK
Cholecystokinin(コレシストキニン)の略称。動物種間で進化的に最もよく保存されている神経ぺプチドの一つとして知られる。
掲載論文
題名
A descending inhibitory mechanism of nociception mediated by an evolutionarily conserved neuropeptide system in Drosophila
著者名
Izumi Oikawa, Shu Kondo, Kao Hashimoto, Akiho Yoshida, Megumi Hamajima, Hiromu Tanimoto, Katsuo Furukubo-Tokunaga, Ken Honjo
掲載誌
eLife
https://doi.org/10.7554/eLife.85760
リリースの内容に関するお問い合わせ
この研究に関すること
国立長寿医療研究センター ジェロサイエンス研究センター 運動器疾患研究部 本庄賢
報道に関すること
国立長寿医療研究センター 総務部総務課 広報担当