2023-07-18 東京大学
発表のポイント
- 家族性組織球症の一つであるSLC29A3異常症は、増殖したマクロファージが多臓器に蓄積する原因不明の疾患です。本研究では、病原体センサーであるToll-like receptor 7(TLR7)、TLR8の活性化によりSLC29A3異常症におけるマクロファージの増殖が誘導されていることを明らかにしました。
- 組織球症においてマクロファージの増殖が起こるメカニズムとして、マクロファージに発現する病原体センサーがヌクレオシドに過剰応答することが一因であることを明らかにしました。
- SLC29A3異常症の治療標的としてTLR7やTLR8が同定されたことにより、新規治療薬の開発が期待されます。
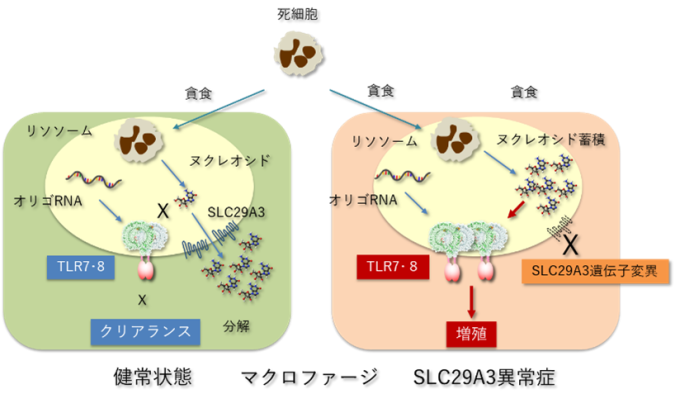
ヌクレオシドによるTLR7・TLR8活性化がSLC29A3異常症を誘導
発表概要
東京大学医科学研究所感染遺伝学分野の三宅健介教授、柴田琢磨准教授、東京大学大学院薬学系研究科の清水敏之教授、東京都立大学大学院理学研究科の田岡万悟准教授らのグループは、ヒトの家族性組織球症(注1)の一つであるSLC29A3異常症の原因が、一本鎖RNAを認識する病原体センサー(注2)であるTLR7とTLR8(注3)の異常活性化により引き起こされることを、世界で初めて明らかにしました。
SLC29A3はリソソーム(注4)に局在するヌクレオシドトランスポーター(注5)ですが、SLC29A3遺伝子における機能欠損型変異ではSLC29A3異常症が引き起こされます。SLC29A3異常症は、核酸の代謝産物であるヌクレオシド(注6)がマクロファージ(注7)のリソソームに蓄積し、結果としてマクロファージが多臓器に蓄積する疾患です。しかし、リソソームに蓄積したヌクレオシドがマクロファージの増殖を誘導するメカニズムは解っておらず、治療法創出のためにも原因解明が望まれていました。
本研究グループは、マクロファージのリソソームに蓄積したヌクレオシドによりTLR7およびTLR8という病原体センサーが活性化されることを見出し、その結果としてSLC29A3異常症が引き起こされていることを明らかにしました。SLC29A3異常症の原因が解明されたことにより、TLR7やTLR8を標的とした新規治療法の開発が期待されます。また、今回の研究においてマクロファージの増殖制御における病原体センサーの重要性が新たに示されたことにより、未だ原因不明である他の組織球症においても病原体センサーに着目した原因解明が進展する可能性があります。本研究成果は7月18日、米国医学雑誌「Journal of Experimental Medicine」に掲載されました。
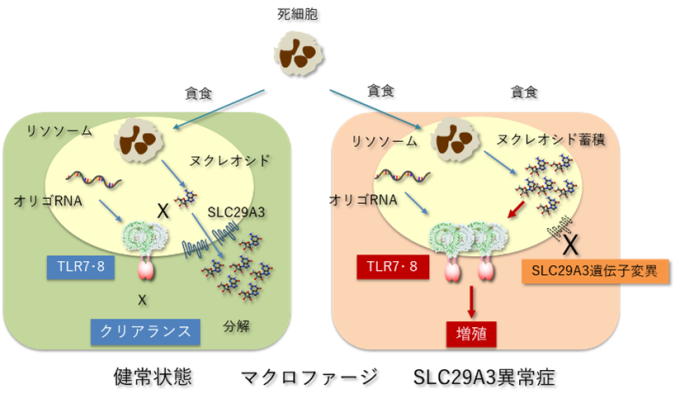
ヌクレオシドによるTLR7・TLR8活性化がSLC29A3異常症を誘導
マクロファージが貪食した死細胞はリソソームで分解され、死細胞に由来するDNAやRNAといった核酸はヌクレオシドにまで分解されます。TLR7やTLR8はリソソームに局在するRNAセンサーとして知られ、RNAの分解産物である短いRNA(オリゴヌクレオチド)とヌクレオシドの両者によって活性化されます。健常状態では、リソソーム内のヌクレオシドはSLC29A3により細胞質に輸送されるため、TLR7やTLR8は活性化されません。一方、SLC29A3の機能が欠失したSLC29A3異常症ではリソソーム内にヌクレオシドが蓄積してしまい、オリゴリボヌクレオチドとともに作用することでTLR7とTLR8は活性化されてしまいます。過剰に活性化されたTLR7とTLR8がマクロファージの増殖を誘導することでマクロファージの蓄積を主徴とするSLC29A3異常症は誘導されてしまいます。
発表内容
〈研究の背景〉
ヌクレオシドトランスポーターであるSLC29A3は主にマクロファージに発現し、リソソームに局在しています。死細胞の貪食などによりマクロファージのリソソームに取り込まれたDNAやRNAは、リソソーム内の分解酵素によりヌクレオシドにまで分解されます。その後、リソソーム内ヌクレオシドはSLC29A3を介して細胞質側に輸送され、不用なヌクレオシドはさらに分解されて細胞外へと排出されます。このSLC29A3の遺伝子に機能欠損型変異が生じることで、家族性組織球症の一つであるSLC29A3異常症が起こります。SLC29A3異常症は、マクロファージが多臓器に蓄積する組織球症を特徴とした疾患です。SLC29A3異常症のモデルとして報告されているSLC29A3欠損マウスでも、ヒトと同様にマクロファージが全身に蓄積しています。このSLC29A3欠損マウスにおいて、マクロファージのリソソーム内にヌクレオシドが蓄積してしまうことは分かっていましたが、蓄積したヌクレオシドがマクロファージの増加をどの様に誘導するのかは解明されていませんでした。
本研究グループでは、自然免疫応答(注8)を司るToll様受容体F(Toll-like receptor, TLR)についての解析を一貫して進めてきました。TLRファミリーのメンバーは、主にマクロファージや樹状細胞に発現し、病原体由来の脂質、タンパク質、核酸に応答することで感染防御反応を誘導します。核酸を認識するTLRは細胞表面ではなくリソソームに局在しており、核酸認識TLRの中でもTLR7とTLR8は1本鎖RNAのセンサーとして機能します。本研究グループはこれまでに構造生物学的および分子細胞生物学的な解析を介して、TLR7とTLR8が1本鎖RNAそのものではなく、その分解産物であるヌクレオシドとオリゴRNAに結合することで活性化されることを明らかにしてきました。
〈研究の内容〉
TLR7とTLR8がヌクレオシドに応答するという研究結果を受け、本研究グループはSLC29A3異常症の解析に着手しました。すなわち、SLC29A3異常症ではマクロファージに発現するTLR7やTLR8がリソソームに蓄積したヌクレオシドに応答してしまい、その結果としてマクロファージの増殖が誘導されてしまう可能性があると考えたのです。
マウスではヒトと異なり、TLR7とTLR8のうちTLR7のみが一本鎖RNAのセンサーとして機能しています。そこでSLC29A3欠損マウスとTLR7欠損マウスの交配により2重遺伝子欠損マウスを作成したところ、マクロファージの増加・蓄積によって引き起こされる脾臓の腫大は完全に消失しました。また脾臓におけるマクロファージを調べたところ、SLC29A3欠損マウスにおいて認められたマクロファージの増殖亢進(こうしん)もTLR7の欠損により完全に消失していました。これらの結果は、SLC29A3欠損マウスにおける組織球症の誘導がTLR7の活性化により引き起こされることを明確に示しています。
次にヒトSLC29A3異常症の患者検体を解析したところ、末梢血単球から誘導したマクロファージでは健常人由来マクロファージに比べて生存・増殖が亢進していることが分かりました。マウスとは異なり、ヒトの単球・マクロファージではTLR7よりもTLR8の発現および機能が強いことから、本研究グループはヒトTLR8がマクロファージの増殖誘導を起こす可能性を検討しました。その結果、SLC29A3異常症において亢進したマクロファージの生存・増殖はTLR8拮抗剤により強く抑制されました。ヒトTLR8がSLC29A3異常症の原因となり得ることを示すため、本研究グループは、マウスモデルを用いてさらにヒトTLR8の機能解析を行いました。SLC29A3とTLR7の2重遺伝子欠損マウスのマクロファージにヒトTLR8を発現させたマウスを作製したところ、マクロファージの増加および脾臓の腫大が明らかに認められました。すなわち、マウスTLR7と同様に、ヒトTLR8もマウス生体内において組織球症を誘導し得ることが示されたと言えます。これらの結果から、ヒトにおける組織球症の病態の誘導にはヒトTLR8が関与する可能性が高いと考えられます。
〈今後の展望〉
組織球症では、マクロファージがなぜ増加するのかに関してこれまでも解析が進められてきています。炎症の結果として増殖が起こる可能性も考えられていましたが、がん細胞で認められるような増殖を亢進する遺伝子変異が組織球症で蓄積したマクロファージでも検出されており、それらの遺伝子変異がマクロファージの異常な増殖や蓄積を起こすという考えが現在の主流です。今回、研究グループは、組織球症の中でも家族性組織球症という稀なタイプにおいて、マクロファージの増殖がヌクレオシドに対する病原体センサーTLR7、TLR8の応答によって誘導されることを世界で初めて示しました。今回の結果は、TLR7やTLR8を標的とした全く新しい組織球性疾患治療法の可能性を示したことになります。また、この結果は、希少なタイプの組織球性疾患の病態を解明しただけでなく、マクロファージの増加や蓄積を引き起こす新たなメカニズムを提唱するものでもあり、SLC29A3異常症以外の組織球症の病態解明にも貢献し得る結果であると考えられます。
発表者
東京大学
医科学研究所
三宅 健介(教授)(感染遺伝学分野)
柴田 琢磨(准教授)(感染遺伝学分野)
大学院薬学系研究科
清水 敏之(教授)(蛋白構造生物学教室)
東京都立大学大学院理学研究科
田岡 万悟(准教授)(化学専攻)
論文情報
〈雑誌〉 Journal of Experimental Medicine
〈題名〉 TLR7/8 stress response drives histiocytosis in SLC29A3 disorders
〈著者〉 Takuma Shibata, Ryota Sato, Masato Taoka, Shin-Ichiroh Saitoh, Mayumi Komine, Kiyoshi Yamaguchi, Susumu Goyama, Yuji Motoi, Jiro Kitaura, Kumi Izawa, Yoshio Yamauchi, Yumiko Tsukamoto, Takeshi Ichinohe, Etsuko Fujita, Ryosuke Hiranuma, Ryutaro Fukui, Yoichi Furukawa, Toshio Kitamura, Toshiyuki Takai, Arinobu Tojo, Mamitaro Ohtsuki, Umeharu Ohto, Toshiyuki Shimizu, Manabu Ozawa, Nobuaki Yoshida, Toshiaki Isobe, Eicke Latz, Kojiro Muka, Tomohiko Taguchi, Hiroaki Hemmi, Shizuo Akira, Kensuke Miyake*
*責任著者
〈DOI〉 10.1084/jem.20230054
〈URL〉 https://doi.org/10.1084/jem.20230054
研究助成
本研究は、「JSPS科研費(16H06388, 21H04800, 22H05184, 22K19424, JP22H05182, 16H02494, 21K15464, 26293083, 19H03451, 16K08827, JP16H06276_AdAMS)」、「JST CREST (JPMJCR13M5, JPMJCR21E4)」、「日本医療研究開発機構(AMED)(JP20ek0109385, JP223fa627001, JP233fa627001)」、「持田記念医学薬学振興財団」の支援により実施されました。
用語解説
(注1)家族性組織球症:
組織球症とは、免疫細胞の一種である組織球(単球やマクロファージ)が増殖し、体内の組織に異常に蓄積してしまう病的な状態を指します。家族性組織球症は、家系内で変異した遺伝子が遺伝した結果としてこの組織球症が起こる希少疾患であり、SLC29A3異常症はその一例です。SLC29A3異常症では蓄積した組織球により、脾臓や肝臓の腫大、皮膚への色素沈着、難聴、I型糖尿病、および膵外分泌機能不全といった様々な症状が現れます。
(注2)病原体センサー:
マクロファージや樹状細胞といった免疫細胞に高発現するレセプターのことです。病原体センサーは細菌、ウイルス、真菌など病原体に由来する分子パターンを認識して活性化し、細胞内にシグナルを伝達する役割を持っています。その結果として、炎症サイトカインやインターフェロンの産生、および獲得免疫応答が誘導されます。
(注3)TLR7、TLR8:
Toll Like Receptor(TLR)は病原体の構成成分を特異的に認識する病原体センサーです。その中でもTLR7とTLR8はウイルスに由来する一本鎖RNAを認識するセンサーとして知られ、サイトカインやインターフェロン産生を誘導することで生体防御に寄与します。
(注4)リソソーム:
細胞を構成する細胞内小器官の一つ。膜に包まれた小器官であり、内部に様々な消化酵素を含みます。エンドサイトーシスやファゴサイトーシスにより細胞外から取り込まれた物質や、オートファジーにより集められた細胞内の物質を分解する役割担っています。
(注5)ヌクレオシドトランスポーター:
ヌクレオシドは細胞膜を通過できません。細胞膜に埋まって存在する複数回膜貫通型のヌクレオシドトランスポーターはこのヌクレオシドを輸送する機能を持っており、同分子の存在により細胞膜で仕切られた細胞内空間をヌクレオシドは行き来することができます。
(注6)ヌクレオシド:
塩基が糖に結合した分子であり、RNAやDNAの構成因子です。RNAの場合、糖はリボースで構成され、塩基の違いによりアデノシン、グアノシン、シチジン、ウリジンに分類されます。DNAの場合、糖はデオキシリボースで構成され、塩基の違いによりデオキシアデノシン、デオキシグアノシン、デオキシシチジン、チミジンの四つに分類されます。
(注7)マクロファージ:
様々な異物を貪食する機能を持つ免疫細胞の一種。侵入病原体や死細胞の排除を担っています。また貪食物の有する特徴を病原体センサーにより感知し、状況に応じた適切な炎症応答や獲得免疫応答を誘導することも大切な役割です。
(注8)自然免疫応答:
先天的に備える生体防御システムであり、病原体や異物の侵入に対して即座に起こる炎症などの免疫応答を誘導することで非自己の排除を行います。この自然免疫応答の誘導は主に免疫細胞が発現する病原体センサーの活性化によって引き起こされます。
問合せ先
〈研究に関する問合せ〉
東京大学医科学研究所
教授 三宅 健介(みやけ けんすけ)
東京大学医科学研究所
准教授 柴田 琢磨(しばた たくま)
〈報道に関する問合せ〉
東京大学医科学研究所 プロジェクトコーディネーター室(広報)
東京都立大学管理部 企画広報課
科学技術振興機構 広報課
〈JST事業に関する問合せ〉
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
保田 睦子(やすだ むつこ)