2023-09-20 京都大学iPS細胞研究所
ポイント
- テトラサイクリン応答型制御システム (Tet-Onシステム) 注1)を応用した従来のMyoD遺伝子強制発現法注2)では、細胞ごとの遺伝子発現が均一ではなく、ヒトiPS細胞から筋細胞への分化誘導効率が低い。
- ヒトiPS細胞にTet-Onシステムを適用したときの遺伝子発現の不均一性は、rtTA遺伝子注3)発現の低下に起因することを示した。
- rtTA遺伝子をピューロマイシン耐性遺伝子(PuroR)注4)と連結することで発現が向上し、筋細胞への高効率な分化誘導を実現する。
1. 要旨
大友淳氏(当時:CiRA臨床応用研究部門 大学院生)、クヌート・ウォルツェン准教授(CiRA未来生命科学開拓部門)、櫻井英俊准教授(CiRA臨床応用研究部門)らの研究グループは、iPS細胞における高効率な外来性遺伝子発現システムを改善することにより、ヒトiPS細胞からの簡便かつ高効率な筋細胞分化誘導に成功しました。今回活用した遺伝子発現システムは筋細胞分化にとどまらず、転写因子の強制発現を主軸としたさまざまな細胞の分化誘導法に応用できることが期待されます。
この研究成果は2023年8月19日に科学誌「iScience」にオンライン公開されました。
2. 研究の背景
テトラサイクリン応答型制御システム(Tet-Onシステム)は、哺乳細胞に制御性の外来性遺伝子発現を可能とし、幅広い研究分野で活用されている遺伝子工学ツールです。
特にヒトiPS細胞においては、マスター転写因子の強制発現を主軸とした細胞分化に応用されており、過去に本研究グループはTet-OnシステムをMyoD遺伝子強制発現に活用することで、任意のタイミングで、ヒトiPS細胞から筋細胞分化誘導が可能な手法を報告しました(CiRAニュース 2013年4月24日)。
しかしながら、上記の研究ではMyoD遺伝子を発現する細胞と発現しない細胞が含まれていたことから、MyoD遺伝子発現が高い細胞を単離する工程に加え、単離してきた複数の細胞を維持する必要がありました。
そこで、本研究グループはTet-Onシステムにおける遺伝子発現の不均一性の原因を明らかにし、克服することで、従来の手法よりも簡便な筋細胞分化誘導法の開発を目指して研究を行いました。
3. 研究結果
1)従来のTet-MyoD ヒトiPS(hiPS)細胞における筋細胞分化誘導の評価
本研究グループは、これまでにTet-Onシステムによって、筋細胞分化におけるマスター転写因子のMyoD遺伝子発現を制御可能なTet-MyoDベクターを開発しました(CiRAニュース 2013年4月24日)。Tet-MyoDベクターは薬剤耐性遺伝子のネオマイシン耐性遺伝子(NeoR)注5)と低分子化合物のドキシサイクリン(Dox)に応答し、MyoD遺伝子と可視化のためのレポーター遺伝子(mCherry)を発現するように設計しました(図1A)。このベクターをヒトiPS細胞に導入後、抗生物質のG418注6)を投与することで耐性のあるTet-MyoD hiPS細胞を選択し、筋細胞分化効率の評価を行いました。その結果、Tet-MyoDベクターが組み込まれた細胞のみを選択したにもかかわらず、Doxに応答して目的遺伝子を発現する細胞と発現しない細胞の両方が混在し、筋細胞への分化効率の低下につながることがわかりました(図1B、C)。
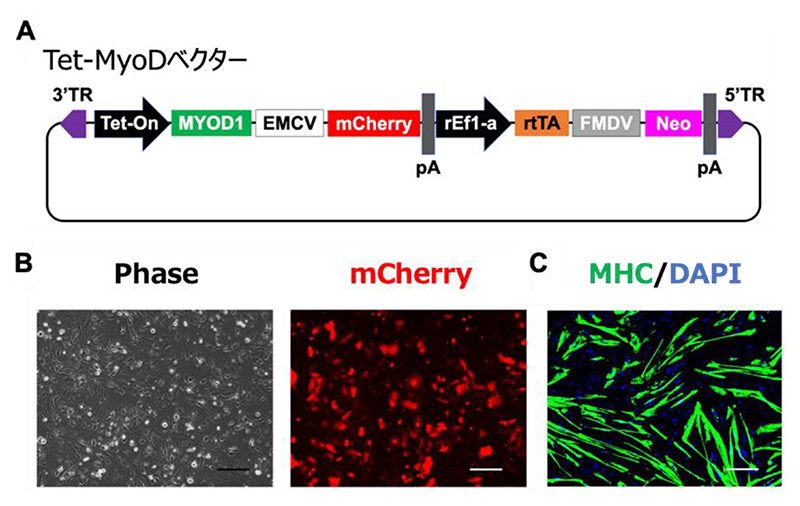 図1 Tet-MyoD hiPS細胞における遺伝子発現の不均一性
図1 Tet-MyoD hiPS細胞における遺伝子発現の不均一性
A:Tet-MyoDベクターの模式図。このベクターをヒトiPS細胞に導入し、G418選択することで、Tet-MyoD hiPS細胞を作製した。
B:Dox投与24時間後のTet-MyoD hiPS細胞。赤色はレポーター遺伝子mCherryの発現を示す。
C:免疫染色法で確認した、筋細胞分化誘導7日目のTet-MyoD hiPS細胞。
MHC (緑色)は筋細胞を示す。
2)Dox非応答性の細胞集団におけるrtTA遺伝子発現の低下
次に、Doxに応答せず目的遺伝子を発現しない原因を調べました。Tet-MyoD hiPS細胞にDoxを投与した24時間後、Dox応答性と非応答性の細胞をセルソーター注7)で分離しました(図2A)。分離したそれぞれの細胞集団の遺伝子発現について、定量的リアルタイムPCR法により解析したところ、Dox応答性の細胞集団と比べ、Dox非応答性の細胞集団ではrtTA遺伝子発現が低下していることがわかりました(図2B)。rtTA遺伝子はTet-Onシステムの機能の一部であり、Doxに応答することで目的遺伝子を発現させる役割を担います。このことから、Dox非応答性の細胞集団の出現はrtTA遺伝子発現の低下に起因していることが示唆されました。
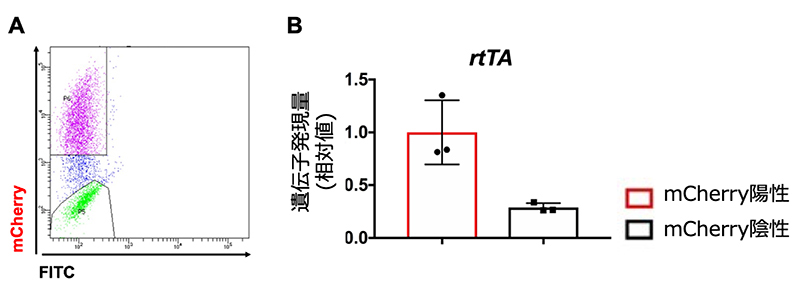 図2 Dox応答性の細胞集団におけるrtTA遺伝子発現の低下確認
図2 Dox応答性の細胞集団におけるrtTA遺伝子発現の低下確認
A:Dox投与24時間後、セルソーターを用いてmCherry発現を解析した。縦軸はmCherry発現の強度を示す。解析結果をもとに、mCherry陽性と陰性の細胞集団を分離した。
B:セルソーターで分離したmCherry陽性および陰性の細胞集団におけるrtTA遺伝子の発現量を、定量的リアルタイムPCR法を用いて解析した。
3)rtTA遺伝子発現ベクターの追加導入によるDox応答性細胞の増加
rtTA遺伝子の発現低下がDox非応答性の細胞が存在する直接的な原因かどうかを明らかにするために、Tet-MyoD hiPS細胞にrtTA遺伝子を発現するベクターを追加しました。その結果、rtTA 遺伝子発現ベクターが追加されたTet-MyoD hiPS細胞ではDox応答性の細胞の割合が増加し(図3A)、筋細胞分化の改善も確認されました(図3B)。以上から、Dox非応答性の細胞はrtTA遺伝子発現の低下に起因することが判明しました。また、Tet-MyoD hiPS細胞にrtTA遺伝子発現ベクターを追加導入することで、Dox応答性の細胞を増やし、筋細胞への分化誘導の効率を向上させる手法の開発に成功しました。
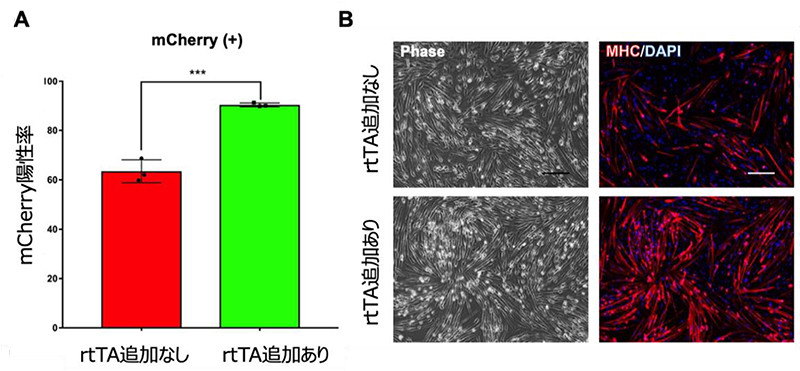 図3 rtTA遺伝子発現ベクターの追加による遺伝子発現の不均一性と筋分化への誘導効率の改善
図3 rtTA遺伝子発現ベクターの追加による遺伝子発現の不均一性と筋分化への誘導効率の改善
A:FACS解析結果による、rtTA遺伝子発現ベクターを追加導入した細胞とのmCherry陽性率の比較。赤はrtTA追加なし、緑はrtTA追加あり、を示す。
B:免疫染色法によって確認した、筋細胞分化誘導7日目の細胞。MHC(赤色)は筋細胞を示す。上段はrtTA追加なし、下段はrtTA追加あり、を示す。
4)Tet-MyoDベクターにおけるPuroRの有用性の検証
最後に、研究グループはTet-MyoDベクターの構成に着目しました。Tet-MyoDベクターはMyoD遺伝子と同期してmCherry遺伝子を発現し、rtTA遺伝子にNeoRをつないだ融合遺伝子を発現します。しかし、このような同期した複数遺伝子の発現は、目的遺伝子を単体で発現させたときに比べ、その機能が低下することが知られています。また、NeoRと比較して、もう一つの薬剤耐性遺伝子であるピューロマイシン耐性遺伝子(PuroR)を採用したベクターのほうが、目的遺伝子をより高く発現することも報告されていました。
そこで、従来のTet-MyoDベクターを基盤に3つの変更を加えた、異なる4つの構成(①:もともと開発した構成でNeoRとmCherryを採用 ②:mCherryを除いてNeoRのみを採用 ③:NeoRをPuroRに変更してmCherryを採用 ④:PuroRのみを採用)のベクターを作製し、機能が変化するかどうかを検証しました (図4A)。その結果、PuroRを導入したヒトiPS細胞において、rtTA遺伝子発現と筋細胞分化誘導効率の顕著な改善がみられました(図4B、C、①と③の比較および②と④の比較)。また、分化誘導効率のよいPuroRを採用したベクター2種においてmCherryによる影響を比較すると、mCherryを除いてMyoD遺伝子を単体で発現させた構成において、わずかに筋細胞への分化誘導効率の改善傾向がみられました(図4C、③と④の比較)。
以上より、Tet-MyoDベクターにおいて、rtTA遺伝子と連結する薬剤耐性遺伝子をNeoRからPuroRに変更し、MyoD遺伝子を単体で発現させることにより、rtTA遺伝子発現ベクターを追加導入することなく、目的遺伝子の発現を大幅に改善できることがわかりました。この改善により、従来の手法では必要不可欠だった目的遺伝子を発現するhiPS細胞を単離してくる工程を省略することができるようになり、より簡便的かつ高効率に筋細胞への分化誘導を行う手法の開発に成功しました。
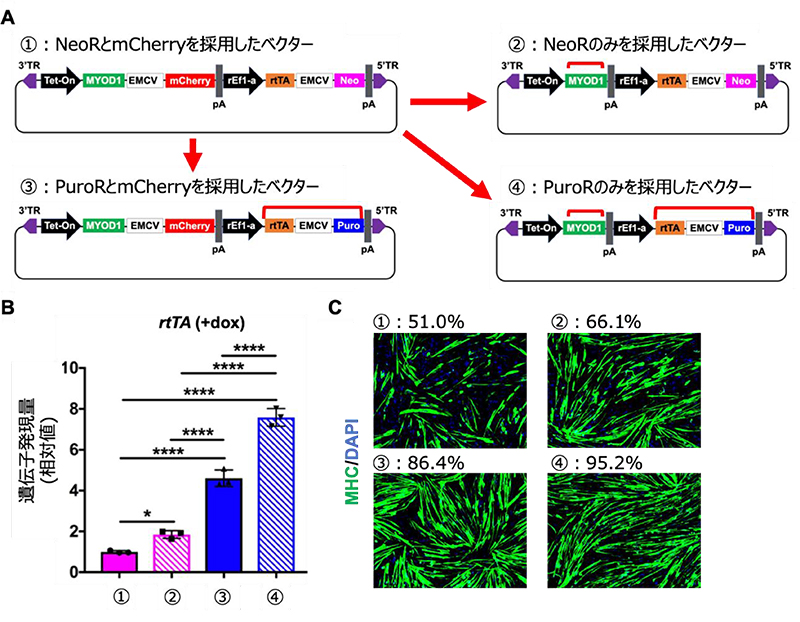 図4 Tet-MyoDベクターの構成による機能の比較
図4 Tet-MyoDベクターの構成による機能の比較
A:①を基盤として新たな構成の3種のTet-MyoDベクターを作製した。赤線は②、③、④に加えた主な変更点を示す。
B:定量的リアルタイムPCR法によるDox投与24時間後のrtTA遺伝子発現量。グラフの左から①、②、③、④の構成をもつTet-MyoD hiPS細胞の解析結果を示す。
C:筋細胞への分化誘導7日目の免疫染色の結果。MHC(緑色)は筋細胞を示す。数値は免疫染画像をもとに算出した筋細胞分化誘導効率を示す。
4. まとめ
本研究では、Tet-MyoD hiPS細胞からDox応答性と非応答性の細胞を分離したことで、Tet-Onシステムにおける遺伝子発現がrtTA遺伝子発現に依存することを明らかにしました。また、rtTA遺伝子と連結していた薬剤耐性遺伝子をNeoRからPuroRに変更するという単純な方法で、rtTA遺伝子発現を改善し、目的遺伝子の発現を均一にできることを示しました。Tet-Onシステムは、これまでに幅広い研究分野で活用されており、特にヒトiPS細胞ではMyoD遺伝子を含めた細胞種特異的なマスター転写因子の発現を主軸とした細胞分化誘導法に多く応用されています。このことから、今回新たに見出したTet-Onシステムの知見とヒトiPS細胞から筋細胞への分化誘導法は、MyoD遺伝子以外のマスター転写因子を活用した細胞分化誘導法の開発にも貢献することが期待されます。
5. 論文名と著者
- 論文名
Uniform transgene activation in Tet-On systems depends on sustained rtTA expression - ジャーナル名
iScience - 著者
Jun Otomo1, Knut Woltjen1*, Hidetoshi Sakurai1*
* : 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。国立研究開発法人 日本医療研究開発機構(AMED)(JP17bm0804005、JP22bm0104001)
7. 用語説明
注1)テトラサイクリン応答型制御システム (Tet-Onシステム)
テトラサイクリン応答性プロモーターに組み込まれた遺伝子発現を制御するシステム。このシステムが導入された細胞に低分子化合物のドキシサイクリン(Dox)を投与することで、目的遺伝子を強制発現させることができる。任意のタイミングで細胞に目的遺伝子を発現させられることから、汎用性の高い遺伝子工学ツールとなっている。
注2)MyoD遺伝子強制発現法
筋細胞分化のマスター転写因子であるMyoD遺伝子を強制的に細胞に発現させることで、筋細胞を作製する手法。これにより、ヒトiPS細胞から約1週間で筋細胞を誘導することができる。
注3)rtTA遺伝子
Tet-Onシステムの機能の一部。低分子化合物のドキシサイクリン(Dox)と複合体を形成し、テトラサイクリン応答性プロモーターに結合することで、プロモーターを活性化させ、プロモーター下の遺伝子を発現させる。
注4)ピューロマイシン耐性遺伝子 (PuroR)
遺伝子発現ベクターに搭載する代表的な薬剤選択マーカーの一つ。この遺伝子を発現する細胞は、抗生物質のピューロマイシンに耐性があるので、遺伝子発現ベクターが導入された細胞のみを選択的に培養することが可能となる。
注5)ネオマイシン耐性遺伝子 (NeoR)
遺伝子発現ベクターに搭載する代表的な薬剤選択マーカーの一つ。この遺伝子を発現する細胞は、抗生物質のG418に耐性があるので、遺伝子発現ベクターが導入された細胞のみを選択的に培養することが可能となる。
注6)G418
薬剤選択に用いられる抗生物質の一つ。ネオマイシン耐性遺伝子(NeoR)を発現する細胞はG418に耐性をもつ。
注7)セルソーター
細胞で発現しているmCherryなどの蛍光シグナルを検出することで、特定の細胞集団の割合を算出したり、蛍光シグナルを指標に特定の細胞集団を分離することができる装置。