2018-08-24 東京大学
1.発表者:
川口 寧(東京大学医科学研究所 感染・免疫部門ウイルス病態制御分野 / 感染症国際研究 センター / アジア感染症研究拠点 教授)
有井 潤(東京大学医科学研究所 感染・免疫部門ウイルス病態制御分野 / 感染症国際研究 センター / アジア感染症研究拠点 助教)
2.発表のポイント:
◆単純ヘルペスウイルス(HSV)が増殖するには、カプシド(注1)の核内膜からの出芽が必 要だが、そのためには、宿主細胞の ESCRT-III システム(注 2)が核内膜に集積され、核内 膜を切断する必要があることを発見しました。
◆非感染細胞における巨大リボ核蛋白質(RNP)複合体(注 3)の核外輸送や、核内膜の恒常 性維持にも ESCRT-III が貢献していることを発見しました。
◆本研究成果によって、HSV は本来宿主細胞が持つ核外輸送機構をハイジャックすることで ウイルス粒子を輸送し、効率的に子孫ウイルスを産生していることが明らかになりました。 また、本研究は、解明されたウイルス輸送の分子機構を標的としたヘルペスウイルス感染 症の新しい治療法の開発に繋がることが期待されます。
3.発表概要:
ヒトに多彩な病態を引き起こす単純ヘルペスウイルス(HSV)は、宿主細胞の核内におい て、ウイルスゲノムを内包したカプシド(注 1)を形成します。核内のカプシドは、HSV 粒 子の最終形成の場である細胞質へと輸送される必要があります。その際、核膜孔非依存的な 小胞媒介性核外輸送という生物学上極めてユニークな核外輸送機構でカプシドは核外に輸送 されます。しかし、小胞媒介性核外輸送の分子機構はほとんど不明でした。東京大学医科学 研究所の川口寧教授、有井潤助教らの研究グループは、HSV カプシドの核外輸送には、本来 細胞質で機能する宿主の ESCRT-III システムが利用されていることを明らかにしました。さ らに非感染細胞における巨大リボ核蛋白質(RNP)複合体の核外輸送や、核内膜の恒常性維 持にも同様のシステムが貢献していることを発見しました。つまり HSV は、細胞に本来備わ っている核外輸送機構を活性化(ハイジャック)することでカプシドの核外輸送を達成して いると考えられます。本研究は、ウイルス研究から、細胞に本来備わっているユニークな核 外輸送の分子機構とその意義を明らかにしただけでなく、HSV 感染症や核内膜の恒常性破綻 に起因する遺伝性疾患の新しい治療法の開発に繋がることが期待されます。
本研究成果は、2018 年 8 月 23 日午後 6 時(英国時間 8 月 23 日午前 10 時)、英国科学雑 誌「Nature Communications」のオンライン版で公開されました。なお、本研究成果は、文部科 学省新学術領域研究、日本学術振興会(JSPS)科学研究費補助金事業、文部科学省共同利用・共同研究拠点事業などの一環として得られました。
4.発表内容:
①研究の背景・先行研究における問題点
HSV はヒトに口唇ヘルペス、脳炎、性器ヘルペス、皮膚疾患、眼疾患、新生児ヘルペスと いった多様な病態を引き起こします。HSV は一度感染したらヒト体内に終生潜伏し、潜伏と 再発を繰り返すことが特徴で、実に人類の 70%以上が HSV の感染者とされています。DNA ウイルスである HSV は、核内においてウイルスゲノムを内包したカプシドを形成しますが、 増殖するためには、最終的にウイルス粒子が形成される細胞質へと輸送される必要がありま す。しかし、巨大な複合体である HSV カプシドは、核膜孔の通過許容サイズを超えているた め、HSV カプシドは小胞媒介性核外輸送という細胞生物学上ユニークな核外輸送機構で核内 から細胞質へ輸送されます。つまり、HSV カプシドは、一旦核内膜に対して出芽し、核内外 膜間において膜に包まれた小胞構造を形成後、この小胞が核外膜と融合することで、カプシ ドが細胞質へと放出されます。また、ウイルスが感染していないハエの細胞において、巨大 RNP 複合体が類似した方法で核外輸送されることがわかっていました。しかし、この複雑で ユニークな小胞媒介性核外輸送の分子機構は不明でした。
②研究内容
細胞に本来備わっている ESCRT-III システム(注 2)は、細胞質で機能し、多くのウイルス の出芽や細胞外小胞の形成の最終段階において細胞質膜を切断することが知られています。 一方、HSV を感染させた細胞では、ESCRT-III は HSV 蛋白質 UL31/UL34 依存的に核内膜に 集積されていました。ESCRT-III の阻害は、核内膜からの HSV の出芽を抑制し、ウイルスの 増殖を著しく阻害しました。以上の結果から、HSV は自身のウイルス因子を利用して、ESCRTIII システムという宿主細胞機構を核内膜において活性化(ハイジャック)することで HSV カ プシドの核外輸送を達成していることが明らかになりました。また、ESCRT-III の阻害は、ハ エ細胞における巨大 RNP 複合体の核外輸送も阻害しました。さらに興味深いことに、HSV が 感染していないヒト細胞において ESCRT-III を阻害すると、核内膜の過形成が誘導されまし た。つまり、これまで細胞質膜の切断を担うとされてきた ESCRT-III は、非感染細胞におい ても核内膜で機能し、RNP の核外輸送や核内膜の恒常性維持に貢献していることが明らかに なりました。 小胞性核外輸送は、ほとんどの非感染培養細胞で検出できません。そのため、長らくこの 現象はヘルペスウイルス感染細胞特有の現象だと考えられてきました。本研究は、ウイルス 研究から、細胞に本来備わっているユニークな核外輸送の分子機構とその意義を明らかにし たものといえます。
③社会的意義・今後の予定
本研究成果は、長年未解明であった HSV カプシドの核外輸送の分子機構を解明しただけで なく、非感染細胞においても同様の機構が存在し、小胞媒介性核外輸送や核内膜恒常性の維 持に寄与することを世界で初めて明らかにした点で、学術的に高い意義を有していると考えられます。
HSV が子孫ウイルスを産生するためには、カプシドの核外輸送は必須な過程と考えられて います。その分子機構の解明は、HSV 感染症の新しい治療法や予防法の開発に繋がることが 期待されます。また、核内膜恒常性の破綻は、多くの遺伝性疾患において認められ、その病 態発現の原因と考えられています。本研究成果は、これらの疾患の病態発現機構の解明と治 療法開発への一歩となることが考えられます。
5.発表雑誌:
雑誌名:Nature Communications (英国時間 8 月 23 日午前 10 時オンライン掲載)
論文タイトル: ESCRT-III mediates budding across the inner nuclear membrane and regulates its integrity
著者:有井潤、渡辺瑞季、前田史雄、西住(渡海)紀子、千原崇裕、三浦正幸、丸鶴雄平、小 栁直人、加藤哲久、川口寧
DOI 番号:10.1038/s41467-018-05889-9
6.問い合わせ先:
<研究に関するお問い合わせ>
東京大学医科学研究所ウイルス病態制御分野
教授 川口 寧(かわぐち やすし)
<報道に関するお問い合わせ>
東京大学医科学研究所 管理課総務チーム
7.用語解説:
(注 1)カプシド:ウイルスタンパク質が形作り、ウイルスのゲノムを取り囲む殻のこと。 HSV の場合は正二十面体。
(注 2)ESCRT-III:多数の構成因子が規則正しく集合することで膜を切断する細胞のシステ ム。細胞分裂や細胞外小胞の形成などにおける膜切断を担う。多くのウイルスは、細胞質 からの出芽に ESCRT-III を利用していることが知られている。
(注 3)RNP 複合体:RNA と核タンパク質の複合体。ハエ細胞において認められる巨大 RNP は、細胞質に輸送され、シナプスの形成に寄与することが知られている。
8.添付資料:
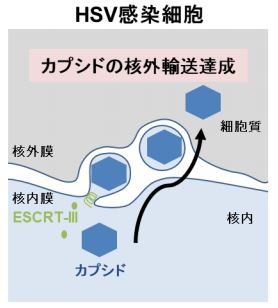
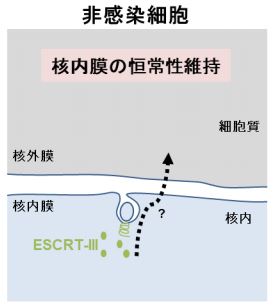
図 HSV 感染ヒト細胞では、ESCRT-III は核内膜の切断を行うことで、核内の HSV カプシド の核外輸送を引き起こす。同様に、非感染ハエ細胞における巨大 RNP 複合体の核外輸送にも ESCRT-III が必要である。また、非感染ヒト細胞においては、ESCRT-III は核内膜の恒常性維 持に貢献している。HSV は細胞に本来備わっている核外輸送機構を活性化(ハイジャック) することで、カプシドを核内から細胞質に輸送し、子孫ウイルスの産生を達成していると考えられる。