2023-10-17 国立がん研究センター,千葉大学,東京大学,京都医療科学大学
発表のポイント
- 放射性医薬品*1は次世代のがん画像診断・がん治療薬剤として大きな注目を集めています。これまでは、薬をがん病巣に到達させる技術の開発に力が注がれてきましたが、肝臓など健常な組織にも薬が分布してしまうのを避けることができませんでした。
- 放射性医薬品を用いる核医学に薬物送達システム(Drug Delivery System, DDS)*2、さらに錯体化学*3を組み合わせることで、健常組織への薬の分布を抑えるのではなく、いったん分布した薬を迅速に体外に排出させる新たな手法を開発しました。
- 本手法によって、がん病巣に放射性医薬品を充分に集積させると同時に、健常組織への薬の停滞時間を大きく短縮させ、結果として、がん病巣だけに薬を集中させ、がん病巣への薬の作用を従来よりも飛躍的に改善させることに成功しました。
- 本研究成果により、難治性がん画像診断の精度向上、健常組織への毒性低減、治療効果向上などが期待できます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)先端医療開発センター(センター長 土井俊彦) 機能診断開発分野の梅田泉研究員、藤井博史研究員などからなる研究チームは、千葉大学大学院薬学研究院、東京大学国際高等研究所カブリ数物連携宇宙研究機構、京都医療科学大学との共同研究で、核医学に薬物送達システム(Drug Delivery System, DDS)と錯体化学という異分野領域を巧みに組み合わせることで、健常組織への薬の分布を抑えるのではなく、いったん分布した薬を迅速に体外に排出させる新たな手法を開発しました。
放射性医薬品を用いた核医学がん画像診断・がん治療は、診断と治療の一体化を可能とする次世代の高精度がん診療(セラノスティクス)*4として多くの注目を集めています。放射性医薬品をがん病巣に集めることで、がんを正しく診断し、かつ効果的に治療を行うことが可能です。しかしながらこれまでは、がん以外の健常組織、特に肝臓などにも集積してしまうという問題点が未解決でした。この問題に対して、研究チームでは発想を転換し、集積を抑制するのではなく、いったん肝臓などに集積した後に、これを速やかに排泄させて、結果的に肝臓や脾臓への放射性同位元素(RI)*5停滞を大幅に低減し、がんの診断や選択的治療の妨げにならない手法の開発を手がけました。具体的には、リポソーム*6に、111In-エチレンジシステイン(111In-EC)という独自の錯体で標識したRIを封入した新規製剤を開発しました。
今回開発した新しい手法によって、がん病巣への高い集積を保ったまま、肝臓などの健常組織では一旦取り込まれるものの、速やかに消失して尿として体外に排泄され、結果としてがん病巣のみにRIを集中させることができました。この画期的なアプローチによって、難治性がん画像診断の精度向上、健常組織への毒性低減、治療効果向上などが期待できます。
本研究の成果は医学雑誌「Journal of Controlled Release」に2023年8月23日付(オンライン版)で掲載されました。
背景
放射性医薬品を用いた核医学がん画像診断・がん治療は、RIを医薬品として体に投与し、がん病巣に集め、放出される放射線でがんの画像診断を行ったり、がん細胞の増殖をピンポイントで抑えて治療を行うものです。核医学画像診断はすでに臨床でも広く用いられています。核医学治療は、苦痛はほとんどなく、正常な細胞への影響が少ないため、他に治療手段のない難治性がんに対しても大きな治療効果が期待でき、近年、多くの注目が集まっています。さらに画像診断と治療を一体化させた一連の高精度がん診療(セラノスティクス)は、次世代のがん診療として有望視されています。
しかし、従来の核医学がん画像診断・がん治療では、投与された放射性医薬品が、がん病巣以外の健常組織にも集積してしまうという大きな問題がありました。薬は血流にのって体内を回りながらがん病巣に集まるため、がん病巣以外の健常な組織にもRIが取り込まれてしまいます。特に、重要な臓器である肝臓などに集積してしまうと毒性に繋がることから、がんの診断や選択的治療の妨げとなっていました。
核医学治療実用化のためには、がん病巣に薬を充分に集中させると同時に、非がん組織への集積を最小限に抑えることが極めて重要です。しかしながら、この2点は相反するもので、両立は非常に難しい課題でした。本研究では、この難しい2課題の両立を達成すべく、核医学で用いるRIの大半が金属イオンであることを巧みに利用し、核医学とDDS、錯体化学を組み合わせた独自の手法を開発しました。
研究方法・成果
図1は、本研究で検討した放射性医薬品(RI封入リポソーム)の構成を示しています。構成要素は放射性医薬品の本体であるRI、RIに結合して安定化する配位子(chelating ligand)、リポソームの3種です。RIは配位子と錯体を形成した形でリポソームの内部に封入されています。図に示した2種類のRI封入リポソームは、リポソームの組成や粒子径などは同一であり、RIも同じ111Inで、異なるのは配位子のみです。ここでは、配位子としてニトリロ三酢酸(NTA)とエチレンジシステイン(EC)が例示されています。ECが本研究で新たに着目した新しい配位子です。本研究では、この3種の組合せによって、RIの体内挙動を巧みに制御し、がん病巣のみにRIを集中できる理想的な放射性医薬品とすることを目指しました。
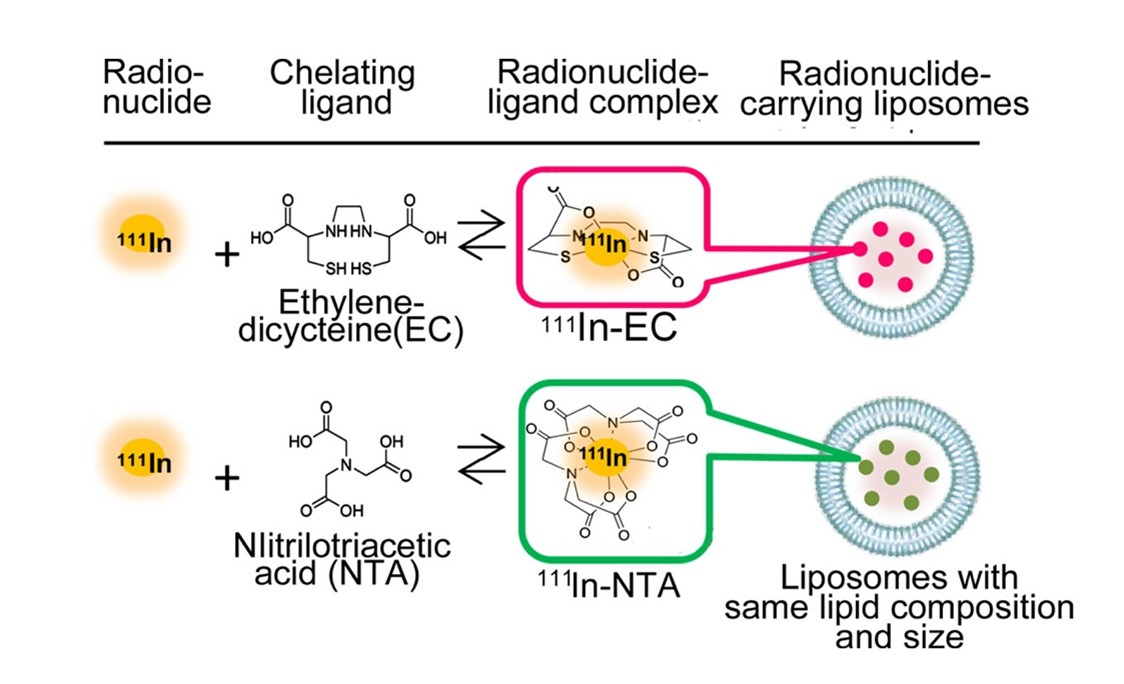
図1 RI封入リポソームの構成要素.
新しい配位子(ligand)としてエチレンシステイン(EC)を検討した。
まず、上述の2種類の111In-配位子錯体封入リポソームをそれぞれ担がんマウスに投与し、がん並びに肝臓や脾臓などの健常組織への 111Inの取込および集積を、時間を追って観察しました(図2)。その結果、両者の腫瘍(がん)への集積には大きな差はなく、いずれも良好な集積を示しましたが、肝臓および脾臓においては、顕著な違いが生じることが確認できました。すなわち、111In-NTAリポソーム(緑)は肝臓や脾臓に多量に取り込まれ、長時間留まっているのに対して、111In-ECリポソーム(ピンク)は、いったん取り込まれるものの、速やかな消失が認められました。結果として、投与24時間後の腫瘍/肝臓比は大幅に向上しました。111In-ECリポソームは、尿中排泄、糞中排泄ともに促進されており、尿の分析から、111In-EC錯体の形で排泄されていることも明らかになりました。
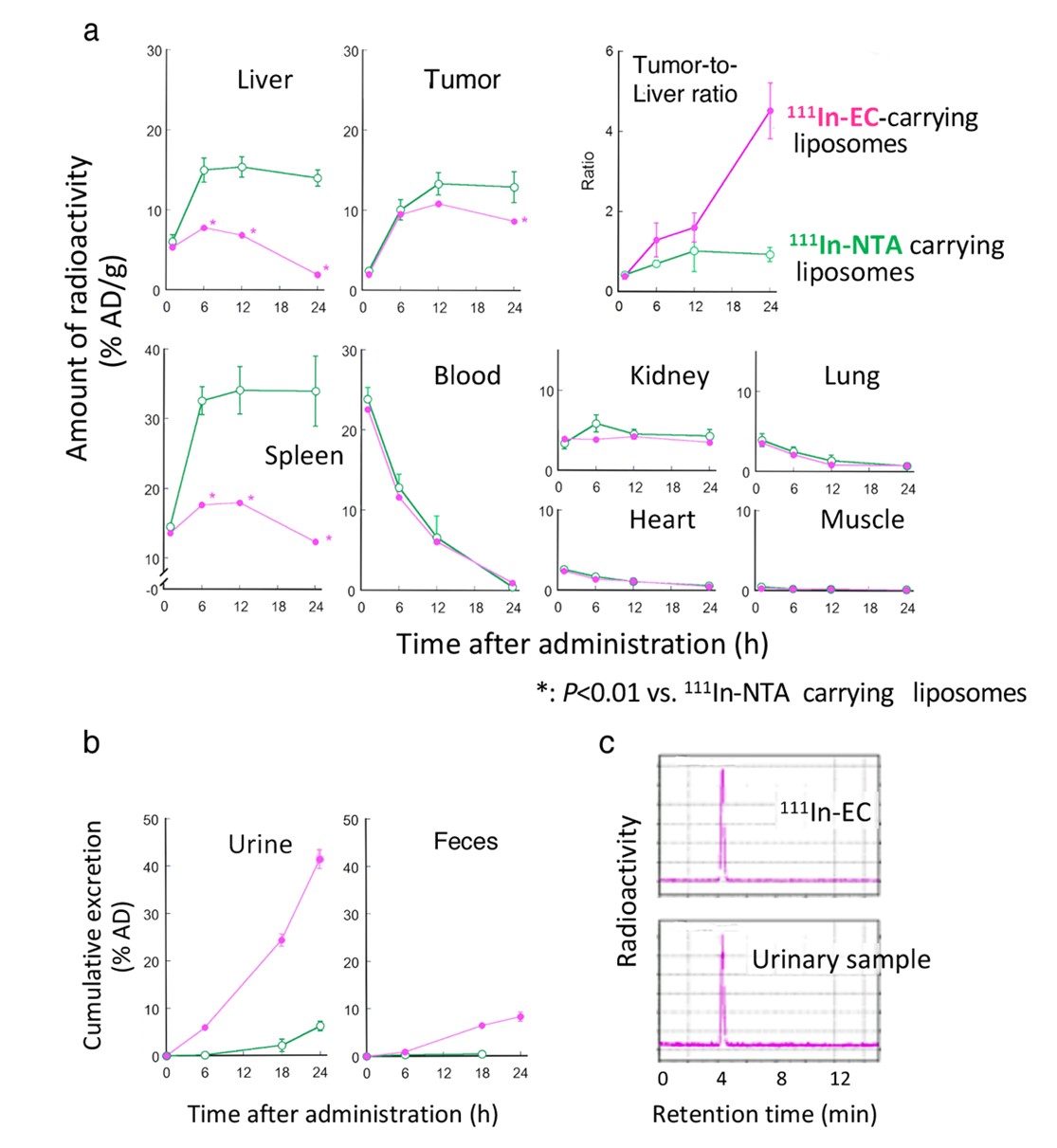
図2 111In-EC封入リポソームと111In-NTAリポソ-ムを担がんマウスに投与後の111In放射活性の体内挙動の相違. a; 腫瘍および各臓器への111In放射活性集積の経時的変化. b; 糞尿中への111In放射活性の累積的排出. c; HPLCによる尿中の111In放射活性の化学形分析
次に、肝臓と腫瘍を摘出して、生化学的な分析を行いました。その結果、111In-NTAリポソームの肝臓での滞留は細胞内ライソゾーム画分での捕捉によることがわかりました。興味深いことに111In-ECリポソームではその捕捉が解除されていました。一方、腫瘍では、2種類のリポソームの間に明らかな差は認められず、また、ライソゾーム画分への滞留もありませんでした。さらに、高速液体クロマトグラフィと分子ふるいカラムによる分析により、投与24時間後、肝臓ではどちらのリポソームもすでにほとんど壊れていて、内部の111In錯体が放出されていましたが、腫瘍ではどちらのリポソームも大半は111In錯体を内部に封入したまま、形を保っていることが明らかとなりました。
国立がん研究センター先端医療開発センター機能診断開発分野に設置されている小動物専用の高分解能画像診断装置を用いて薬剤の体内分布を画像化しました(図3)。投与1時間後では2種類のリポソームの間に分布の差異はありませんでしたが、24時間後、111In-NTAリポソームは肝臓や脾臓に大量に集積しているのに対して、111In-ECリポソームでは腹部の集積はほぼ完全に消失し、腫瘍のみに薬剤が集中していることが明瞭に示されました。この画像は組織分布の結果ともよく合致しており、本研究で開発された手法が優れたものであることを裏付けるものです。
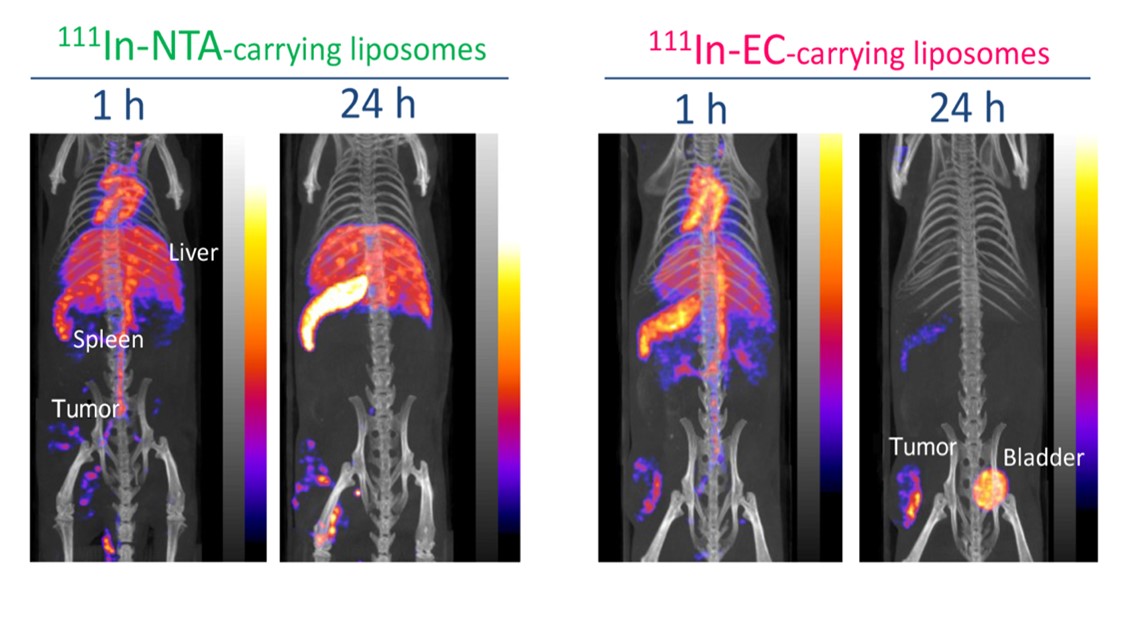
図3 111In-EC封入リポソームと111In-NTAリポソ-ムを担がんマウスに投与後のin vivo SPECT/CT画像.
111In-EC封入リポソームも一旦は肝臓や脾臓に集まるが、速やかに排泄される。その様子を分子イメージング技術を使って画像化した。
各組織の被曝線量推定でも、111In-ECリポソームは肝臓、脾臓において111In-NTAリポソームの3割以下にまで低減され、他のいずれの組織でも大幅に減少していました。腫瘍へRIを集中させ、かつ健常組織を守るという目的が達成できたと考えられます。
本研究の戦略の成功には2つの因子が関わっていると考えられます。1つは配位子ECの特異な性質です。ECは脳血流診断薬に用いられているエチレンシステイン二量体(ECD)の代謝物のひとつです。本研究チームは、投与された99mTc-ECDの大部分が肝臓に集積するものの、速やかに尿中に排泄され、その代謝物が99mTc-ECであることに着目し、111In-ECリポソームのアイデアを着想しました。本研究の結果からもEC錯体は肝臓や脾臓から速やかにクリアランスされる性質を有すると考えられます。
2つ目の成功の要因は、肝臓と腫瘍におけるリポソームの分解速度の違いです。本研究の検討では、ほとんどのリポソームは腫瘍内で長時間壊れずに存在し、RI-配位子錯体はリポソーム内に保持されていました。一方、肝臓では、リポソームは速やかに分解され、内包されたRI錯体が放出されていました。EC錯体がその性質を発揮するためには、リポソームから放出されることが必要です。これらの結果は、111In-ECリポソームが腫瘍では良好な集積を示し、肝臓や脾臓からは速やかに排出された理由を説明していると考えられます。
本研究で得られた結果に基づき、RI封入リポソームの生体内運命を説明するスキームを提案しました(図4)。
従来型の111In-NTA-リポソームと今回新たに考案された111In-EC-リポソームは、いずれも静脈内投与後、血流中を循環し、リポソームの性質によって腫瘍に高率に集積します。ほとんどのリポソームは、腫瘍内で長時間壊れずに、内部の111In錯体を保持したまま留まります。その結果、いずれのリポソームでも腫瘍に高率に、かつ長時間にわたってRIを集積させることができます。一方、肝臓に到達したリポソームは、そこで速やかに分解され、内封された111In錯体が放出されます。111In-NTAのような従来型の111In錯体は、肝臓で捕捉され、長く留まってしまいますが、新たに開発した111In-ECは、その特異な性質を発揮して、いったんは取り込まれるものの、迅速に肝臓から洗い出され、他の組織にも蓄積することなく、速やかに尿として体外に排泄されます。結果として、健常組織へのRI集積は大きく低減し、がん病巣のみに放射性核種を集中させることができるようになりました。化学療法剤はがん細胞に直接とりこまれることが必要ですが、放射性医薬品の場合は、RIがリポソームの中にあっても効果を発揮することができます。今回、検討した手法によって、核医学がん画像診断・がん治療の効率は大きく向上し、健常組織への障害は最小限に抑制できると考えられます。
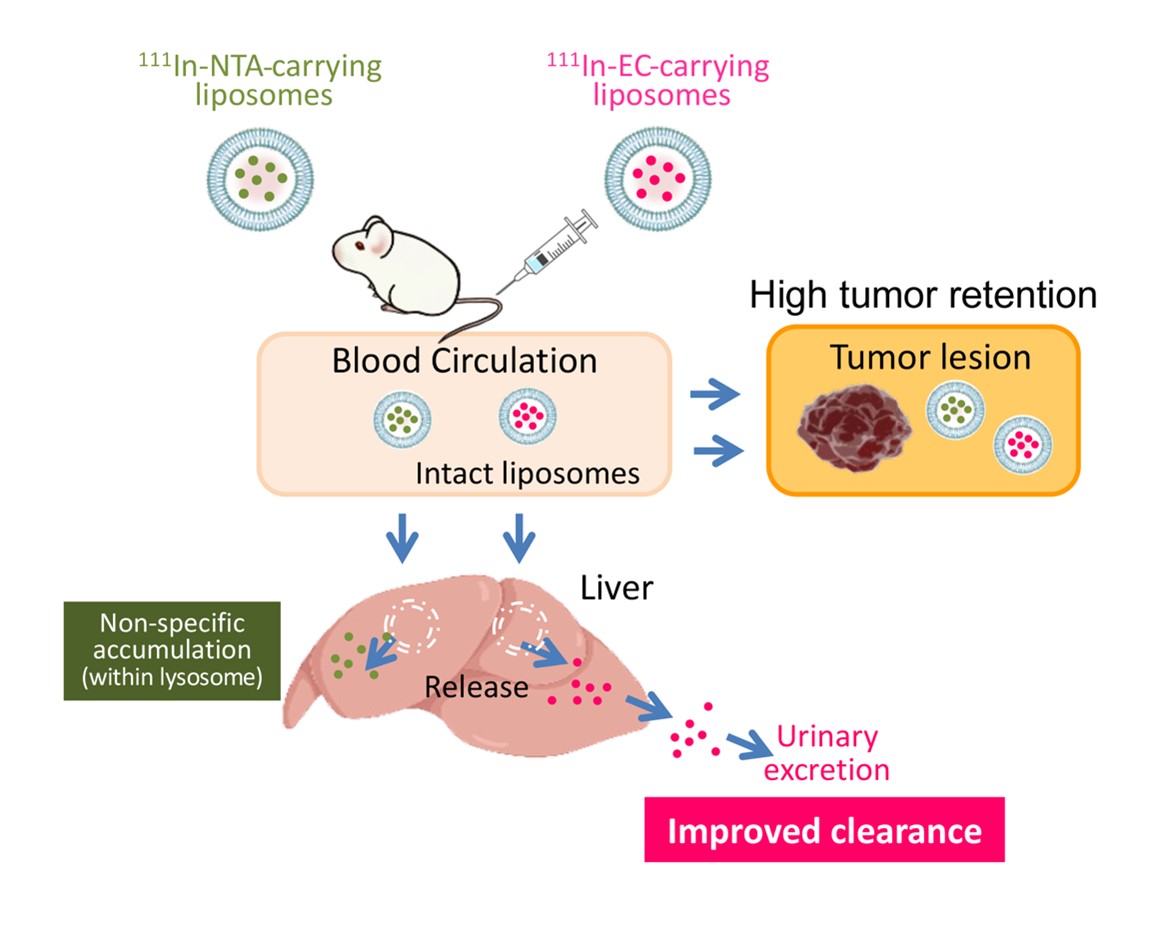
図4 担がんマウスに投与後のRI封入リポソームの予想される生体内運命.
リポソームに封入するRI-配位子錯体の工夫により、RIががん病巣には保持され、健常組織には留まらないという新しいRIの送達系を実現することに成功した。
本研究では、核医学、DDS、錯体化学を組み合わせることで、がん病巣のみにRIを集中させ、健常組織への集積を最小限にする手法を開発しました。腫瘍への標的集中にリポソームを用い、かつ、健常組織である肝臓、脾臓ではリポソームと錯体の性質を巧みに利用して、迅速な洗い出しによって集積低減を図るという、放射性医薬品の体内動態の緻密な制御は、これまで報告されていない画期的な手法であり、高い独自性を発揮しています。
展望
今後は、健常臓器への分布を避けるだけではなく、分布してしまった薬を迅速に排出させ、がん病巣には薬を留めるという新たな発想で薬剤開発を進めることで、これまでになかったがん病巣だけに留まる薬の開発が期待されます。特に最近では、α線放出核種などのアイソトープを利用したがん治療薬が精力的に開発されており、薬をがん病巣のみへ長く留めることの重要性がより増してきています。このタイミングで、健常組織を保護しつつ、かつ薬のがん病巣への集中を保持するための新しい視点での薬剤開発の手法が拓かれたことは、将来的に高精度がん診療(セラノスティクス)が難治性がん診療に果たす役割を考える上で、非常に重要な意味を持つと考えられます。
発表論文
雑誌名
Journal of Controlled Release
タイトル
New liposome-radionuclide-chelate combination for tumor targeting and rapid healthy tissue clearance
著者
Izumi O. Umeda, Yusuke Koike, Mayumi Ogata, Emi Kaneko, Shusei Hamamichi, Tomoya Uehara, Kunikazu Moribe, Yasushi Arano, Tadayuki Takahashi, Hirofumi Fujii
DOI
doi.org/10.1016/j.jconrel.2023.07.060
掲載日
2023年8月23日
URL
https://doi.org/10.1016/j.jconrel.2023.07.060(外部サイトにリンクします)
研究費
- 国立がん研究センターがん研究開発費
放射性核種封入リポソームによるがん選択的内用療法およびtheranostics製剤の開発(29-シーズ選定-7) - 日本学術振興会
基盤研究(A) 「進行固形がんの治癒をも可能にする革新的内用放射線治療法/セラノスティクスの創成」 - 国立研究開発法人日本医療研究開発機構(AMED)
次世代がん医療創生研究事業
「放射錯体化学とDDS先端技術の融合による革新的RI内用療法/radio-theranosticsの創出」 - 新学術領域研究(日本学術振興会)
宇宙観測検出器と量子ビームの出会い。新たな応用への架け橋
研究プロジェクトおよび研究参画者
本研究は、国立がん研究センター先端医療開発センター機能診断開発分野と千葉大学大学院薬学研究院が共同で実施した新規放射性医薬品開発研究を土台として、同機能診断開発分野と東京大学カブリ数物連携宇宙研究機構が共同で実施した宇宙観測技術の医学応用を目指した高精度ガンマカメラ開発研究、および機能診断開発分野と京都医療科学大学による核医学データ解析研究を融合させ、まとめたものです。
氏名;所属(研究当時)
梅田泉(共同筆頭著者、責任著者); 国立がん研究センター、東京大学カブリ数物連携宇宙研究機構、京都医療科学大学
小池悠介(共同筆頭著者); 国立がん研究センター、千葉大学大学院薬学研究院
緒方真由美; 国立がん研究センター、千葉大学大学院薬学研究院
金子恵美; 千葉大学大学院薬学研究院
濱道修生; 国立がん研究センター
上原知也; 千葉大学大学院薬学研究院
森部久仁一; 千葉大学大学院薬学研究院
荒野泰; 千葉大学大学院薬学研究院
高橋忠幸; 東京大学カブリ数物連携宇宙研究機構
藤井博史; 国立がん研究センター
用語解説
*1 放射性医薬品
核医学画像診断や核医学治療のために用いられる、放射性同位元素(RI)を含む医薬品。医薬品効能の本体はRIであり、放出される放射線によって、体内の組織や臓器の機能や病態を評価したり、疾病を治療するために用いられます。透過性の高いγ線などを放出する核種(111In, 99mTc, 18Fなど)が診断に、細胞傷害性をもつβ線やα線放出核種(90Y, 177Lu, 225Acなど)が治療に用いられます。RI自体が標的指向性を有しているもの(131I、223Raなど)、RIと結合してRIを含んだ形が標的指向性を発揮するもの(99mTc-MIBI, 99mTc-HMPAOなど)、標的指向性をもつ分子やキャリアにRIを結合(標識)させたもの等があります。
*2 薬物送達システム(Drug Delivery System, DDS)
必要な薬物を必要な時間に必要な部位で作用させるための技術の総称。薬物の体内動態を量的・空間的・時間的に制御することによって、治療効果の向上や副作用の軽減を図る目的で使用されます。放出制御、吸収改善、標的選択的送達などに用いられます。標的選択的送達には抗体薬物複合体やミセル製剤、リポソームなどのナノキャリアが用いられます。
*3 錯体化学
錯体とは、無機物質である金属イオンに対して、配位子と呼ばれる有機化合物がイオン結合や共有結合、配位結合や水素結合などによって配位して形成される化合物の総称です。錯体は物理的にも化学的にも単体とは異なる性質を持ちます。中心イオンの周囲に配位子が平面四角形、正八面体などのさまざまな形式で配位することによって形成され、配位子の種類や配位形式によって性質に違いが生じます。金属イオンと配位子の組合せは無限にあり、その組合せの違いから様々な分子機能を発揮することが知られています。こういった錯体構造や分子機能全般の研究領域が錯体化学です。錯体の身近な例として、赤血球中のヘモグロビンやビタミンB12などがあります。また、代表的な制がん剤であるシスプラチンは白金の錯体です。
*4高精度がん診療(セラノスティクス)
放射性医薬品を用いた核医学がん画像診断とがん治療は、放射性核種を適切に使い分けることで、診断(diagnosis)の結果に基づいて、最適な治療(therapy)を可能にします。すなわち、治療(therapy)と診断(diagnosis)の一体化により、高精度のがん診療を実現します。この一体化はセラノスティクスtheranostics (therapy + diagnosis に由来)と呼ばれ、近年多くの注目を集めています。
*5 放射性同位元素(RI)
陽子と中性子の数がアンバランスな原子核を持ち、放射線を放出して安定化する元素。この放出される放射線をがんの画像診断や治療に役立てることができます。
*6 リポソーム
脂質二分子膜からなる閉鎖小胞で、難溶性薬物の可溶化や薬物送達のためのDDSキャリアとして広く用いられています。リポソームは水にも油にもなじみやすい性質を有するため、水溶性・脂溶性いずれの薬も取り込みやすく、製剤化しやすいのが特長です。リポソーム膜は、生体膜と類似するため、身体になじみが良く、アレルギーの原因になりにくい点も利点です。また、表面を抗体など標的指向性分子で修飾することで、標的指向性を持たせることも可能です。現在、国内では加齢黄斑変性症治療薬「ビスダイン」、真菌感染症治療薬「アムビゾーム」、乳がん、卵巣がん、カポジ肉腫を適応とした抗がん剤「ドキシル」、膵がん治療薬「オニバイド」の4つがリポソーム製剤として認可されています。また、近年は化粧品などにも広く用いられています。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター先端医療開発センター
機能診断開発分野 稲木 杏吏
報道に関するお問い合わせ
千葉大学広報室
東京大学国際高等研究所カブリ数物連携宇宙研究機構 (Kavli IPMU)
広報担当 小森 真里奈
京都医療科学大学
学長室 広報担当 小山 博