2018-08-24 京都大学iPS細胞研究所(CiRA)
ポイント
- 発生期におけるシグナル環境注1を模倣することで、体節細胞注2とよばれる中胚葉注3細胞の一種を高効率で誘導する方法を開発した。
- 体節細胞から腱・靭帯細胞、真皮細胞、および間葉系間質細胞注4様細胞への分化誘導に初めて成功した。
- 本分化誘導法を、進行性骨化性線維異形成症(Fibrodysplasia Ossificans Progressiva; FOP)注5患者さん由来iPS細胞に用い、その病態の一部を再現した。
- 著者らの先行研究により同定されていた、FOPの進行を抑える薬の候補であるラパマイシン注6が、体節由来間葉系間質細胞様細胞にも効果があることを示した。
1. 要旨 中島大輝大学院生(CiRA未来生命科学開拓部門)と池谷真准教授(CiRA臨床応用研究部門)らの研究グループは、 ヒトiPS細胞から中胚葉細胞の一種である体節細胞への効率的な誘導法を確立し、さらに体節細胞から骨格筋細胞、軟骨細胞、腱靭帯細胞、真皮細胞、間葉系間質細胞様細胞へと分化誘導する方法を確立しました。体節細胞から骨格筋細胞、軟骨細胞、腱靭帯細胞、真皮細胞という4つの全ての派生細胞を誘導したのは、世界初の成果です。また、これらの誘導法をFOP患者さん由来iPS細胞に用いてFOPの病態を再現し、さらに、先行研究で同定したFOPの進行阻害薬であるラパマイシンの効果を確認しました。これにより、本研究で確立した誘導法が疾患研究に有効であることが示されました。
この研究成果は2018年8月24日午前10時(日本時間)に英国科学誌「Development」で公開されました。
2. 研究の背景 ES細胞やiPS細胞といった多能性幹細胞を出発点とする分化誘導法を構築する際、発生期におけるシグナル環境を再現することは重要なヒントとなります。これまでの研究から、中胚葉細胞を誘導する際にはアクチビン/ノーダル/トランスフォーミング増殖因子β(TGFβ)注7シグナル、または骨形成タンパク質(BMP)注8シグナルが使われていました。しかし、この誘導条件で主に誘導される中胚葉は、側板中胚葉注9であり、別の亜集団である沿軸中胚葉注10への誘導効率は20%程度と高くありませんでした。沿軸中胚葉は発生初期に前体節中胚葉を経て体節を形成し、さらに体節は背側の皮筋節と腹側の硬節に分化します(Fig. 1)。皮筋節は、さらに骨格筋の前駆体である筋節と、真皮のもとである真皮節へと分化し、硬節からは主に骨軟骨と、腱および靭帯の前駆体である靭帯節が形成されます。このように沿軸中胚葉は脊つい動物の形態形成に重要な役割を果たす細胞であり、高効率な誘導法の確立が望まれていました。
近年、いくつかの研究グループにより、異なるアプローチ方法での沿軸中胚葉の誘導法が発表されました。これらの研究では、アクチビン/ノーダル/TGFβシグナルの阻害剤添加という多能性幹細胞を神経(背側)方向への分化を誘導する条件と、比較的高濃度のGSK3注11阻害剤(WNTシグナル注12活性化剤)を組み合わせて培養することで、沿軸中胚葉マーカーを発現する細胞の誘導効率を70〜95%にまで高めることができました。
しかし、これらの研究では沿軸中胚葉から分化する細胞のうち筋節や硬節への分化能は示されていましたが、真皮節や靭帯節への分化能は、分化誘導法が確立されていないという理由もあり、示されていませんでした。また、成体における骨、軟骨、脂肪細胞のもととなる間葉系間質細胞に沿軸中胚葉が分化できるかどうかを検証した論文も存在しませんでした。
今回の研究ではヒトiPS細胞から前体節中胚葉細胞、体節細胞を誘導し、さらにそこから筋節細胞、硬節細胞とともに真皮節細胞と靭帯節細胞、および間葉系間質細胞様細胞へと分化可能であることを示しました。さらに、難治性希少疾患であるFOP患者さんから作製したiPS細胞に今回開発した誘導方法を適用し、FOPの病態を再現することに成功しました。本結果は、今回開発した分化誘導法が、正常および疾患のヒト体節の発生をモデル化するための強力なツールとなりうることを示しています。
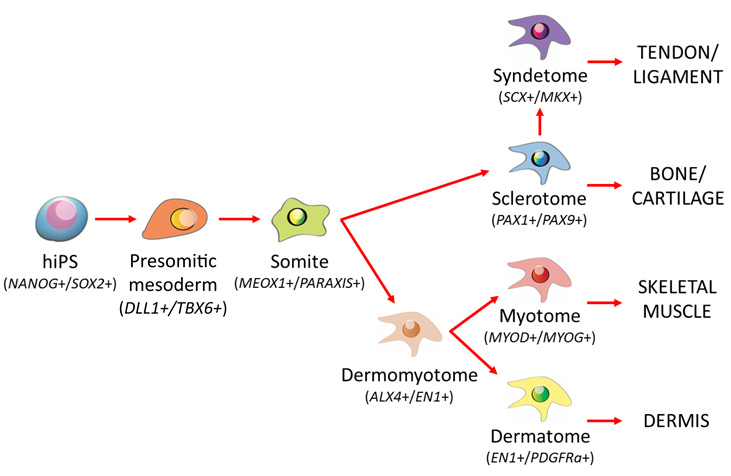
Fig.1 沿軸中胚葉への分化
ヒトiPS細胞(hiPS)は前体節中胚葉(Presomitic mesoderm)、体節細胞(Somite)へと分化したのち、腹側部分は硬節細胞(Sclerotome)に、 背側部分は皮筋節細胞(Dermomyotome)にそれぞれ分化する。硬節細胞の一部は靭帯節細胞(Syndetome)に分化し、皮筋節細胞は筋節細胞(Myotome)と真皮節細胞(Dermatome)へと分化する。
(カッコ内はそれぞれで発現している遺伝子群。)
まず、ヒトiPS細胞から前体節中胚葉細胞への誘導法を開発するために、マウス胚およびニワトリ胚におけるシグナル環境を参考にし、TGFβ-OFF / WNT-ON / BMP-OFF / FGF注13-ONの条件でヒトiPS細胞を培養しました。この際、mTeSR1注14およびマトリゲル注15を用いたフィーダーフリー注16条件下で3日間培養した後、血清を含まない化学合成培地に 10 µMのSB431542(アクチビン/ノーダル/TGFβ阻害剤)、10 µMのCHIR99021(GSK3阻害剤)、2 µMのDMH1(BMP阻害剤)、および20 ng / mLのFGF2を加え4日間培養しました(Fig. 2A)。 誘導された細胞を、前体節中胚葉細胞のマーカーであるDLL1の陽性率と、1つ発生の進んだ体節細胞のマーカーであるPAX3の陰性率注17を指標にフローサイトメトリー解析注18を行ったところ、DLL1陽性かつPAX3陰性細胞が高効率(85.4±0.4%)で誘導されていることが分かりました(Fig. 2B)。同様の結果は、前体節中胚葉細胞の別のマーカーであるTBX6の免疫染色(Fig. 2C)などでも確認されました。また、他のiPS細胞株においても同様に、DLL1陽性細胞が高効率で誘導されました。
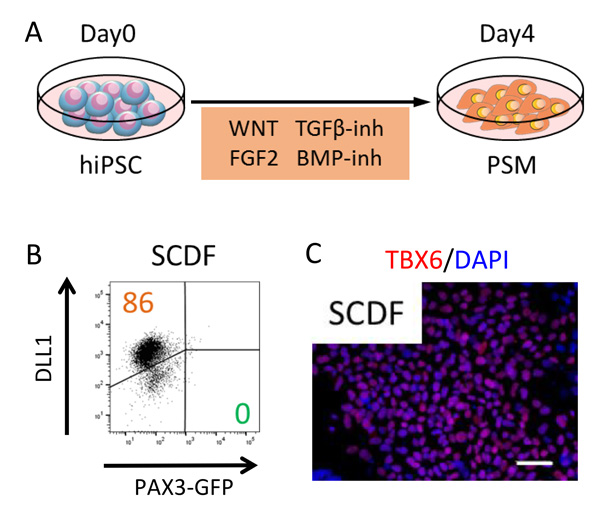
Fig.2 前体節中胚葉への分化誘導
A. 誘導条件の模式図。
B. フローサイトメトリー解析の結果。DLL1陽性かつPAX3陰性の前体節中胚葉細胞が高効率で誘導されている。
C. 前体節中胚葉のマーカーの1つであるTBX6の抗体染色でも高効率な誘導が確認された。
赤:TBX6、青:細胞核
スケールバー:50 µm
2. 前体節中胚葉から体節細胞の誘導
次に、DLL1陽性細胞を分離した後、体節細胞への誘導を試みました。発生期のシグナル環境を参考に、10 µMのSB431542および5 µM のCHIR99021で4日間処理してDLL1陽性細胞を培養したところ(Fig. 3A)、PAX3陽性の体節細胞が高効率(74.7±0.5%)で誘導されることが分かりました(Fig. 3B)。さらに、SB431542だけで処理をした場合でも体節細胞マーカーであるPAX3、PARAXIS、MEOX1の発現は誘導されましたが、CHIR99021とSB431542の両方の添加時にのみ細胞接着因子CDH11が細胞間接合部に蓄積し、体節細胞の形態的特徴である上皮化が観察されました(Fig. 3C)。
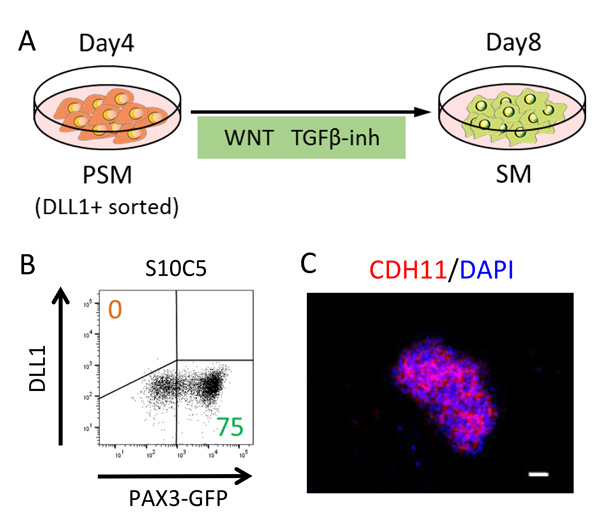
Fig.3 体節細胞への分化誘導
A. 誘導条件の模式図。
B. フローサイトメトリー解析の結果。DLL1陰性かつPAX3陽性の体節細胞が高効率で誘導されている。
C. 体節細胞の特徴の1つとして、CDH11が細胞間接合部に濃縮している。
赤:CDH11、青:細胞核
スケールバー:50 µm
3. 皮筋節細胞を介した筋節細胞および真皮節細胞の誘導
次に、体節細胞から次の発生段階の細胞への誘導を試みました。体節の背側は皮筋節細胞になり、さらに筋節細胞と真皮節細胞へと分化します(Fig. 4A)。皮筋節細胞の分化にはWNTシグナルおよびBMPシグナルが重要な機能を果たしていることが知られているため、10 µMのIWR1(WNTシグナル阻害剤)と種々の濃度のCHIR99021を用いてWNTシグナル強度を、また、10 µMのDMH1といくつかの濃度のBMP4を用いてBMPシグナル強度を調整して培養したところ、5 µM のCHIR99021および10 ng/mLの BMP4を添加すると、皮筋節細胞マーカーであるEN1の発現が効率的に誘導されることを見出しました(Fig. 4B)。誘導された皮筋節細胞の分化能力を確認するため、さらに筋節細胞への誘導を行いました。CHIR99021の単体投与により18〜30日で筋節細胞マーカーであるMYOD陽性細胞およびMYOG陽性細胞が約22%の効率で誘導されることが分かりました(Fig. 4C)。一方、継続して皮筋節誘導条件で培養を行ったところ、誘導9日で真皮節細胞マーカーの発現が上昇しました。PDGFRαは真皮節細胞および皮膚線維芽細胞で発現し、EN1は真皮節細胞および皮筋節細胞で発現するため、真皮節細胞はPDGFRα陽性かつEN1陽性細胞として定義されます。フローサイトメトリー解析により、真皮節誘導9日目の細胞の69.5±1.4%がPDGFRα陽性であり、そのPDGFRα陽性細胞のうち92.7±0.4%がEN1陽性と分かりました(Fig. 4D, E)。またマーカーの発現だけではなく、真皮細胞の機能の1つであるコラーゲンおよびヒアルロン酸などの細胞外マトリックス注19タンパク質の分泌を調べたところ、iPS細胞由来の真皮節細胞は、成人の皮膚線維芽細胞と同程度の1型コラーゲンおよびヒアルロン酸を分泌していることが分かりました。
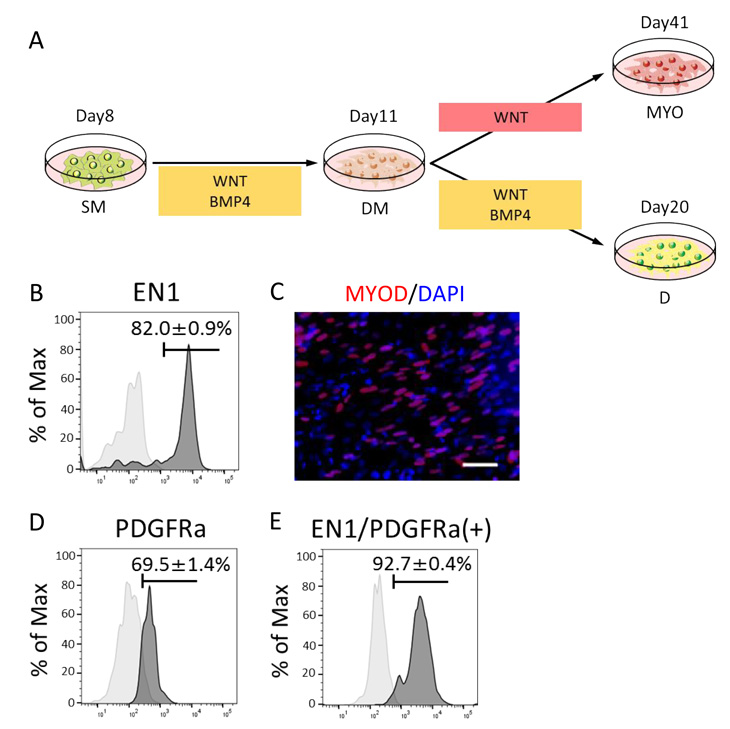
Fig.4 皮筋節細胞、筋節細胞、真皮節細胞への分化誘導
A. 誘導条件の模式図。
B. 皮筋節細胞誘導後の、皮筋節細胞マーカーであるEN1陽性率のフローサイトメトリー解析の結果。
C. 筋節細胞誘導後の、筋節細胞マーカーであるMYODの免疫染色。
赤:MYOD、青:細胞核
スケールバー:50 µm
D. 真皮節誘導後の、真皮節/皮膚線維芽細胞マーカーであるPDGFRα陽性率のフローサイトメトリー解析の結果。
E. 真皮節誘導後、PDGFRαで分離した細胞の、真皮節/皮筋節細胞マーカーであるEN1陽性率のフローサイトメトリー解析の結果。
4. 硬節細胞からの軟骨細胞、骨細胞、靭帯節細胞の誘導
体節の腹側は、胎児期における軟骨細胞および骨細胞のもととなる硬節細胞に分化します(Fig. 5A)。既報の方法に従い、体節細胞を100 nMのSAG(SHHシグナル注20活性化剤)および0.6 µMのLDN193189(BMP阻害剤)で培養したところ、PAX1などで標識される硬節細胞が約45%の効率で誘導されました(Fig. 5B)。また、硬節細胞から骨軟骨細胞への分化能も確認されました。
硬節細胞の最も背側部分は腱および靭帯の前駆細胞である靭帯節細胞へと分化します(Fig. 5A)。しかし、その分化誘導法はこれまで報告されていませんでした。
そこで、硬節へと誘導した細胞にFGF8を72時間処理し、次いでBMP7およびTGFβ3を18日間添加したところ、SCXなどの靭帯節マーカーの発現上昇が確認されました(Fig. 5C)。これまでの研究により、機械的ストレスが出生前後の腱の発達に影響し、前駆細胞から腱細胞の分化を促進することが報告されています。そこで、誘導された靭帯節細胞に機械的ストレスを与えながら培養したところ、ストレスに応答して靭帯節関連マーカーの発現が誘導されることが分かりました。
これらのことから、今回開発した分化誘導法で誘導された体節細胞は、真皮節細胞、筋節細胞、硬節細胞、靭帯節細胞へと分化できることが分かりました。
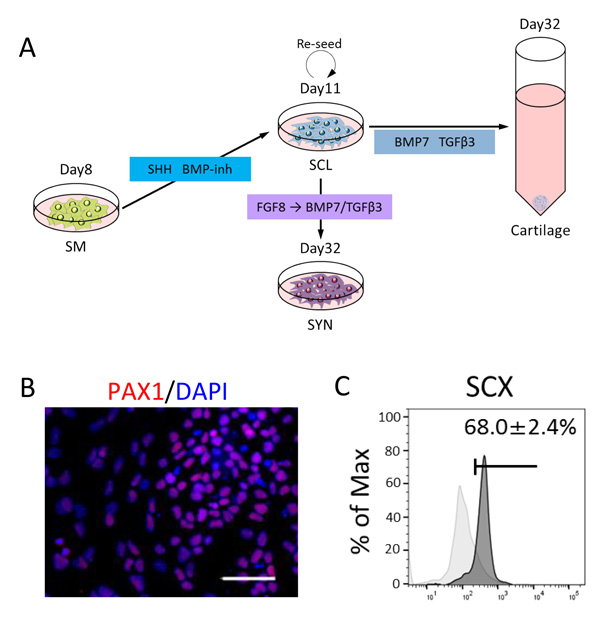
Fig.5 硬節細胞と靭帯節細胞への分化誘導
A. 誘導条件の模式図。
B. PAX1陽性の硬節細胞が高効率で誘導されている。
赤:PAX1、青:細胞核
スケールバー:50 µm
C. フローサイトメトリー解析の結果。SCX陽性の靭帯節細胞が高効率で誘導されている。
5. 体節細胞からの間葉系間質細胞様細胞の誘導
間葉系間質細胞の発生学上の起源として側板中胚葉と神経堤細胞注21が知られていますが、体節細胞が間葉系間質細胞の起源の1つであるかどうかはまだ分かっていません。
そこでまず、体節細胞が間葉系間質細胞に分化できるかどうかを調べました。神経堤細胞から間葉系間質細胞を誘導する際に用いられる培地である、FGF2を添加した10%ウシ胎児血清(FBS)/αMEMで体節細胞を培養すると(Fig. 6A)、2継代後には細胞の形態が線維芽細胞様へと変化し、間葉系間質細胞の表面マーカーであるCD44、CD73およびCD105が陽性となりました(Fig. 6B)。また、誘導された間葉系間質細胞様細胞は骨、軟骨、および脂肪細胞への分化能を有していました。網羅的遺伝子発現解析からも、体節細胞由来の間葉系間質細胞様細胞はヒト骨髄由来間葉系間質細胞と同様の特徴を持つことが分かりました。
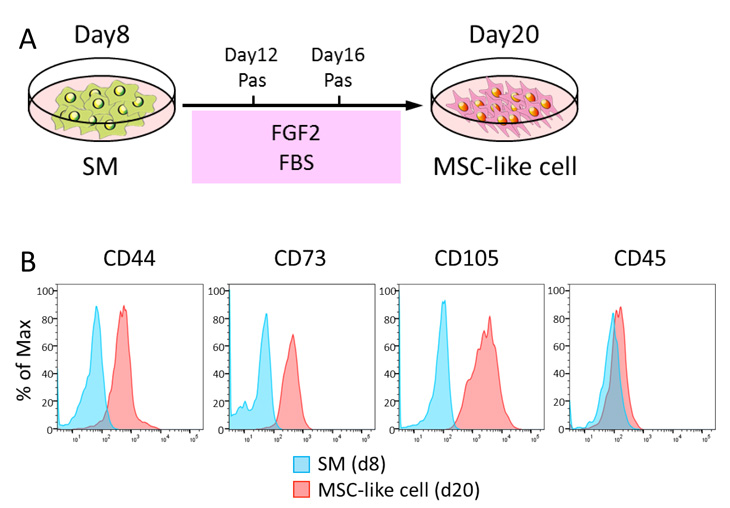
Fig.6 間葉系間質細胞様細胞への分化誘導
A. 誘導条件の模式図。
B. 誘導された細胞は、間葉系間質細胞のマーカーであるCD44, CD73, CD105が陽性である。
6. FOP-iPS細胞由来の間葉系間質細胞様細胞では軟骨形成が促進されるが、FOP-iPS細胞由来の硬節細胞では促進されない
上述より、研究チームはさらに体節細胞からそれぞれ硬節細胞、間葉系間質細胞様細胞を介して軟骨細胞を誘導することに成功しました(Fig. 7A)。この方法をFOP患者さん由来iPS細胞(FOP-iPS細胞)に適用し、硬節細胞および間葉系間質細胞様細胞を誘導した後、ACVR1注22の刺激因子であるアクチビンA注23を添加した軟骨形成培地で二次元軟骨分化を行いました。すると、アクチビンAで刺激されたFOP患者さん由来の間葉系間質細胞様細胞のみで軟骨誘導が亢進し(Fig. 7B, C)、硬節細胞では違いがありませんでした(Fig. 7D, E)。FOP患者さんでは硬節細胞由来の胎児性骨軟骨形成には大きな異常がないとされております。以上のこ
とから、本研究結果はFOP患者さんで見られる異所性の骨軟骨形成と、硬節細胞由来の正常な胎児性骨軟骨形成を再現していると考えられます。また、異所性骨化の強力な阻害剤であるR667(レチノイン酸受容体γアゴニスト)およびmTORシグナル注24阻害剤ラパマイシンにより、軟骨形成の亢進が抑えられました。これらの結果より、今回開発した分化誘導法が疾患解析にも有効であることが分かりました。
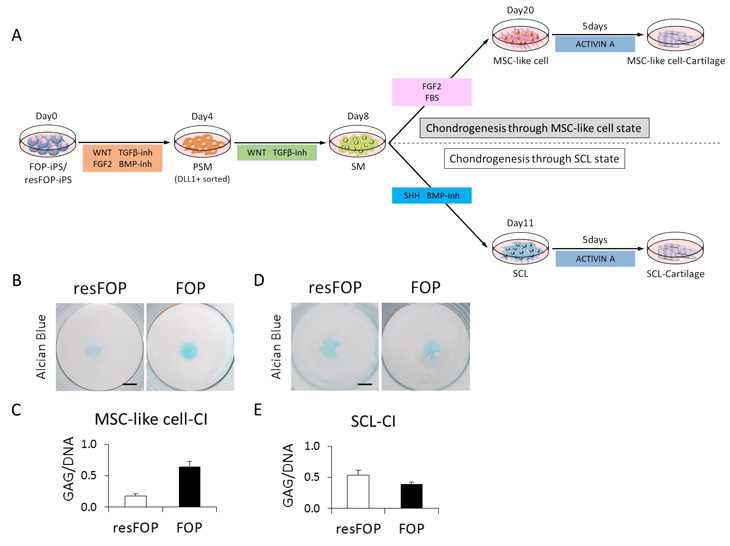
Fig.7 今回の誘導法を用いたFOPのモデル化
A. 誘導条件の模式図。FOP-iPS細胞とresFOP-iPS細胞注25それぞれから、胎児性軟骨のもととなる硬節細胞と、同じ体節細胞に由来する間葉系間質細胞様細胞を誘導した。
B. 間葉系間質細胞を経由して誘導した軟骨細胞では、FOP細胞で軟骨形成の亢進が観察される。
C. 軟骨化の指標である細胞外マトリックスであるグリコサミノグリカン(GAG)量を、細胞数の指標であるDNA量で割った値。FOP細胞で軟骨形成の亢進が観察される。
D. 硬節細胞を介して誘導した軟骨細胞では、FOP細胞で軟骨形成の亢進が観察されない。
E. GAG量をDNA量で割った値。FOP細胞では軟骨形成の亢進が観察されない。
4. まとめ 今回の成果により、ヒトiPS細胞から体節細胞を経て骨格筋細胞、軟骨細胞、腱靭帯細胞、真皮細胞、間葉系間質細胞様細胞へと分化誘導する方法を確立しました。また、この分化誘導法で得られた細胞に対しても、FOPの進行阻害候補薬ラパマイシンの効果が確認されました。
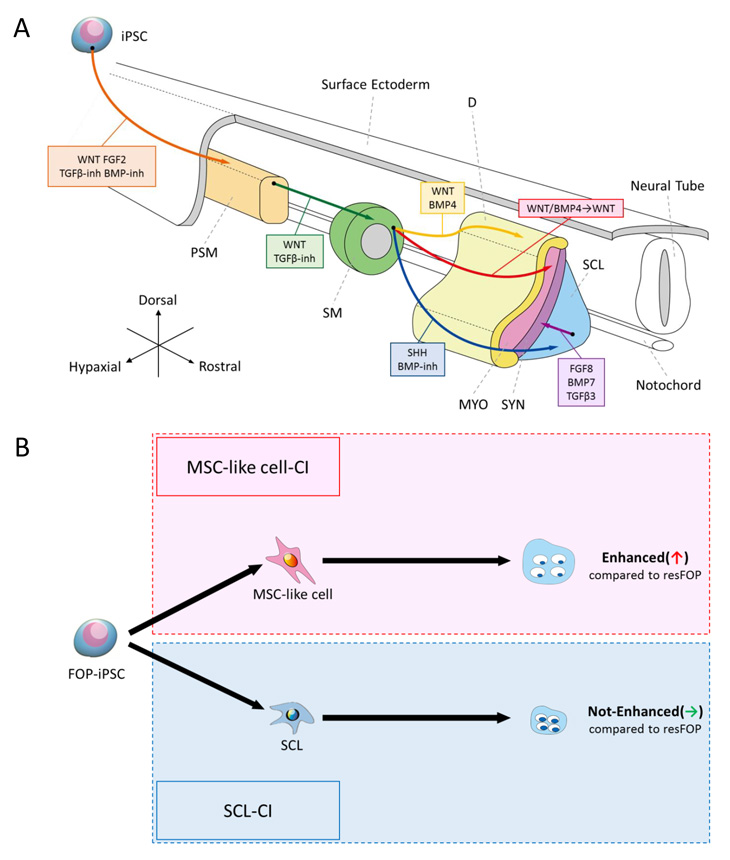
Fig.8 今回の論文のまとめ
A. 発生期におけるシグナル環境を模倣することで、沿軸中胚葉派生細胞の誘導に成功した。
B. 今回開発した分化誘導法をFOP-iPS細胞に適用することで、FOP病態のモデル化に成功した。間葉系間質細胞様細胞を介して作製した軟骨細胞では軟骨形成の亢進が観察されたが、硬節細胞を介して作製した軟骨細胞では軟骨形成の亢進が観察されなかった。
5. 論文名と著者
- 論文名
“Modeling human somite development and fibrodysplasia ossificans progressiva with induced pluripotent stem cells” - ジャーナル名
Development - 著者
Taiki Nakajima1, Mitsuaki Shibata1, Megumi Nishio2, Sanae Nagata1, Cantas Alev1, Hidetoshi Sakurai1, Junya Toguchida1,2,3,, Makoto Ikeya1 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学 ウイルス・再生医科学研究所
- 京都大学大学院医学研究科
6. 本研究への支援本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興機構 科学研究費補助金
- JST/AMED 「疾患特異的iPS細胞を活用した難病研究」
- JST/AMED 「iPS細胞研究中核拠点」
- AMED 「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」
- iPS細胞研究基金
注1) シグナル環境
細胞外に分泌される成長因子などによって構成され、細胞の分化や移動などを制御する環境のこと。今回の研究では、TGFβ注7シグナル、WNTシグナル注12、BMP注8シグナル、FGF注13シグナル、SHHシグナル注20などを制御することで、生体内のシグナル環境を再現している。注2) 体節細胞(Somite; SM)
中胚葉注3細胞の一種。発生期に一時的に形成される構造体。骨格筋細胞、骨軟骨細胞、真皮細胞、腱靭帯細胞の発生学上の起源細胞である。注3) 中胚葉
受精後の胚からできる細胞の塊は、内胚葉、中胚葉、外胚葉に分けられる。中胚葉は骨、心筋、赤血球などに分化する。注4) 間葉系間質細胞(Mesenchymal Stromal Cells; MSC)
成体の骨髄や脂肪組織に存在し、骨細胞、軟骨細胞、脂肪細胞などといった間葉系の細胞に分化する能力を持った間質(結合組織)の細胞。発生学的には、側板中胚葉注9および神経堤細胞注21を経由して間葉系間質細胞へと分化することが知られている。注5) 進行性骨化性線維異形成症(Fibrodysplasia Ossificans Progressiva; FOP)
筋肉や腱、靭帯などの軟部組織の中に異所性骨とよばれる骨組織ができてしまう病気。200万人に1人程度の割合、国内には約80名の患者さんがいると言われている希少難病の一つ。これまでの研究により、この病気は骨形成を司る増殖因子であるBMP受容体の1つであるACVR1注22遺伝子に突然変異が生じて変異型ACVR1へと変化することが原因であることがわかっている。注6) ラパマイシン
移植臓器に対する免疫拒絶を防ぐためなどに使われている薬。免疫抑制機能を持っている。細胞内ではmTOR注24の活性を阻害する効果がある。
注7) トランスフォーミング増殖因子β(Transforming Growth Factor β; TGFβ)
TGFβスーパーファミリー注26に属するタンパク質で、細胞増殖や分化など多くの生理機能を調節する作用を持つ。
注8) 骨形成タンパク質(Bone Morphogenetic Protein; BMP)
骨組織や軟骨組織の分化を誘導、促進するタンパク質。TGF-βスーパーファミリーに属する。
注9) 側板中胚葉
中胚葉細胞の一種。胚の最も側方に形成され、四肢の骨格や腹膜、心臓、血管、血球、内臓筋などに分化する。
注10) 沿軸中胚葉
神経管の両側に形成される中胚葉細胞の一種。前体節細胞、体節細胞、体節から派生する細胞(真皮節、筋節、硬節、靭帯節)の総称。
注11) GSK3(グリコーゲン合成酵素キナーゼ-3; glycogen synthasekinase-3)
当初、グリコーゲン合成酵素をリン酸化して不活性化するセリン/スレオニン蛋白質リン酸化酵素として同定されたが、のちにWNTシグナルの構成要素であるβカテニンと複合体を形成してWNTシグナルを負に制御することが分かった。負の制御因子であるため、GSK3の阻害剤はWNTシグナルに対して正に機能する。
注12) WNTシグナル
WNTリガンドが受容体であるFrizzledを介して活性化する細胞内の伝達機構。βカテニンを介して遺伝子発現を活性化するβカテニン経路が最も有名で、古典的WNTシグナル経路とよばれる。
注13) FGF(線維芽細胞増殖因子; Fibroblast growth factor)
成長因子の一種。線維芽細胞の増殖を制御する因子として発見されたが、現在では発生や創傷治癒などを制御することが分かっている。
注14) mTeSR1 (エムテイザー1; modified Tenneille Serum Replacer 1)
ヒトES/iPS細胞をフィーダーフリー注16の条件で培養することを可能にした無血清培地。
注15) マトリゲル
mTeSR1でヒトES/iPS細胞を培養する際に使用するコート剤。Engelbreth-Holm-Swarm (EHS)マウス肉腫から抽出した細胞外マトリクスで、主成分としてラミニン(主成分)、IV型コラーゲン、ヘパリン硫酸プロテオグリカン、エンタクチン/ニドゲンおよび成長因子を含む。
注16) フィーダーフリー
目的の細胞を培養する際、培養条件を整える補助的な役割をもつ細胞のことをフィーダー細胞という。通常は薬剤処理によって分裂できないように処理されている。フィーダーフリーとは、フィーダー細胞を用いないこと。
注17) PAX3の陰性率
PAX3は核内因子であり細胞表面タンパク質ではないため、通常のフローサイトメトリーによる分離は不可能である。今回の実験では、PAX3遺伝子座にGFPを組み込むことで、GFP蛍光によりPAX3遺伝子発現を検出できるように遺伝子操作したPAX3-GFP iPS細胞を用いている。
注18) フローサイトメトリー解析
流動細胞計測法。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を解析することができる。
注19) 細胞外マトリックス
細胞間の隙間を埋める生体高分子(コラーゲンやプロテオグリカンなど)の集合体。骨・軟骨、歯、皮膚などに多く含まれ、組織を支えてメカニカル(クッション・伸び縮みなど)な機能を果たしている。
注20) SHHシグナル
SHHタンパク質が受容体に結合して活性化される細胞内の伝達機構。
注21) 神経堤細胞
胚発生の途中で生じる遊走能をもった幹細胞で、筋骨格系細胞やメラニン細胞、末梢神経系細胞やシュワン細胞などへ分化することができる。
注22) ACVR1 (Activin receptor type-1)
BMP受容体の一部を構成するタンパク質で、BMPと結合することにより骨形成のシグナルを伝達する。アクチビンAと結合はするものの、シグナルを伝えないことが知られていた。FOP患者さんではACVR1遺伝子の変異により、ACVR1タンパク質の206番目のアルギニンがヒスチジンに変化し、アクチビンAと結合することで本来伝えないはずのBMPシグナルを伝えるということが、同研究グループの先行研究で分かっていた。
注23) アクチビンA
TGF-βファミリーに属するタンパク質で、細胞増殖や分化など多くの生理機能を調節する作用を持つ。
注24) mTOR (mechanistic target of rapamycin) シグナル
免疫抑制剤ラパマイシンの標的分子として発見されたタンパク質。ほ乳類などの動物で細胞内シグナル伝達に関与する。活性化するとタンパク質の合成を増加させたり、分解を抑制したり、細胞分裂などの調節に中心的な役割を果たすと考えられている。
注25) resFOP-iPS細胞
FOP患者さん由来iPS細胞(FOP-iPS細胞)内の変異型ACVR1遺伝子を、遺伝子改変により野生型へと修復したiPS細胞。FOP-iPS細胞と遺伝的背景が同一であるため、対照細胞として最適な細胞と考えられる。
注26) TGF-βスーパーファミリー
TGF-β、BMP、アクチビンなど構造上類似した因子で構成される集合体の総称。スーパーファミリーには他に、免疫グロブリンスーパーファミリー、核ホルモン受容体スーパーファミリーなどが存在する。