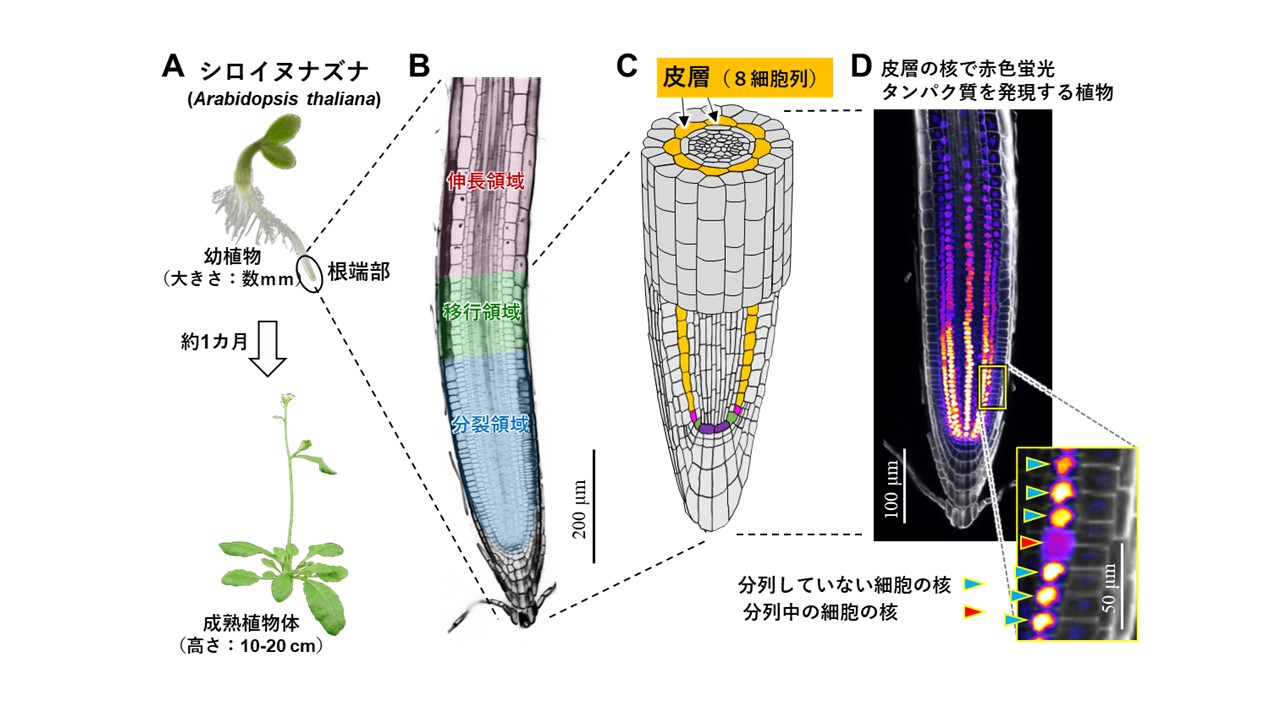
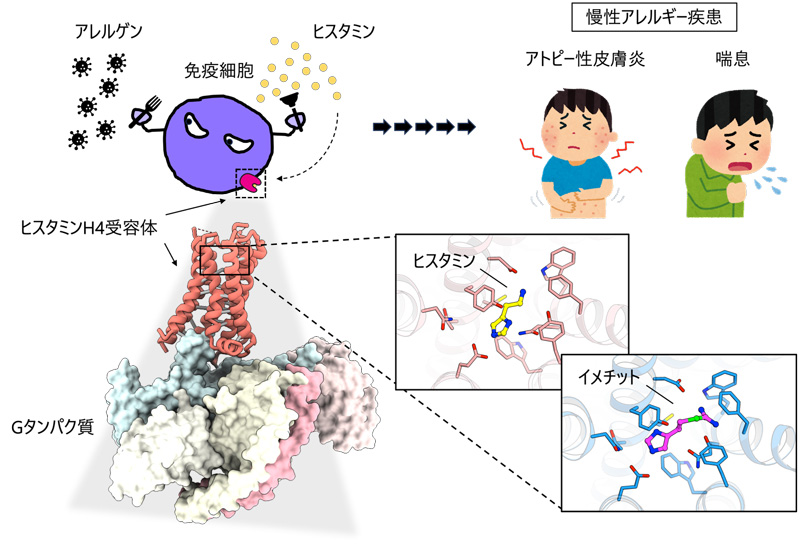
2023-10-20 東京大学
発表のポイント
◆ 医薬品合成で広く用いられるグリニャール反応について、メカニズムが未知の不純物生成を精度良く記述できる新しい数理モデルを構築しました。
◆ 物質・熱収支に基づく物理モデルと、不純物生成を表すAI・機械学習モデルのハイブリッド化により、目的化合物と不純物の生成を同時にシミュレーション可能にしました。
◆ 本研究成果は、デジタル空間での条件探索を可能にし、試行錯誤実験に頼らないプロセス開発、さらには新薬の迅速かつ効率的な上市に貢献します。
フロー実験とハイブリッドモデルのイメージ(発表論文から抜粋)
発表概要
東京大学大学院工学系研究科化学システム工学専攻の杉山弘和教授と金俊佑特任研究員らによる研究グループは、ファーミラ株式会社・シオノギファーマ株式会社との共同研究により、医薬品合成で広く用いられるグリニャール反応(注1)について、メカニズムが未知の不純物生成を精度良く記述できる新しい数理モデルを構築しました。グリニャール反応は、120年以上に渡って活用されてきましたが、未だに不純物の生成機構が解明されていません。そのため、現象論に基づく物理モデル(注2)による記述が困難で、デジタル技術を活用したプロセス設計が制限されていました。本研究では、図1のように物質・熱収支に基づく物理モデルと、不純物生成を表すAI・機械学習モデル(注3)を融合させたハイブリッドモデル(注4)を開発することで、生成物と不純物の定量的評価を可能にしました。必ずしも機構が明らかでない対象を、データとAIの力を利用して記述し、シミュレーション可能にしたことが本研究の価値です。シミュレーションによるデジタル空間での条件探索は、試行錯誤的な実験に頼らないプロセス開発、さらには開発時間とコストの削減を通した新薬の迅速かつ効率的な上市に貢献します。

図1:フロー実験とハイブリッドモデルのイメージ(発表論文から抜粋)
左の明るい領域が物理モデルを用いた生成物の計算、右の暗い領域が機械学習モデルを駆使した不純物の計算に、それぞれ対応している。
発表内容
〈研究の背景〉
抗生物質などで知られる低分子医薬品(注5)は、私たちの健康を守るために欠かせない重要な役割を果たしています。低分子医薬品は化学合成によって製造され、目的化合物を得るためにさまざまな反応が用いられます。その中でも、グリニャール反応は炭素–炭素結合を形成するための強力な手段として広く活用されてきました。この反応では、グリニャール試薬と呼ばれる有機マグネシウム化合物が原料と反応することで目的化合物が得られます。しかし、この過程で生成機構の未知な不純物が生成するという問題がありました。そのため、現象論に基づく物理モデルのみで記述することは困難で、デジタル技術を活用したプロセス設計が制限されていました。
〈研究の内容〉
本研究では、この問題を解決すべく、対象であるグリニャール反応についてフロー法(注6)を用いた実験を行い(図2)、新たな数理モデルの構築を試みました。従来の医薬品合成は、すべての原料を一度に反応器に投入し、反応が終了した後に生成物を取り出すバッチ法(注7)が主流でした。これに対して、フロー法は、原料を連続的に投入し、生成物を連続的に収集する手法であり、近年医薬品合成の分野で注目を浴びている合成法です。
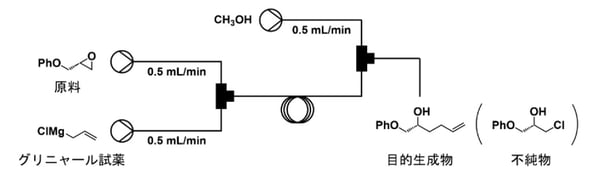
図2:フロー実験の概要(発表論文から抜粋・翻訳)
本研究では、フロー法を用いた実験を行い、濃度、温度、管径、滞留時間を変えた108個の条件でデータを収集しました(図2)。この実験データを基にハイブリッドモデルを構築することで、対象のグリニャール反応を仮想空間で再現しました(図3)。ハイブリッドモデルは、物理モデルとAI・機械学習モデルで構成されます。物理モデルに関しては、目的化合物に関する既知の生成機構をもとに、物質・熱収支モデルを構築しました。
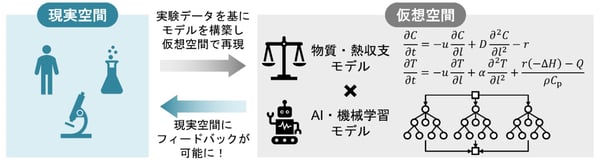
図3:ハイブリッドモデルの概要とその役割
このモデルを用いたシミュレーションでは、図4に示すように、実験で観測された原料と目的化合物の濃度変化を精度高く再現することができました。一方、不純物の生成に関しては機構が分からないため、同様のアプローチを取ることはできません。
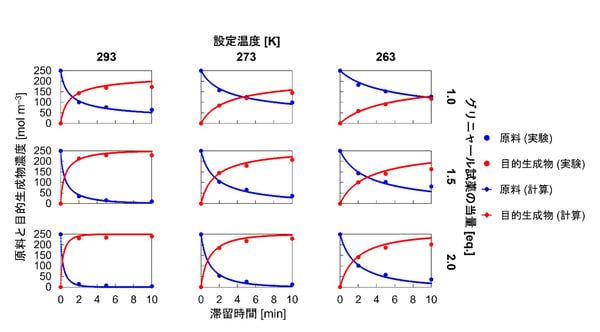
図4:物理モデルを用いた生成物の計算結果の一例(発表論文から抜粋・翻訳)
そこで、不純物生成を表すためにAI・機械学習モデルを用いた検討を行いました。実験で観測された不純物生成は、条件によって異なる傾向を示します(図5)。例えば、高温でグリニャール試薬の当量が少ない条件(図5の左上)では、不純物濃度は単調増加する一方で、低温でグリニャール試薬の当量が多い条件(図5の右下)では、不純物濃度は増加・減少傾向を示します。そこで、条件によって異なる挙動を示す系に適しているランダムフォレスト回帰モデル(注8)を用いた検討を行いました。その結果、図5のように、全ての条件において不純物の生成を精度良く再現できました。データとAIの力を利用した本研究のアプローチは、メカニズムが未知な反応に対しても、シミュレーションとデジタル空間での探索を可能にする、新しい仕組みとして位置づけられます。
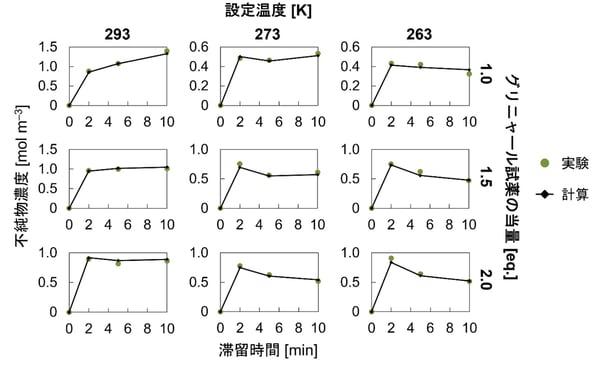
図5:機械学習モデルを用いた不純物の計算結果の一例(発表論文から抜粋・翻訳)
〈今後の展望〉
本研究では、医薬品合成で広く用いられるグリニャール反応について、メカニズムが未知の不純物生成を精度良く記述できる新しい数理モデルを構築しました。今後は、本モデルを用いた最適条件のシミュレーション探索や、他の反応系への展開を進め、AI・デジタル技術を活用した医薬品プロセス開発の姿を探求していきます。
研究チームの構成
東京大学大学院工学系研究科 化学システム工学専攻
金 俊佑(特任研究員)
林 勇佑(助教)
バドラ サラ(准教授)
杉山 弘和(教授)
ファーミラ株式会社
岡本 和也(技術開発1グループ課長補佐)
箱木 敏和(技術開発1グループ長)
古川 晴雄(技術開発2グループ長)
シオノギファーマ株式会社
吉川 覚(先進技術部 連続生産技術部門 課長)
中西 勇夫(先進技術部 ワクチン技術部門 部門長)
論文情報
〈雑誌〉Industrial & Engineering Chemistry Research
〈題名〉Hybrid Modeling of an Active Pharmaceutical Ingredient Flow Synthesis in a Ring-Opening Reaction of an Epoxide with a Grignard Reagent
〈著者〉Junu Kim*, Yusuke Hayashi, Sara Badr, Kazuya Okamoto, Toshikazu Hakogi, Haruo Furukawa, Satoshi Yoshikawa, Hayao Nakanishi, Hirokazu Sugiyama*
研究助成
本研究は、ファーミラ株式会社・シオノギファーマ株式会社と東京大学の共同研究として実施されました。
用語解説
(注1)グリニャール反応:ハロゲン化合物に金属マグネシウムを作用させて得られるグリニャール試薬を用いた、新しい炭素–炭素結合を形成する反応である。この反応を発見したヴィクトル・グリニャールは、この業績によって、1912年にノーベル化学賞を受賞した。
(注2)物理モデル:物理・化学的原理に基づいて記述される数理モデルを指す。これらのモデルは一般的に微分方程式を用いて表現され、対象の挙動を十分に理解している場合には、高い信頼性と優れた外挿性を持つ。ただし、対象の理解が不十分な場合、物理モデルの構築自体が難しくなることがある。
(注3)AI・機械学習モデル:入力と出力のデータから相関関係を導き出し、入力に対して出力を予測するためのモデルを指す。現象の理解がなくても容易にモデルを構築し活用できるという利点がある。良質なモデルを構築するためには、十分なデータ量が必要である。
(注4)ハイブリッドモデル:物理モデルと機械学習モデルを組み合わせたモデルを指す。
(注5)低分子医薬品:化学反応で合成・製造される医薬品を指す。通常、これらの医薬品の分子量は500以下であり、バイオ医薬品のように、数万~数十万に及ぶものと比較して小さいため、低分子と呼ばれる。
(注6)フロー法:原料を細い反応器に流しながら連続的に反応を行う手法である。この方法では、原料を連続的に反応器に供給すると同時に、反応器の出口から生成物を得る。バッチ法に比べて、収率の向上や、コストの削減、廃棄物の減少、安全性の向上などの利点があるとされ、特に医薬品の合成法として注目を集めている。
(注7)バッチ法:原料を一度に反応容器に投入して、その中で反応を進行させ、一定の時間が経過した後に、生成物を取り出す合成手法である。実験室でのフラスコ反応もこれに当てはまる。
(注8)ランダムフォレスト回帰モデル:データ解析や機械学習の分野で用いられるモデルで、決定木と呼ばれる「はい/いいえ」の質問でデータを分類して予測する仕組みを使用する。これらの決定木を複数組み合わせて、数値の予測を行う。
プレスリリース本文:PDFファイル
Industrial & Engineering Chemistry Research:https://pubs.acs.org/doi/10.1021/acs.iecr.3c02137