2023-11-29 理化学研究所
理化学研究所(理研)生命医科学研究センター 組織動態研究チームの髙橋 苑子 研究員、落合 惣太郎 基礎科学特別研究員(研究当時、現 客員研究員)、岡田 峰陽 チームリーダーらを中心とした共同研究グループは、皮膚炎に伴うかゆみの伝達に、感覚神経における転写因子[1]STAT3[2]の活性化が重要な役割を果たしていることを発見しました。
本研究成果は、アトピー性皮膚炎などのかゆみに対する新たな治療法の開発に貢献すると期待されます。
今回、共同研究グループは、アトピー性皮膚炎のかゆみに深く関わるサイトカイン[3]IL-31[4]が、感覚神経に発現する受容体に作用することで、かゆみを引き起こしていることを実証しました。また、IL-31受容体の下流で、転写因子STAT3が活性化されることが、かゆみ誘導に重要であることを示しました。さらに、感覚神経のSTAT3は、実はIL-31受容体の発現や、かゆみ伝達に関わる神経ペプチド[5]の発現にも重要であることも見いだしました。感覚神経のSTAT3は、IL-31依存的なかゆみだけでなく、IL-31非依存的な炎症性のかゆみにも重要であることも示唆されました。これらの結果から、STAT3の阻害薬が開発・改良されれば、新たなかゆみの治療薬となる可能性が示されました。
本研究は、科学雑誌『Cell Reports』オンライン版(11月28日付:日本時間11月29日)に掲載されました。
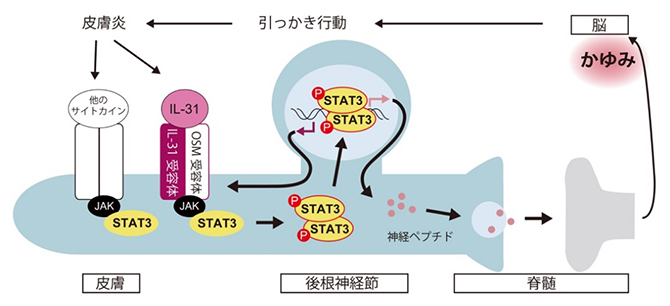
かゆみを伝達する感覚神経細胞におけるSTAT3の役割
背景
QOL(Quality of Life:生活の質)を損なうアトピー性皮膚炎などの炎症とかゆみに、免疫細胞などから分泌されるサイトカインと呼ばれるタンパク質群の一部が、重要な役割を果たしていることが、近年、明らかとなってきました。実際、IL-4やIL-13と呼ばれるサイトカインが作用する受容体に対する抗体や、サイトカインの受容体直下で働くJAK[6]と呼ばれる細胞内シグナル伝達タンパク質に対する小分子阻害薬[7]が、アトピー性皮膚炎の治療に、海外や国内において広く用いられるようになりました。別のサイトカインIL-31の受容体に対する抗体も、アトピー性皮膚炎などのかゆみを効果的に抑えることが示され、2022年に、アトピー性皮膚炎のかゆみの治療における使用が、世界に先駆けて国内で承認されました。
従来、サイトカインは、免疫細胞や上皮細胞[8]などが発現する受容体に作用して働くことが知られていました。ところが近年になり、かゆみの誘導においては、上記のサイトカインは、感覚神経が発現する受容体に作用している可能性が注目されていました。特にIL-31の受容体は、一部の感覚神経に特徴的に強く発現していることが明らかとなり、IL-31は感覚神経に直接作用してかゆみを誘導している可能性が指摘されていました。しかし、この仮説は実証されておらず、皮膚の角化細胞[9]にIL-31が作用することで、別のかゆみ誘導物質が産生されることにより、かゆみが誘導されるという報告もありました。一部の感覚神経がIL-31受容体を発現するメカニズムや、IL-31受容体とJAKの下流で、どのような分子が働くことでかゆみを誘導しているかは明らかではありませんでした。
そこで共同研究グループは、IL-31の感覚神経と角化細胞のどちらへの作用が、かゆみを誘導しているかを明らかにし、IL-31受容体の発現メカニズムや、IL-31受容体下流のかゆみ誘導メカニズムを解明することを目指しました。
研究手法と成果
共同研究グループは、IL-31の感覚神経への直接作用がかゆみを誘導しているかどうかを調べるために、感覚神経においてのみ、IL-31受容体の遺伝子が欠損するマウスを、遺伝子改変技術を用いて作製しました。このマウスの後根神経節[10]や皮膚を解析したところ、たしかに感覚神経のIL-31受容体の発現は消失していました(図1)。IL-31受容体が欠損していないコントロールマウスにIL-31を皮下投与すると、強い引っかき行動が引き起こされますが、感覚神経のIL-31受容体が欠損したマウスでは、IL-31投与による引っかき行動の増加が全く見られませんでした(図2)。つまり、感覚神経のIL-31受容体がなくなったことで、IL-31によるかゆみが消失したと考えられます。一方、角化細胞においてのみ、IL-31受容体の発現が欠損するマウスを作製し、同様の実験を行ったところ、IL-31投与による引っかき行動はコントロールマウスと同程度引き起こされました(図2)。
以上の実験結果から、IL-31は感覚神経に直接作用して、かゆみを誘導していることが初めて実証されました。一方、IL-31の角化細胞への作用は、少なくとも皮膚炎が起きていないマウスにおいては、かゆみ誘導にほとんど寄与していないことが示唆されました。
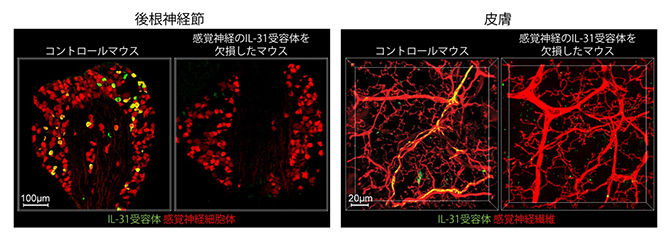
図1 IL-31受容体を発現する感覚神経細胞とそれらが皮膚に伸ばした神経線維
IL-31受容体を欠損していないマウス(コントロールマウス)と、感覚神経においてのみIL-31受容体を欠損させたマウスから、後根神経節の切片(左画像)と皮膚組織サンプル(右画像)を作製し、IL-31受容体(緑)および感覚神経(赤)をそれぞれに対する特異的な抗体を用いて染色し、顕微鏡観察した像。IL-31受容体と感覚神経が重なった部分は黄色に見えている。
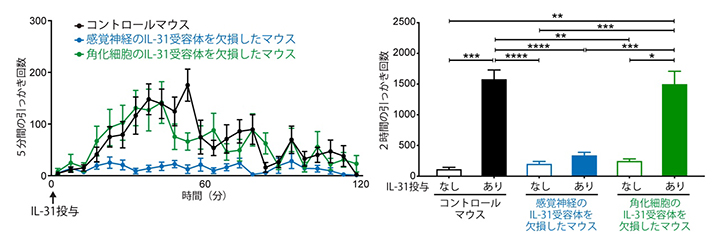
図2 IL-31が誘導するかゆみにおける感覚神経に発現するIL-31受容体の重要性
IL-31受容体を欠損していないマウス(コントロールマウス)、感覚神経においてのみIL-31受容体を欠損したマウス、角化細胞においてのみIL-31受容体を欠損したマウスに、IL-31を皮下投与し、その直後から5分ごとの引っかき回数(左グラフ)と2時間の引っかき回数(右グラフ)を示す。
次に、感覚神経のIL-31受容体とJAKの下流で、どのような分子がかゆみ誘導に関わっているかを調べました。多くの場合、サイトカインシグナルにおいては、JAKによって、STATファミリーと呼ばれるタンパク質が活性化され、細胞核の中へと移行し、遺伝子発現を促す転写因子として働くことが知られています。共同研究グループは、感覚神経においてはSTATファミリーの中でSTAT3が多く発現していることを見いだしました。しかしながら、別の研究者らによる以前の研究で、STAT3の活性化はIL-31によるかゆみ誘導には必須ではないと報告されていました注1)。その報告では、全身でSTAT3の活性化がある程度減弱するとされる遺伝子改変マウスを用いて、IL-31投与時のかゆみが減弱しないことを根拠としていました。今回、共同研究グループは、STAT3の活性を感覚神経においてのみ欠損させたマウスを、新たに作製しました。このマウスに、IL-31を皮下投与すると、驚いたことに、IL-31が引き起こす引っかき行動は全く観察されませんでした(図3上段)。つまり、感覚神経のSTAT3は、IL-31によるかゆみ誘導に必須であることが分かりました。
共同研究グループは、感覚神経のSTAT3が、IL-31受容体下流のかゆみ誘導シグナル伝達に関わっている可能性を考えました。まず、STAT3欠損により感覚神経のかゆみ関連分子の発現が変化していないかを調べたところ、IL-31受容体の発現が減弱しているという予期せぬ結果を得ました(図3下段)。加えて、かゆみ伝達に関わるという報告のある、神経ペプチドの遺伝子の発現も低下していました。それら以外のかゆみ関連分子の発現低下は、調べた限りでは認められませんでした。つまり、一部の感覚神経がIL-31受容体を発現するメカニズムに、STAT3が深く関わっていることが明らかになりました。
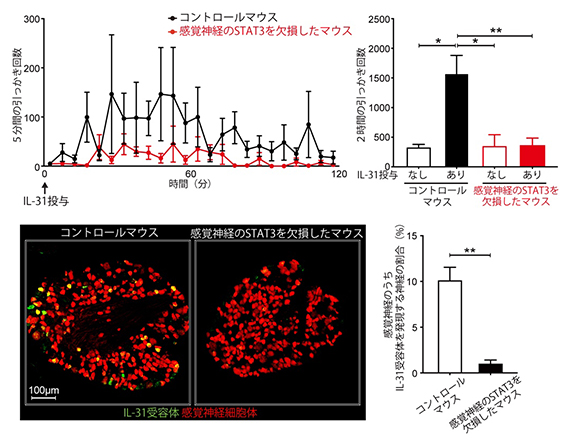
図3 IL-31が誘導するかゆみにおける感覚神経のSTAT3の重要性
上段には、STAT3を欠損していないマウス(コントロールマウス)と、感覚神経においてのみSTAT3を欠損させたマウスに、IL-31を皮下投与し、その直後から5分ごとの引っかき回数(左グラフ)と2時間の引っかき回数(右グラフ)を示す。下段画像は、コントロールマウスと、感覚神経においてのみSTAT3を欠損したマウスから、後根神経節の切片を作製し、IL-31受容体(緑)および感覚神経(赤)をそれぞれに対し特異的な抗体を用いて染色したもの。下段グラフは、後根神経節切片染色像の解析を基に、IL-31受容体を発現する感覚神経細胞の割合を定量した。
上記のように、遺伝子改変によって、感覚神経のSTAT3をマウスの発生途中から欠損させてしまうと、IL-31受容体の発現を低下させることが分かりました。しかし、感覚神経のSTAT3が、IL-31受容体下流のかゆみ誘導シグナル伝達に関わっているかどうかは、解析できませんでした。そこで共同研究グループは、STAT3活性化に対する小分子阻害剤を、野生型マウスに投与することが、IL-31が誘導するかゆみに影響するかを調べました。その結果、阻害剤投与により、IL-31による感覚神経のSTAT3活性化が減弱し、IL-31が惹起する引っかき行動が、消失はしないものの有意に減弱しました(図4)。一方、阻害剤投与によるIL-31受容体の発現低下は確認されませんでした(図4)。以上のことから、STAT3はIL-31受容体下流のかゆみ誘導シグナル伝達に関わっていることが示唆されました。
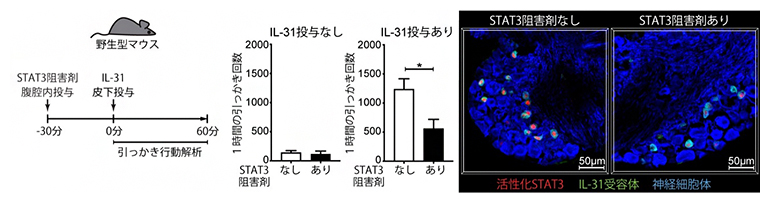
図4 STAT阻害剤投与によるIL-31が誘導するかゆみの減弱
左側模式図のように、野生型マウスに、STAT3阻害剤を腹腔内投与し、その30分後にIL-31を皮下投与して、その後1時間の引っかき回数を解析した。グラフに示すように、IL-31投与をしていない状態の引っかき回数は、STAT3阻害剤投与により変化しなかったが、IL-31を投与してから1時間の引っかき回数は減少した。画像は、IL-31を皮下投与してから15分後の後根神経節の切片の染色画像で、IL-31受容体(緑)を発現した感覚神経(青)の細胞核における活性化STAT3(赤)の蓄積が、STAT3阻害剤投与により減弱している様子が示されている。
共同研究グループは、皮膚炎が起きていないマウスにIL-31を投与したときのかゆみだけでなく、皮膚炎が起こっている状態のマウスのかゆみについても解析を行いました。アトピー性皮膚炎に似た2型炎症[11]を起こす皮膚炎モデルを、角化細胞においてのみIL-31受容体を欠損させたマウスに適用したところ、皮膚炎に伴う引っかき行動は、コントロールマウスと同程度観察され、この皮膚炎モデルにおいても、角化細胞のIL-31受容体の重要性は確認できませんでした。
しかしながら、感覚神経においてのみIL-31受容体を欠損させたマウスに適用したところ、皮膚炎に伴う引っかき行動が減弱することが分かりました。この減弱は有意ではあるものの、引っかき行動はまだ残っていました(図5)。よって、この皮膚炎モデルにおけるかゆみ誘導においても、感覚神経のIL-31受容体の関与が認められたものの、感覚神経のIL-31受容体が関与しないかゆみも存在することが示唆されました。一方、感覚神経においてのみSTAT3を欠損させたマウスに、この皮膚炎モデルを適用したところ、引っかき行動が強く抑制されていました(図5)。よって、感覚神経のSTAT3は、皮膚炎においてIL-31が誘導するかゆみだけでなく、他のかゆみにも重要な役割を果たしていることが示唆されました。
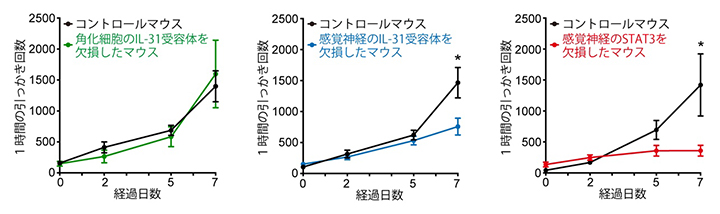
図5 皮膚炎に伴うかゆみにおける感覚神経のIL-31受容体とSTAT3の寄与
MC903と呼ばれるビタミンD類似体を含むエタノールを、マウス耳介皮膚に0~7日目まで1日1回毎日塗布し、炎症を誘導した。0日目、2日目、5日目、7日目に1時間ずつ、引っかき回数の解析を行った結果を示す。
注1)Xu et al., The Cytokine TGF-β Induces Interleukin-31 Expression from Dermal Dendritic Cells to Activate Sensory Neurons and Stimulate Wound Itching, Immunity 2020. DOI: 10.1016/j.immuni.2020.06.023
今後の期待
今回の研究で、IL-31が感覚神経に直接作用してかゆみを誘導していることが実証されました。この実証結果から、アトピー性皮膚炎におけるIL-31受容体に対する抗体療法の、有効性と安全性を高めるための戦略を、より理論的に考えられるようになります。例えば、現状のような抗体の全身投与ではなく、感覚神経の細胞体が存在する神経節へ抗体を効率的に送達することができるようになれば、より少ない投与量でかゆみを抑えられるかもしれません。
感覚神経のSTAT3が炎症性のかゆみに重要な役割を持つことが示されたことにより、STAT3の小分子阻害薬のさらなる開発の必要性が指摘できます。今回マウスに用いた小分子阻害剤は、生体内における効果の程度と持続時間に改善の余地があるといえます。ヒトにおいてSTAT3を特異的・持続的に阻害する効果の高い小分子阻害薬が開発されれば、サイトカイン受容体に対する抗体と比べて、より多くの症例に有効で、かつ比較的安価な治療が可能となるかもしれません。STAT3上流のJAKに対する小分子阻害薬は、多くの症例で効果があり、抗体と比べて安価な治療薬である一方、免疫に大きく影響してしまうなどの副作用の懸念があります。STAT3阻害にも、副作用の懸念はもちろん存在しますが、JAKの下流で働く多くのシグナル伝達経路の一部のみを阻害するため、JAK阻害に比べて副作用が低減する可能性があります。
補足説明
1.転写因子
細胞核の中で遺伝子発現を調節するタンパク質の総称。
2.STAT3
さまざまなサイトカインシグナルにより活性化されるSTATファミリータンパク質の一つ。活性化される前は細胞質に存在し、活性化すると細胞核の中に移行して、さまざまな遺伝子の発現を促す。免疫細胞、上皮細胞、線維芽細胞などにおいて働き、免疫・炎症において重要な役割を果たすことが知られていたが、感覚神経細胞における役割は知られていなかった。
3.サイトカイン
免疫細胞などが分泌して、さまざまな細胞に作用して、細胞機能を調節するシグナルを伝えるタンパク質の総称。
4.IL-31
かゆみを誘導することが知られるサイトカイン。アトピー性皮膚炎などにおいて、免疫細胞などが産生すると考えられている。
5.神経ペプチド
神経細胞から分泌されるペプチドで、別の神経や、他の種類の細胞にシグナルを伝達する。一般に、アミノ酸が数個~数十個つながったものをペプチドと呼び、それよりも多くのアミノ酸がつながったものをタンパク質と呼ぶ。今回、感覚神経において、STAT3依存的に発現することが判明した神経ペプチド遺伝子は、Nppbと呼ばれるものである。Nppb遺伝子から作られるBNPと呼ばれるペプチドは、心不全などにおいて循環器で発現が高まることが知られているものだが、近年、かゆみ伝達にも関わるという報告がされていた。
6.JAK
サイトカインが受容体に結合すると、その直後に活性化する細胞内タンパク質。STAT3を含むSTATファミリータンパク質を活性化することが知られている。しかしながら、感覚神経においては、STATファミリーを介さずに感覚神経を活性化する働きがあるのではないかといわれていた。
7.小分子阻害薬
特定のタンパク質機能を阻害する効果のある分子量の小さい化合物。本稿では、ヒトに用いることが承認されているものを阻害薬、承認されていないものを阻害剤としている。
8.上皮細胞
皮膚、粘膜など外界との境界に存在する細胞。
9.角化細胞
皮膚の上皮細胞であり、複数の層(表皮組織)を形成する。一番内側の層で常にある程度の割合で分裂し、分化しながら外側の層へと移動していく。表皮の最外層では、角化細胞が死ぬことによってできた角層が存在し、外界から体を守るバリア構造の一つとなっている。
10.後根神経節
脊髄の両側に存在する感覚神経の細胞体が集まる組織。ヒトでは31対が脊髄に沿って存在する。細胞体とは、細胞核などの細胞小器官の集中する部分。感覚神経は細胞体から二股に分かれた軸索線維を伸ばし、片方は皮膚などのさまざまな組織へ、もう片方は脊髄神経へと投射して、さまざまな組織から中枢神経系へのシグナルを伝えている。
11.2型炎症
寄生虫感染に対する免疫応答において重要なIL-4やIL-13などのサイトカインが産生される炎症。生体防御反応として重要である一方、アレルギー性疾患の主因ともなっている。
共同研究グループ
理化学研究所
生命医科学研究センター
組織動態研究チーム
研究員 髙橋 苑子(タカハシ・ソノコ)
基礎科学特別研究員(研究当時)落合 惣太郎(オチアイ・ソウタロウ)
(現 客員研究員)
テクニカルスタッフⅠ 高橋 典子(タカハシ・ノリコ)
大学院生リサーチ・アソシエイト 豊島 進(トシマ・ススム)
上級研究員(研究当時)石亀 晴道(イシガメ・ハルミチ)
(現 客員主管研究員)
チームリーダー 岡田 峰陽(オカダ・タカハル)
サイトカイン制御研究チーム
チームリーダー 久保 允人(クボ・マサト)
(東京理科大学 生命医科学研究所 分子病態研究部門 教授)
生命機能科学研究センター
細胞システム動態予測研究チーム
上級研究員(研究当時)金 坚石(ジン・ジャンシ、Jin Jianshi)
チームリーダー 城口 克之(シログチ・カツユキ)
京都大学 大学院医学研究科 皮膚科学
教授 椛島 健治(カバシマ・ケンジ)
かずさDNA研究所 オミックス医科学研究室
主任研究員 中山 学(ナカヤマ・マナブ)
研究支援
本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「多細胞間相互作用による皮膚バリアの適応・修復機序の解明(研究開発代表者:椛島健治)」、免疫アレルギー疾患等実用化研究事業「アトピー性皮膚炎の慢性掻痒を引き起こす末梢神経変化の解明(研究開発代表者:岡田峰陽)」、創薬等先端技術支援基盤プラットフォーム「疾患モデルマウスの作製とゲノムエンジニアリング技術の開発(補助事業代表者:中山学)」、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究「シンギュラリティ生物学」研究領域における研究課題「シンギュラリティ細胞の内部状態を同定するための細胞操作&遺伝子発現解析法の開発(研究代表者:城口克之)」などによる助成を受けて行われました。
原論文情報
Sonoko Takahashi, Sotaro Ochiai, Jianshi Jin, Noriko Takahashi, Susumu Toshima, Harumichi Ishigame, Kenji Kabashima, Masato Kubo, Manabu Nakayama, Katsuyuki Shiroguchi, and Takaharu Okada, “Sensory neuronal STAT3 is critical for IL-31 receptor expression and inflammatory itch”, Cell Reports, 10.1016/j.celrep.2023.113433
発表者
理化学研究所
生命医科学研究センター 組織動態研究チーム
チームリーダー 岡田 峰陽(オカダ・タカハル)
研究員 髙橋 苑子(タカハシ・ソノコ)
基礎科学特別研究員(研究当時)落合 惣太郎(オチアイ・ソウタロウ)
(現 客員研究員)
報道担当
理化学研究所 広報室 報道担当

