2024-01-29 カリフォルニア大学サンディエゴ校(UCSD)
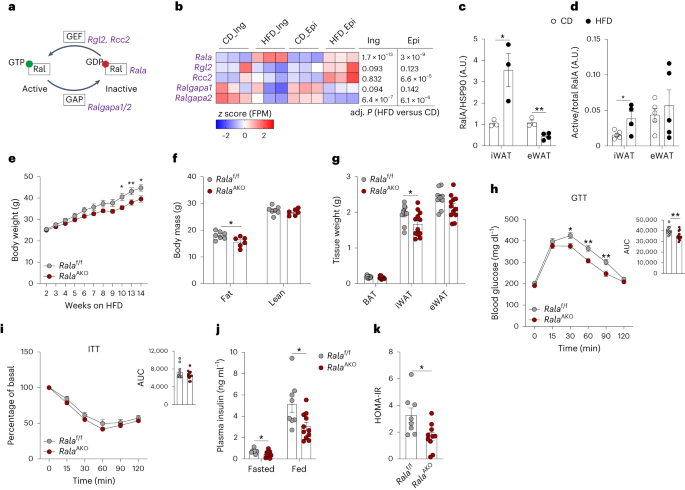
◆この現象は特定の遺伝子によって制御されており、この遺伝子を削除することでマウスは同じ高脂肪ダイエットを摂取しても過剰な体重増加を防ぐことができました。肥満はアメリカの40%以上の成人に影響しており、この研究結果がヒトの肥満にも応用可能かもしれません。
◆研究者は、RaIAと呼ばれる分子の活性化が肥満に関連する代謝の問題を引き起こす可能性があり、この分子に関連する遺伝子を削除することで食事誘発性の体重増加を防ぐことができました。 Saltiel博士は、「このメカニズムを理解することで、新しい治療法の開発に一歩近づいた」と述べています。
<関連情報>
- https://today.ucsd.edu/story/how-obesity-dismantles-our-mitochondria
- https://www.nature.com/articles/s42255-024-00978-0
肥満はRalA活性化による白色脂肪細胞のミトコンドリア断片化と機能不全を引き起こす。 Obesity causes mitochondrial fragmentation and dysfunction in white adipocytes due to RalA activation
Wenmin Xia,Preethi Veeragandham,Yu Cao,Yayun Xu,Torrey E. Rhyne,Jiaxin Qian,Chao-Wei Hung,Peng Zhao,Ying Jones,Hui Gao,Christopher Liddle,Ruth T. Yu,Michael Downes,Ronald M. Evans,Mikael Rydén,Martin Wabitsch,Zichen Wang,Hiroyuki Hakozaki,Johannes Schöneberg,Shannon M. Reilly,Jianfeng Huang & Alan R. Saltiel
Nature Metabolism Published:29 January 2024
DOI:https://doi.org/10.1038/s42255-024-00978-0
Abstract
Mitochondrial dysfunction is a characteristic trait of human and rodent obesity, insulin resistance and fatty liver disease. Here we show that high-fat diet (HFD) feeding causes mitochondrial fragmentation in inguinal white adipocytes from male mice, leading to reduced oxidative capacity by a process dependent on the small GTPase RalA. RalA expression and activity are increased in white adipocytes after HFD. Targeted deletion of RalA in white adipocytes prevents fragmentation of mitochondria and diminishes HFD-induced weight gain by increasing fatty acid oxidation. Mechanistically, RalA increases fission in adipocytes by reversing the inhibitory Ser637 phosphorylation of the fission protein Drp1, leading to more mitochondrial fragmentation. Adipose tissue expression of the human homolog of Drp1, DNM1L, is positively correlated with obesity and insulin resistance. Thus, chronic activation of RalA plays a key role in repressing energy expenditure in obese adipose tissue by shifting the balance of mitochondrial dynamics toward excessive fission, contributing to weight gain and metabolic dysfunction.