2024-02-01 国立精神・神経医療研究センター,東北大学
国立精神・神経医療研究センター(NCNP)神経研究所病態生化学研究部の星野幹雄部長、出羽健一博士(現:理化学研究所脳神経科学研究センター)の研究グループと、東北大学大学院薬学研究科薬理学分野の有村奈利子准教授の研究グループは、ダウン症関連遺伝子産物DSCAMがシナプス内の過剰なグルタミン酸の除去を介して、健全なシナプス機能と神経発達、そして小脳運動学習に関わることを明らかにしました。
脳神経回路のシナプス伝達において、神経伝達物質・グルタミン酸がシナプス間隙に放出されると、余剰量のグルタミン酸は速やかに周辺の細胞へと回収される必要があります。この過程がうまくいかないと、シナプス機能が傷害され、てんかんや精神疾患、あるいは発達障害の原因となります。しかし、この回収に働くグルタミン酸トランスポーターが、いかにしてシナプスに集積し、効率的に余剰グルタミン酸の回収に働くのか、その分子機構は明らかになっていませんでした。
本研究グループは、DSCAMが小脳の神経細胞で発現し、特にプルキンエ細胞が作るシナプスに局在することを見出しました。次に、Dscam遺伝子の機能喪失マウスでは、プルキンエ細胞上に作られるシナプス(平行線維シナプス)において、グルタミン酸の回収が障害されることを見出しました。このシナプスでの余剰グルタミン酸回収には、バーグマングリア(アストロサイトの一種)細胞膜上に存在するグルタミン酸トランスポーターであるGLAST分子が働くことが知られていますが、Dscam機能喪失マウスではGLASTのシナプスへの集積が阻害されていることがわかりました。さらなる解析の結果、プルキンエ細胞膜上のDSCAMタンパク質が、その細胞外領域を介してバーグマングリア細胞膜上のGLASTと結合し、GLASTをシナプス側へ引きつけて集積させるというということが明らかになりました(次ページ模式図)。さらに、DSCAMの機能が失われて余剰グルタミン酸が小脳に溢れるようになると、小脳のシナプス発達も障害され、そのマウスは小脳を使った目の運動学習能力も損なわれることが見出されました。
本研究では、余剰グルタミン酸を回収するアストロサイト細胞膜上のグルタミン酸トランスポーターが、どのようにしてシナプスを認識しそこに集積できるようになるのか、その分子機構を世界で初めて明らかにしました。DSCAMはダウン症の精神神経症状や、さまざまな精神疾患に関与すると言われています。本研究によって、「DSCAM遺伝子に関連する精神・神経疾患の病態の背後には、余剰グルタミン酸の制御異常がある」という可能性が、世界で初めて示唆されました。
この研究成果は、日本時間2024年2月1日 午後7時(報道解禁日時:英国ロンドン時間2月1日午前10時)に科学雑誌「ネイチャー・コミュニケーションズ(Nature Communications)」にオンラインに掲載されました。
今回の発見の概略図
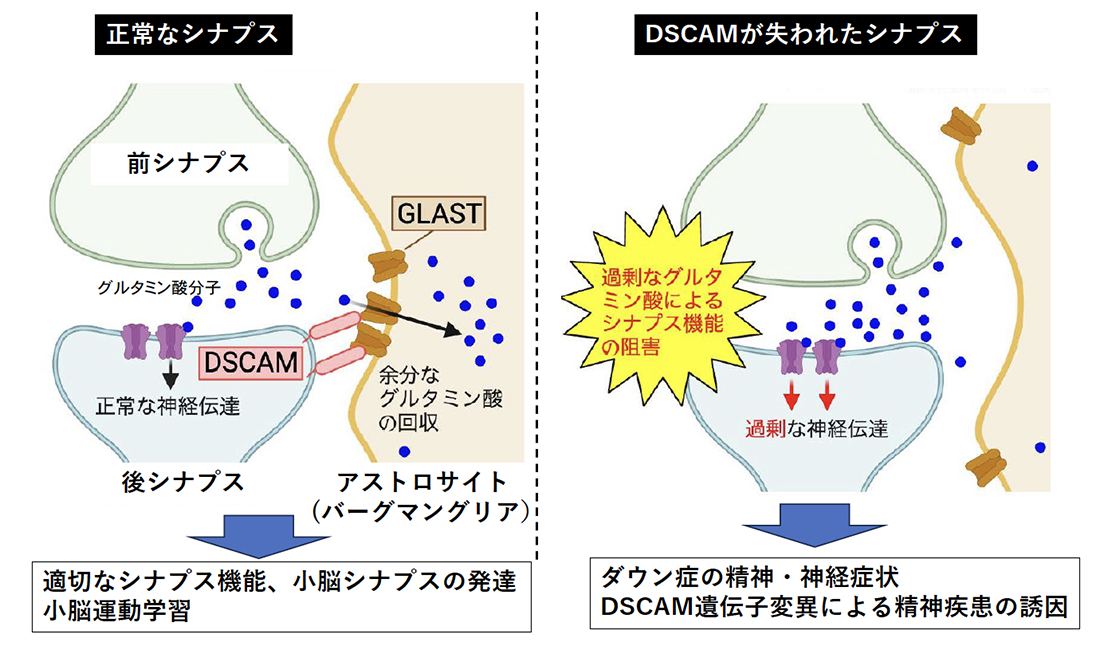
(左図)ダウン症関連遺伝子産物DSCAMは、後シナプス側の神経細胞膜上に存在し、隣接するバーグマングリア(アストロサイトの一種)細胞膜上のGLASTと結合し、シナプスへと集積させる。これによって、シナプス間隙の余剰グルタミン酸をバーグマングリア内に取り込み、シナプスの適切な機能に働く。さらに、この機能は正常な小脳シナプスの発達と、小脳運動学習にも必要とされる。
(右図)DSCAMが失われると、バーグマングリア上のGLASTをシナプス近傍に集積することができないため、余剰なグルタミン酸を効率的に回収できない。その結果として、シナプスの正常な機能が失われるだけでなく、漏れ出たグルタミン酸によって小脳シナプスの発達が阻害され、さらに小脳の運動学習機能も損なわれる。DSCAMのこうした機能が、ダウン症の精神・神経症状や、あるいはDSCAM遺伝子変異による精神疾患の病態メカニズムに関係する可能性が示唆される。
研究の背景
脳神経系は、電気的信号により情報を交換する神経細胞のネットワークで形成されています。このネットワークの神経細胞と神経細胞との結合部がシナプスと呼ばれる構造体で、前シナプス、後シナプス、シナプス間隙、そしてそれを被覆するアストロサイト(グリア細胞の一種)などで構築されています(図1)。神経興奮によって、前シナプスから神経伝達物質(興奮性神経細胞では多くの場合グルタミン酸)がシナプス間隙に放出され、それが後シナプスの受容体に受容されることで、情報が神経細胞を超えて伝えられます。この過程で、シナプス間隙に過剰な遊離グルタミン酸が残ると、神経細胞が必要以上に興奮することになり、それがさまざまな精神疾患やてんかんなどの原因・誘因となるとも言われています。また発生期においても遊離グルタミン酸のコントロールが、適切な脳の発達に関わることが示唆されてきています。余剰な遊離グルタミン酸の除去には、神経細胞膜上あるいはアストロサイト膜上のグルタミン酸トランスポーターが関わっていることが知られていますが、特にアストロサイト膜上のトランスポーター(代表的分子:GLAST)が、いかにして神経細胞が作るシナプス構造を認識し、その近傍に集積するのか、そのメカニズムは今まで明らかになっていませんでした。
図1: シナプスの構造とアストロサイトによるグルタミン酸回収システム
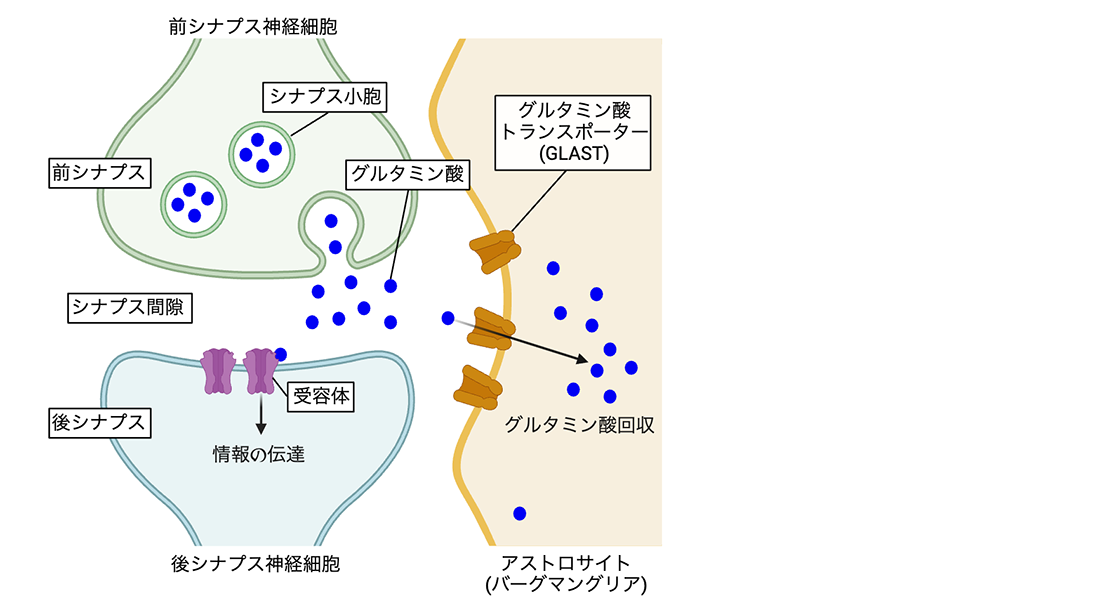
シナプスは、前シナプス神経細胞から後シナプス神経細胞へと情報を伝達するための構造体である。前シナプスからシナプス間隙へと放出されたグルタミン酸は、後シナプスのグルタミン酸受容体で受容され、後シナプス神経細胞へと情報が伝達される。この構造は、アストロサイト(小脳では主としてバーグマングリア)と呼ばれるグリア細胞によって被覆されている。シナプス間隙に放出されたグルタミン酸のうち、必要量以上の余剰グルタミン酸は、グルタミン酸トランスポーターによって速やかに細胞内へと回収される。アストロサイトに存在するグルタミン酸トランスポーター(GLAST)は、アストロサイト細胞膜上に一様に分布するのではなく、シナプスの近傍に集積し、効率的に余剰グルタミン酸を回収する。しかし、GLASTがどのようにしてシナプスを認識し、そこに集積するのか、その分子機構については未解明のままであった。
研究の内容
ヒト21番染色体上に存在するDown syndrome cell adhesion molecule (DSCAM) はダウン症の関連遺伝子として注目されており、近年では統合失調症や自閉症等に関わることも示唆されています。しかしこれらの疾患の背後にある病態メカニズムについては未解明な部分が多いです。一方で、DSCAM遺伝子およびそれにコードされるDSCAMタンパク質が、さまざまな生物種において神経系の発生・発達に重要な役割を果たしてきていることが報告されています。本研究グループにおいても、神経前駆細胞(ラディアルグリアと呼ばれる)から生まれたばかりの神経細胞が、脳室面から離脱する過程でDSCAMが働くことを報告してきました(参考文献1)・参考プレスリリース)。さらに、本研究グループでは、シナプスの構造と機能を解析しやすい小脳をモデル系として、DSCAMがシナプスの発達と機能に果たす役割を研究してきました(なお、この遺伝子はヒトではDSCAM遺伝子、マウスではDSCAM遺伝子と表記されますが、タンパク質はヒトでもマウスでもDSCAMタンパク質と表記されます)。
1. Dscam遺伝子・DSCAMタンパク質は小脳の神経細胞で発現し、興奮性シナプスに集積する
まず、マウス小脳のどの細胞、どの場所にDscam遺伝子・DSCAMタンパク質が存在するかについて調べました。mRNAの分布を調べたところ、Dscam遺伝子が小脳の各種神経細胞では発現するものの、バーグマングリアなどのアストロサイト系細胞では発現しないことを見出しました(図2a)。次に、ウエスタンブロット法というタンパク質検出方法で調べると、DSCAMタンパク質が小脳のシナプスに濃縮して存在することが明らかになりました(図2b)。さらに、DSCAMタンパク質をALFAと呼ばれる特殊なタグで標識したマウスを観察すると、DSCAMタンパク質が小脳の興奮性シナプスに存在することがわかりました(図2c)。以上から、DSCAMが小脳の興奮性シナプスで何らかの機能を果たしている可能性が示唆されました。
図2: 小脳におけるDscam遺伝子の発現とDSCAMタンパク質の分布
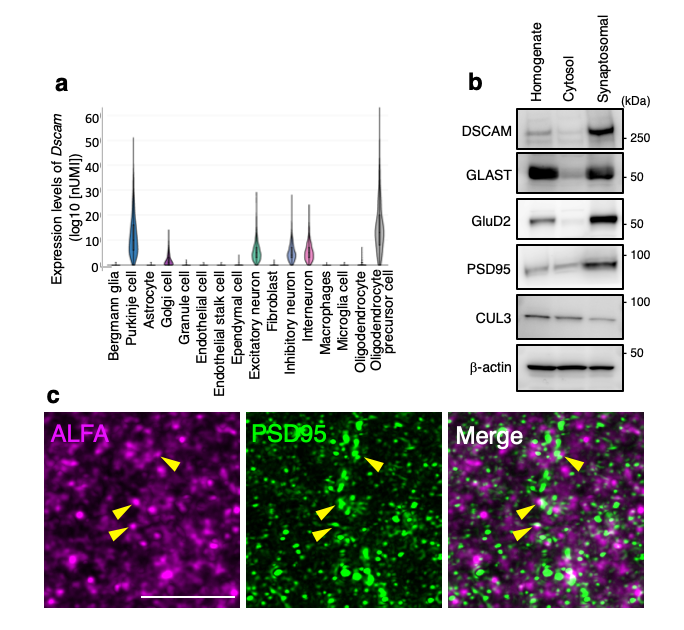
a. シングルセルRNAseq公共データベースを用いて、小脳の細胞種ごとにおけるDscam遺伝子のmRNA量を評価した結果。Dscam遺伝子はプルキンエ細胞 (Purkinje cell)やその他の神経細胞(Excitatory neuron, Inhibitory neuron, interneuron等)で発現するが、バーグマングリア(Bergmann glia)では発現しないことがわかる。
b. 小脳組織を破砕し(Homogenate)、さらに細胞分画法を使って細胞質分画(Cytosol)、 シナプスを多く含む分画(Synaptosomal)に分離した上で、その中に含まれるタンパク質について、ウエスタンブロット法で調べたもの。シナプス分画には、シナプス分子として知られるGluD2やPSD95が予想通り濃縮されている。既報通り、GLASTもシナプスに濃縮されている。この図では、DSCAMタンパク質もシナプスに濃縮されることが示されている。
c. まず、ALFAタグと呼ばれるアミノ酸配列によって標識されるDSCAMタンパク質(DSCAM-ALFAタンパク質)を発現するようなゲノム編集マウス(DscamALFA/ALFA)を作成した(データ省略)。このマウスの生後14日の小脳組織に対して、ALFAタグおよびPSD95(興奮性シナプスマーカー)に対する抗体による免疫二重組織化学染色を行った。二色のシグナルが重なっている部位は、DSCAM-ALFAタンパク質が興奮性シナプスに存在することを意味している (黄色矢頭)。
2.DSCAMが失われると、GLASTのシナプスへの集積が阻害され、遊離グルタミン酸回収が損なわれる
次に、成体小脳のプルキンエ細胞に電極を刺してパッチクランプ法で神経活動を調べたところ、Dscam遺伝子の機能喪失マウス(Dscamdel17/del17)では、興奮性シナプスの一つである平行線維シナプスで遊離グルタミン酸の回収率が低下していることがわかりました(図3a,b)。このことは、DSCAMが失われると、なぜかグルタミン酸トランスポーターがうまく機能しなくなることを示唆しています。グルタミン酸トランスポーターには、神経細胞の細胞膜上で働く分子と、バーグマングリア(アストロサイトの一種です)の細胞膜上で働く分子がありますが、どちらの機能の異常によるのかについては、電気生理学的波形から区別することができます。図3aの波形から、DSCAMが失われるとバーグマングリア側のトランスポーター(代表的な分子はGLAST)が機能不全となっていることが示唆されました。なお、このような現象は登上線維シナプス(もう一種類の興奮性シナプス)では認められませんでした(データ省略)。
なお、Dscam遺伝子の機能喪失マウス(Dscamdel17/del17)では、GLASTタンパク質の発現量自体には変化がありませんでした(データ省略)。そこで次に、免疫電子顕微鏡実験によって、GLASTの興奮性シナプス(平行線維シナプス)における分布を調べました。本来、GLASTはバーグマングリア細胞膜上で興奮性シナプスの近傍に集積する性質があるのですが、Dscam遺伝子の機能喪失マウスでは、その集積が優位に阻害されていることがわかりました(図3c, d)。このことから、神経細胞で発現するDSCAMが、バーグマングリアの細胞膜上のGLASTのシナプスへの集積に関わっていること、逆にDSCAMが失われるとGLASTのシナプスへの集積が阻害され、結果的に遊離グルタミン酸の回収が損なわれることが示唆されました。
図3: Dscam機能喪失マウス(Dscamdel17del17)の小脳シナプスにおける神経活動とGLASTの分布の変化
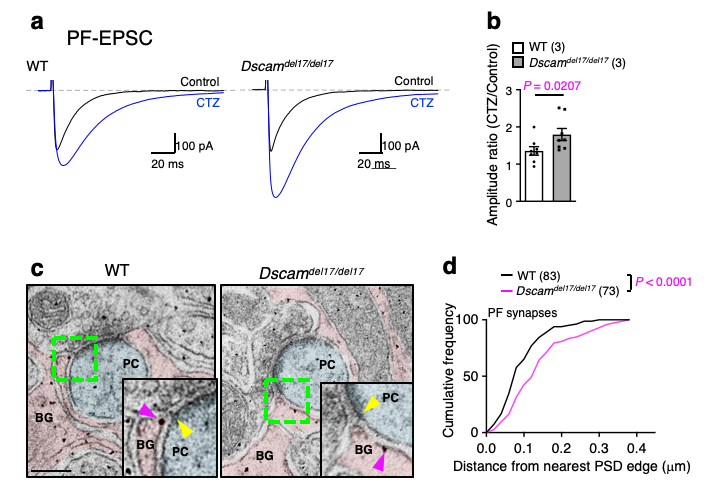
a. プルキンエ細胞に対するパッチクランプにより平行線維シナプス後電流 (PF-EPSC)を計測した際の波形。シクロチアジド (CTZ, 青線)を用いることで、シナプス間隙の遊離グルタミン酸の量が直接的に波形に反映される。
b. CTZ添加時のEPSCの増加割合を示したグラフ。Dscamdel17del17マウスでは野生型 (WT)に比べて増加割合が大きいことから、シナプス間の遊離グルタミン酸量が多くなっていると考えられる。
c. 電子顕微鏡により平行線維シナプスを観察した画像。抗体によってGLASTの分布を可視化している(黒点, 紫矢頭)。正常マウス(WT)ではシナプス近傍(黄色矢頭)に集積するGLASTが、Dscam機能喪失マウスではより離れた位置に存在する。
d. GLAST分子とシナプス(アクティヴゾーンと呼ばれる部位の末端)の距離を計測し、結果を累積度数分布で表した図。横軸が距離を示しており、シナプスから離れたGLASTが多いほどグラフは右寄りになる。
3. DSCAMタンパク質はGLASTと結合し、小脳シナプスに共局在する
次に、小脳の抽出液からDSCAM抗体を用いてDSCAMタンパク質とそれに結合する分子群をまとめて分離しました。その分離産物を、ウエスタンブロット法で調べたところ、その中にGLAST分子も含まれていることが観察されました(図4a)。つまり、小脳においてDSCAMとGLASTが結合していることが示唆されました。次に、培養細胞を用いて結合部位を調べたところ、DSCAMタンパク質の細胞外領域とGLASTが結合することがわかりました(データ省略)。さらに、先述のDSCAMタンパク質にALFAタグをつけた遺伝子改変マウス(DscamALFA/ALFA)の小脳を観察したところ、DSCAMとGLASTが同じ場所に共局在していることが観察されました(図4b)。GLASTは興奮性シナプスに強く局在することが知られていますし、また図2でDSCAMもシナプスに濃縮することがわかったので、この二つのタンパク質が小脳の興奮性シナプスにおいて結合しているのではないかということが、さらに示唆されました。
図4: DSCAM-GLAST結合と小脳組織内での共局在
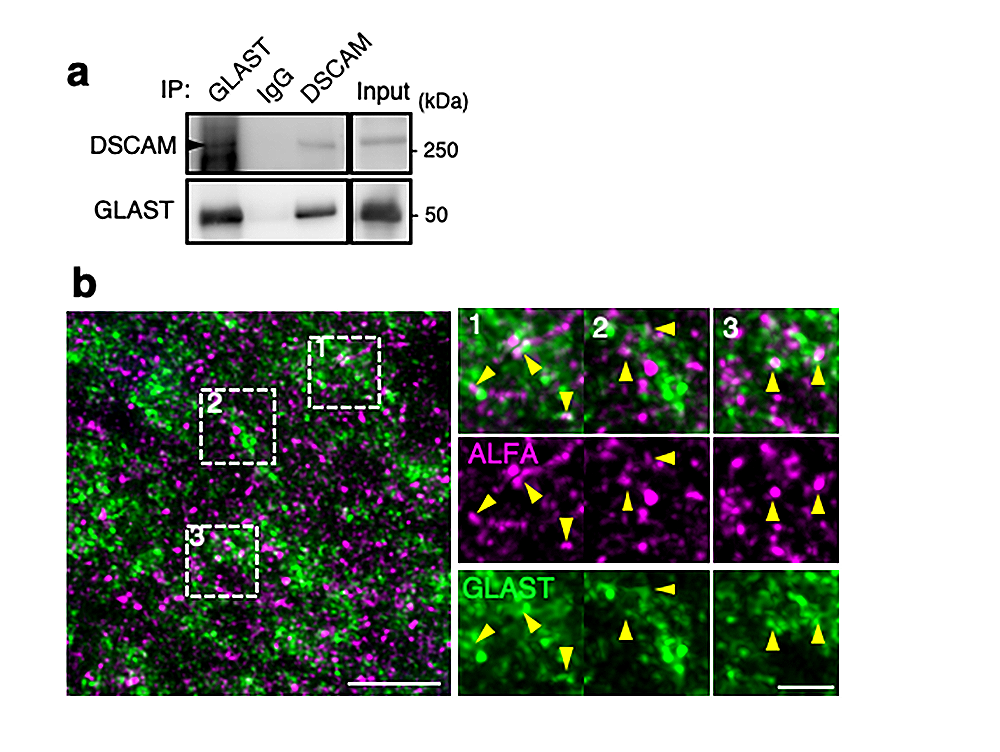
a. 成体小脳の抽出液に対してDSCAM抗体を用いた免疫沈降法 (IP: Immunoprecipitation)を行い、DSCAMおよびその結合タンパク質を集め、その精製物に対してウエスタンブロット法を行った。GLAST抗体で強いシグナルが見られるので(下のパネル)、DSCAMとGLASTが小脳組織内でお互いに結合していることが示唆される。
b. DSCAM-ALFAタンパク質が発現するゲノム編集マウス(DscamALFA/ALFA)の生後14日目小脳に対して行った免疫組織化学染色。ALFAタグとGLASTのシグナルが隣接していることから、DSCAM-ALFAとGLASTが小脳組織で共局在することがわかる(黄色矢頭)。GLASTはシナプスに強く局在することが知られおり、また図2でDSCAMもシナプスに濃縮することがわかったので、この二つのタンパク質は小脳シナプスにおいて結合しているのではないかと考えられた。
DSCAMは神経細胞側で発現し(図1)、GLASTがバーグマングリア側で発現することを考えると、DSCAMとGLASTが小脳の興奮性シナプスにおいて細胞を超えて(神経細胞とバーグマングリア)、お互いに結合していることが示唆されます。以上から、シナプスにおいて、神経細胞膜上のDSCAMがその細胞外ドメインを介してバーグマングリア細胞膜上のGLASTと結合することによって、GLASTをシナプス側へ集積させていることが示唆されました。このメカニズムによって、GLASTがシナプス近傍へと集積することになり、結果的にシナプス内の遊離グルタミン酸の効率的な除去が可能となっていると考えられました(図5)。逆に、DSCAMの機能が失われるとGLASTがシナプスに集積しにくくなり、効率的なグルタミン酸の除去が阻害されるために、適切なシナプス機能が障害されることになります
図5: DSCAMによるGLASTのシナプスへの集積メカニズムと病態
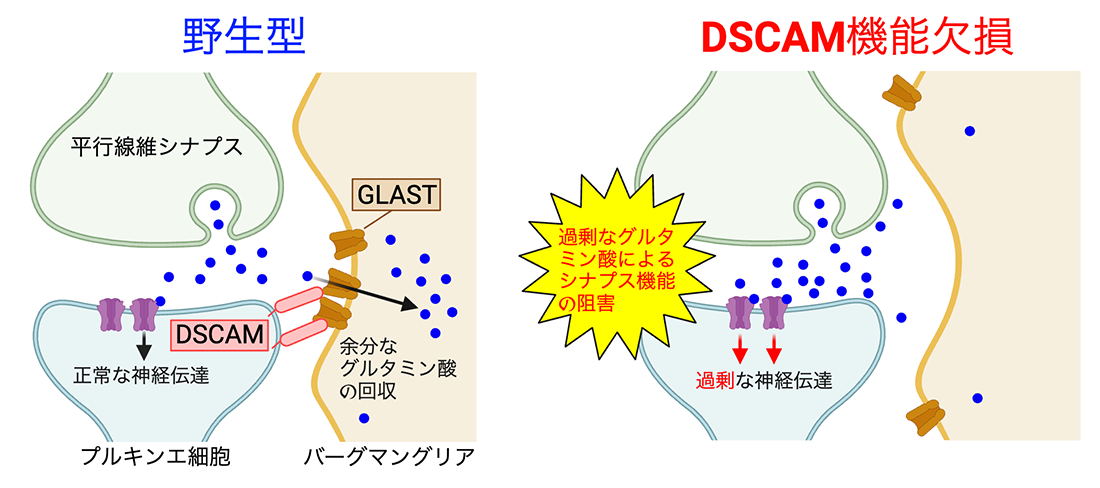
(左図)正常マウス(野生型)では、シナプスのプルキンエ細胞膜上に配置されたDSCAMが、その細胞外領域を使ってバーグマングリア細胞膜上のGLASTと結合し、GLASTをシナプスへと集積させる。これによって、シナプス間隙の余剰グルタミン酸が効率よく除去される。プルキンエ細胞上のDSCAMが働くと特定された理由については、「研究の意義・今後の展望」の項を参照。
(右図)DSCAMの機能が失われるとGLASTのシナプスへの集積が損なわれるため、シナプスおよびその周辺に過剰グルタミン酸が漏出し、適切なシナプス機能が障害される。
4.DSCAMによる余剰グルタミン酸制御は、小脳の興奮性シナプスの発達に大きく関与する
一般的に、シナプスにおける余剰な遊離グルタミン酸のコントロールは、シナプスの適切な機能に必要とされるだけでなく、神経系の発生・発達にも大きく関わっていると考えられています。そこで我々は、プルキンエ細胞へと投射する2種類の興奮性シナプス(平行線維シナプスと登上線維シナプス)の発達について調べました。この2種類のシナプスは、お互いに競合してテリトリーを奪い合いながら発達するのですが、登上線維シナプスが発達に伴って少しずつプルキンエ細胞の基部から樹状突起の末端方向(上方)へと数を増やしていくことが知られています。正常なマウスと比べて、Dscam遺伝子の機能喪失マウス(Dscamdel17/del17)では、登上線維シナプスの上方拡大が極端に損なわれることが観察されました(図6a, b)。この現象は、Dscam遺伝子をプルキンエ細胞だけで阻害したノックアウトマウス(Dscamflox/flox; Pfcp2Cre)でも認められたため(図6c、右上vehicle参照)、プルキンエ細胞で発現するDSCAMタンパク質こそが、このシナプス発達に重要な役割を果たしていることが明らかになりました。
上述のように、DSCAMが失われると平行線維シナプスでのグルタミン酸回収が障害されますので(図2)、そこから漏れ出た遊離グルタミン酸が競合する登上線維シナプスの発達を阻害したという可能性が浮上してきました。そこで、上記のDSCAM遺伝子をプルキンエ細胞だけでノックアウトしたマウス(Dscamflox/flox; Pfcp2Cre)に対して、GLASTのグルタミン酸取り込み促進剤(リルゾール)を投与したところ、登上線維シナプスの発達異常がかなり軽減されました(図6c-e)。以上から、DSCAM欠損による登上線維シナプスの発達異常が、GLASTによる遊離グルタミン酸の取り込み障害のせいであることが示唆されました。また、DSCAMの機能異常による登上線維シナプスの障害について、模式図にまとめました(図6f)。
図6: DSCAM欠損及びグルタミン酸回収不全による登上線維シナプスの発達障害
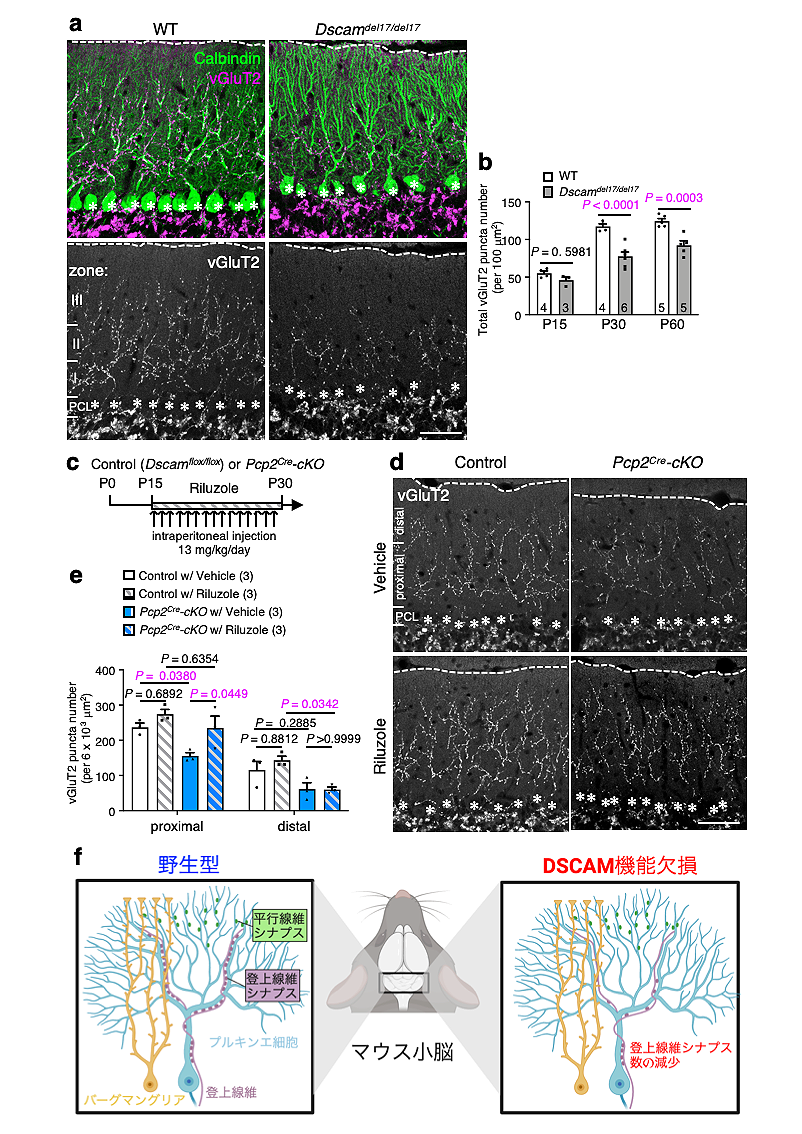
a. Dscam機能欠失マウス(Dscamdel17del17)の生後30日目の小脳組織をプルキンエ細胞マーカー(Calbindin)と登上線維シナプスマーカー(vGluT2)で免疫染色した画像。
b. マウスの生後15日(P15), 30日(P30), 60日(P60)における登上線維シナプス密度の計測結果を示したグラフ。
c. リルゾール投与実験のデザイン。
d. 対照群(Control)マウスと、プルキンエ細胞だけでDscam遺伝子をノックアウトしたマウス(Pcp2cre-cKOと表記。正確にはDscamflox/flox; Pcp2Cre)の生後30日におけるvGluT2免疫染色の画像(Vehicle: 生理食塩水投与, Riluzole: リルゾール投与)。
e. リルゾール投与後の登上線維シナプス密度の計測結果を示したグラフ(斜線入り: リルゾール投与群)。グラフ左側はプルキンエ細胞下方(proximal), 右側はプルキンエ細胞上方(distal)。
f. DSCAM欠損による小脳のシナプス形成障害の模式図。
5.DSCAMはマウスの運動学習に必要とされる
チェック模様の壁の内側にマウスを固定し、その壁を15度ずつ左右に周期的に動かすと、マウスは目でこの動きを追いますが、訓練を重ねて学習すると、だんだんこの動きが上手になってきます。しかし、Dscam遺伝子をプルキンエ細胞だけでノックアウトしたマウス(Dscamflox/flox; Pfcp2Cre)では、この学習能力が極端に低下することがわかりました。登上線維シナプスの発達が、この運動学習(OKRと呼ばれます)に関わることが知られていますので、DSCAMが登上線維シナプスの発達制御を介して、運動学習に関与することが示唆されたと言えます。
図6: DSCAM機能欠損マウスでは小脳が関与する運動学習が障害される
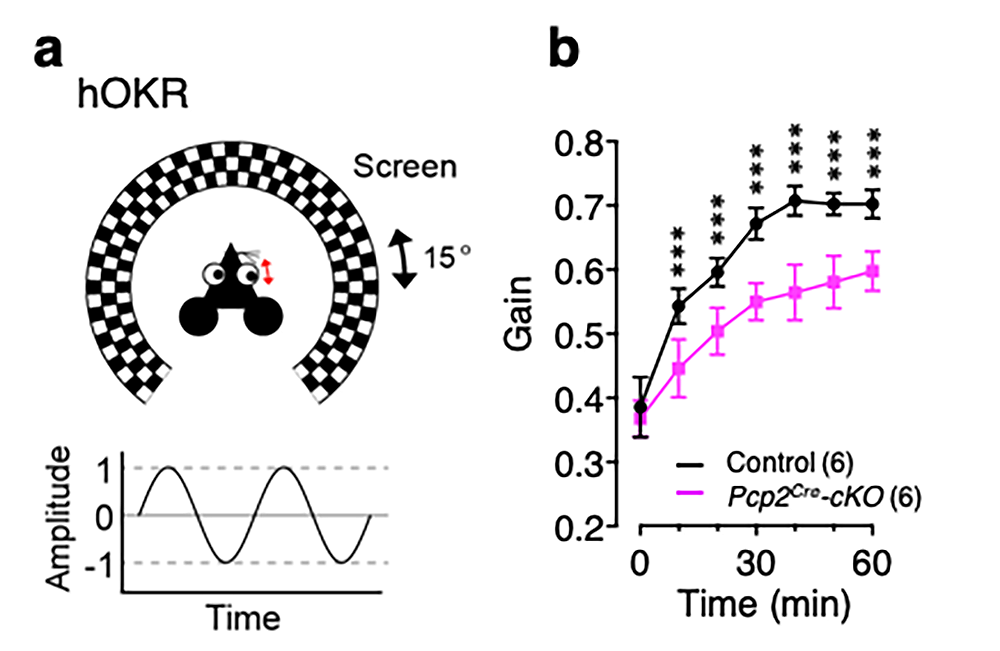
a.水平性視機性眼球反応(hOKR)の模式図。
b.60分間のhOKR訓練中に増加した眼球反応の割合(10分間毎の平均値)。縦軸(Gain)の値が低いほど、模様を追う目の動きが少ないことを示す
研究の意義・今後の展望
シナプスにおける遊離グルタミン酸のコントロールが、シナプス機能・脳神経回路機能や脳の発達に極めて重要な役割を果たすことが知られていますが、その除去に関わるグルタミン酸トランスポーターが、どのようにシナプスを見つけ出し、そこに効率的に集積するのか、その分子機構についてはわかっていませんでした。本研究は、ダウン症関連分子であるDSCAMがシナプスの神経細胞側の細胞膜に局在し、細胞外ドメインを介してバーグマングリア細胞膜上のグルタミン酸トランスポーター(GLAST)をシナプスへと引きつけることを明らかにしたものであり、「グルタミン酸トランスポーターのシナプスへの局在メカニズム」という神経科学上の大きな課題を解明したものであります。また、プルキンエ細胞だけでDscamをノックアウトしたマウスでもシナプスの発達異常が観察されましたので、少なくともDSCAMタンパク質は後シナプス側(プルキンエ細胞側)の細胞膜に局在し、そこでバーグマングリア細胞膜上のGLASTと結合していると考えられます。さらに、DSCAMがGLASTのシナプスへの集積機構を介して、シナプスの正常な機能や発達を制御し、さらに運動学習にも関わることも示されました。今回の発見は、ダウン症の精神・神経症状や、DSCAM遺伝子の変異による精神疾患の病態の理解につながると期待されます。
用語解説
1) DSCAM/Dscam遺伝子
Down syndrome cell adhesion molecule (DSCAM) は1998年にヒト21番染色体のダウン症責任領域で見つかり、ダウン症の関連遺伝子として注目された。さらに、さまざまな精神疾患に関連することが示唆されているがその背後の病態機序は不明である。この遺伝子は、ヒト・マウスなどの脊椎動物だけでなく、ショウジョウバエ等の無脊椎動物においても、神経系の発生に重要な役割を果たすことが報告されてきている。
2) プルキンエ細胞
小脳皮質を構成する抑制性神経細胞の一つで、大きな細胞体と複雑に枝分かれした樹状突起を持つ特徴的な形態を呈する。顆粒細胞から平行線維、下オリーブ核神経細胞から登上線維という2種類の興奮性神経線維の投射を受けて、興奮性シナプス(平行線維シナプス、登上線維シナプス)を形成する。
3) バーグマングリア
小脳だけに存在する、アストロサイトの一種。プルキンエ細胞に投射するシナプスを包み込み、グルタミン酸トランスポーターを介して放出された神経伝達物質(グルタミン酸)を取り込むなど、神経細胞の活動をサポートする役割を持つ。
4) グルタミン酸トランスポーターとGLAST
興奮性シナプスにおいて機能する神経伝達物質であるグルタミン酸は、神経活動依存的に放出された後、グルタミン酸トランスポーターによってシナプス間隙から回収されることによって過剰な入力が起こらないよう制御されている。GLASTはバーグマングリアを含むアストロサイトに発現するグルタミン酸トランスポーターであり、シナプス間隙におけるグルタミン酸濃度が高い場合にのみ応答し、グルタミン酸を細胞内へと取り込む。
発表論文
著者:Dewa K, Arimura N, Kakegawa W, Itoh M, Adachi T, Miyashita S, Inoue YU, Hizawa K, Hori K, Honjoya N, Yagishita H, Taya S, Miyazaki T, Usui C, Tatsumoto S, Tsuzuki A, Uetake H, Sakai K, Yamakawa K, Sasaki T, Nagai J, Kawaguchi Y, Sone M, Inoue T, Go Y, Ichinohe N, Kaibuchi K, Watanabe M, Koizumi S, Yuzaki M, Hoshino M:
タイトル:Neuronal DSCAM regulates the peri-synaptic localization of GLAST in Bergmann glia for the functional synapse formation.
雑誌:Nature Communications
DOI: 10.1038/s41467-023-44579-z.
URL: https://www.nature.com/articles/s41467-023-44579-z
参考文献
1)Arimura N, Okada M, Taya S, Dewa KI, Tsuzuki A, Uetake H, Miyashita S, Hashizume K, Shimaoka K, Egusa S, Nishioka T, Yanagawa Y, Yamakawa K, Inoue YU, Inoue T, Kaibuchi K, Hoshino M:
DSCAM regulates delamination of neurons in the developing midbrain.
Science Advances, 6(36), eaba1693. 2020
<プレスリリース>生まれたての神経細胞が旅立つための最初期段階メカニズムを解明 〜 脳室面にくっついた神経細胞の足をDSCAMタンパク質が切り剥がす 〜
https://www.ncnp.go.jp/topics/2020/20200903d.html
助成金
本研究は、以下の事業・研究領域・研究課題によって得られました。
・日本医療研究開発機構(AMED) (JP23wm0425005h0003)
・日本学術振興会(JSPS) 科学研究費補助金 基盤研究(B)( 22H02730)
お問い合わせ先
【研究に関するお問い合わせ先】
星野 幹雄 (ほしの みきお)
国立精神・神経医療研究センター 神経研究所 病態生化学研究部・部長
有村 奈利子(ありむらなりこ)
東北大学 大学院薬学研究科 薬理学分野・准教授
【報道に関するお問い合わせ先】
国立研究開発法人 国立精神・神経医療研究センター 総務課広報係
国立大学法人 東北大学 大学院薬学研究科 総務係