2024-02-16 ジョージア工科大学
<関連情報>
- https://research.gatech.edu/clearer-image-glaucoma
- https://www.nature.com/articles/s41467-023-44479-2
アミロイドを形成するβ-プロペラにおける内部からの展開と病原性凝集の競合 Competition between inside-out unfolding and pathogenic aggregation in an amyloid-forming β-propeller
Emily G. Saccuzzo,Mubark D. Mebrat,Hailee F. Scelsi,Minjoo Kim,Minh Thu Ma,Xinya Su,Shannon E. Hill,Elisa Rheaume,Renhao Li,Matthew P. Torres,James C. Gumbart,Wade D. Van Horn & Raquel L. Lieberman
Nature Communications Published:02 January 2024
DOI:https://doi.org/10.1038/s41467-023-44479-2
Abstract
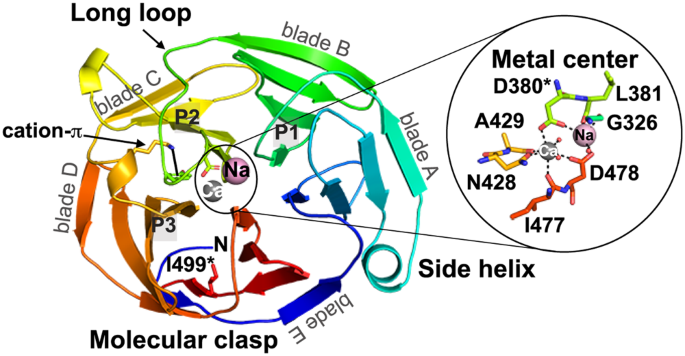
Studies of folded-to-misfolded transitions using model protein systems reveal a range of unfolding needed for exposure of amyloid-prone regions for subsequent fibrillization. Here, we probe the relationship between unfolding and aggregation for glaucoma-associated myocilin. Mutations within the olfactomedin domain of myocilin (OLF) cause a gain-of-function, namely cytotoxic intracellular aggregation, which hastens disease progression. Aggregation by wild-type OLF (OLFWT) competes with its chemical unfolding, but only below the threshold where OLF loses tertiary structure. Representative moderate (OLFD380A) and severe (OLFI499F) disease variants aggregate differently, with rates comparable to OLFWT in initial stages of unfolding, and variants adopt distinct partially folded structures seen along the OLFWT urea-unfolding pathway. Whether initiated with mutation or chemical perturbation, unfolding propagates outward to the propeller surface. In sum, for this large protein prone to amyloid formation, the requirement for a conformational change to promote amyloid fibrillization leads to direct competition between unfolding and aggregation.


