2024-05-13 理化学研究所,バイオ産業情報化コンソーシアム
理化学研究所(理研)生命機能科学研究センター 生体分子動的構造研究チームの嶋田 一夫 チームリーダー(バイオ産業情報化コンソーシアム(JBIC)特別顧問)、今井 駿輔 上級研究員、タンパク質機能・構造研究チームの白水 美香子 チームリーダーらの研究チームは、Gタンパク質共役型受容体(GPCR)[1]の一種であるμオピオイド受容体(MOR)[2]が、アロステリック調節薬[3]により活性化されるメカニズムを、日本医療研究開発機構(AMED)の支援により導入された超高磁場NMR装置(4K 1GHz)を用いた溶液核磁気共鳴法(溶液NMR法)[4]とクライオ電子顕微鏡法[5]を使って解明しました。
本研究成果は、GPCRを標的とした、既存薬より高い薬効を有する医薬品の開発に貢献すると期待できます。
GPCRを標的とする医薬品はこれまで多く開発されていますが、従来の医薬品はGPCRの細胞外側にある結合ポケット[6]に結合しており、GPCRの活性を十分に引き出すことができなかったため、この結合ポケット以外の場所に結合して作用するアロステリック調節薬の実用化が期待されています。
今回、研究チームは、オピオイド鎮痛薬の主な標的であるMORの活性がアロステリック調節薬により増強される構造的要因を調べました。構造解析の結果、アロステリック調節薬はMORの膜貫通ヘリックス[7]の細胞膜側表面に結合することで、MORの中心部に位置する二つの保存されたアミノ酸残基間の相互作用を強め、これによってMORの動的構造平衡[8]のうち活性の最も高い完全活性化構造の存在比が増大することを明らかにしました。
本研究は、科学雑誌『Nature Communications』オンライン版(5月13日付:日本時間5月13日)に掲載されました。
背景
Gタンパク質共役型受容体(GPCR)は、米国食品医薬品局(FDA)承認薬の標的の30%以上を占める、創薬標的として極めて重要な膜タンパク質ファミリーです。GPCRは細胞外のさまざまな刺激を細胞内シグナル伝達因子[9]であるGタンパク質[9]に伝える機能を持ち、その最初のステップは、ホルモンなどの分泌因子がGPCRの細胞外側に存在するポケットに結合することです。GPCRを標的とした医薬品は、この仕組みを利用してGPCRを活性化することで、体に作用します。現在もより高い効果を示す医薬品の開発が進められていますが、細胞外側の結合ポケットを標的とした化合物スクリーニングでは、完全作動薬と呼ばれる最大活性を示す既存薬より、強くGPCRを活性化するものが新たに見つかることはまれであり、この上限をいかに克服するかが課題となっています。一方で、細胞外側のポケットとは異なる部位に結合する「アロステリック調節薬」と呼ばれる新しいクラスの化合物が報告されています。これは、細胞外側ポケットに結合する医薬品と、この結合ポケットとは異なる場所に結合するアロステリック調節薬がGPCRに同時に作用すると、GPCRのシグナル伝達活性が増強されるという現象を応用したものです。アロステリック調節薬は、既存薬の薬効度の限界を打ち破る新たな医薬品候補として期待されています。
μオピオイド受容体(MOR)は、鎮痛作用に関わる代表的なGPCRの一種です。嶋田 チームリーダーらは、溶液NMR法による解析から、MORが不活性化、部分活性化、完全活性化の3種の構造間の動的構造平衡にあり、その存在比が細胞外側ポケットに結合する医薬品により変化することを示しました。さらに、アロステリック調節薬であるBMS-986122がMORに結合すると、部分活性化構造の存在比が減少し、完全活性化構造の存在比を増大させることによってMORの活性を上昇させることを突き止めました注1)。
この先行研究において嶋田 チームリーダーらは、BMS-986122がMORの膜貫通ヘリックス3の細胞膜側に結合することで、膜貫通ヘリックス3と膜貫通ヘリックス5間の相互作用が変化し、MORの動的構造平衡を変化させることが、アロステリック調節薬の作用メカニズムであると提唱しました。
しかし、アロステリック調節薬の結合がどのようにMORの動的構造平衡を調節するのかはまだ不明な点が多いことや、また、この膜貫通ヘリックス3と膜貫通ヘリックス5の結合(疎水性結合)に関わる複数の疎水性アミノ酸残基(疎水性クラスター)はGPCR間で保存されているわけではないことから、MOR以外のGPCRに広く適用可能な、強い作用を持つアロステリック調節薬を合理的に設計するための方針を示すには至っていませんでした。
注1)2022年4月12日プレスリリース「アロステリック薬剤はタンパク質の構造平衡を変化させる」
研究手法と成果
今回、研究チームは、アロステリック調節薬の作用メカニズムをさらに詳細に調べるため、BMS-986122と完全作動薬(DAMGO)結合状態のMOR、Gタンパク質(三量体Giタンパク質)の複合体のクライオ電子顕微鏡構造を初めて決定しました(図1)。この結果、BMS-986122は確かにMORの膜貫通ヘリックス3の細胞膜側に結合することが示されました。さらに、BMS-986122が結合したときとしていないときのMORのクライオ電子顕微鏡の密度マップ[5]を比較した結果、MORの全体構造には大きな変化がなかったものの、GPCR間で保存性の高い残基である167番目のアルギニン(R167、膜貫通ヘリックス3に存在)と254番目のチロシン(Y254、膜貫通ヘリックス5に存在)の側鎖間の密度が、BMS-986122結合時には非結合時よりもわずかに強く観測されることが明らかとなりました。このことは、BMS-986122の結合によって両残基間の相互作用が影響を受けることを示唆します。
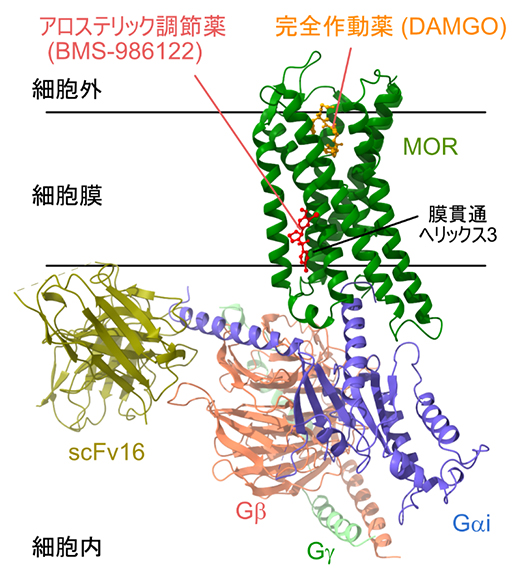
図1 アロステリック調節薬結合状態のMOR-Gタンパク質複合体のクライオ電子顕微鏡構造
アロステリック調節薬(BMS-986122)、μオピオイド受容体(MOR)、Gタンパク質(Gαi、Gβ、Gγの三つのサブユニットから成る三量体Giタンパク質)の複合体のクライオ電子顕微鏡構造。MORの細胞外側ポケットには完全作動薬であるDAMGOが結合している。scFv16は、クライオ電子顕微鏡解析の際に、Gαiサブユニットの運動性を抑制するために添加した単鎖抗体。細胞膜に対応する領域を黒の実線で示した。BMS-986122は細胞膜側からMORの膜貫通ヘリックス3に直接結合する。
次に、R167とY254の相互作用がMORの活性を規定する動的構造平衡に及ぼす影響を調べました。このために観測対象分子が水溶液中で機能している状態をそのまま観測できる溶液NMR法により解析しました。まず、R167とY254の近傍に存在する257番目のメチオニン(M257)のメチル基由来のNMRシグナルを観測し、BMS-986122がその周辺の構造に及ぼす影響を解析したところ、BMS-986122結合によってこの領域の運動性が抑制されることが明らかとなりました(図2A)。この実験は、日本医療研究開発機構(AMED)の支援により導入されたBruker社製4K 1GHz NMR装置[10]により可能となりました。
さらに、Y254をフェニルアラニンに置換してR167との相互作用を変調させたY254F変異体を、野生型MORと比較しました。Y254F変異体ではM257のシグナルが広幅化しBMS-986122の有無に関わらず観測されなくなったことから、Y254がM257近傍の運動性の抑制に関わっていることが示されました(図2B)。
加えて、Y254F変異体について、MORの活性を規定する3構造間の動的構造平衡を解析したところ、完全活性化構造の存在比が野生型と比較して減弱しており、活性の低下も認められました。
以上の結果から、Y254とR167の分子内相互作用による運動性の抑制が完全活性化構造を安定化させること、およびBMS-986122の結合がその安定化をさらに強めることが分かりました(図2B)。
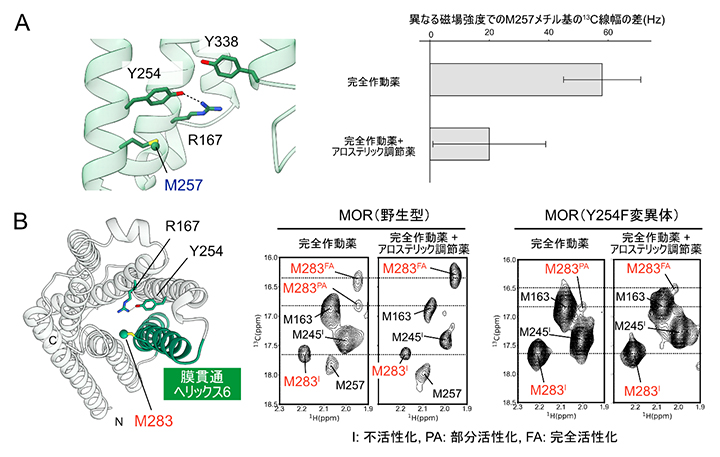
図2 MORの構造平衡へのアロステリック調節薬およびR167-Y254相互作用の影響
(A)左:アロステリック調節薬結合状態MORのクライオ電子顕微鏡構造におけるR167-Y254とM257の関係。M257はY254と同じ膜貫通ヘリックス5に存在し、共に分子内部方向を向く。またM257は、Y254と相互作用する膜貫通ヘリックス3のR167とも近傍である。右:M257メチル基の2磁場強度(1H共鳴周波数として800MHz、1GHz)における13C線幅の差。この差が大きいほど、マイクロ秒~ミリ秒における運動性が大きいことを表す。アロステリック調節薬の共存下ではこの値が小さくなることは、アロステリック調節薬の結合によってM257周辺の運動性が抑制されることを示している。
(B)左:アロステリック調節薬結合状態MORのクライオ電子顕微鏡構造におけるR167-Y254とM283(283番目のメチオニン)の関係。膜貫通ヘリックス6上に存在するM283のNMRシグナルは、膜貫通ヘリックス6の細胞内側の開閉状態を反映する。右:M283メチル基由来のNMRシグナル。野生型MORでは、M283は不活性化、部分活性化、完全活性化のそれぞれに対応する3個のシグナルを与え、その強度比が測定条件におけるMORの活性を規定する。Y254F変異体では完全活性化構造由来シグナルの強度比が野生型よりも低下することから、Y254が完全活性化構造の安定化に寄与することが分かった。
以上の解析から、MORがアロステリック調節薬と結合していない状態における不活性化、部分活性化、完全活性化の動的構造平衡にはR167とY254の間の相互作用が関わっており、BMS-986122は細胞膜側からMORに結合することでこの相互作用を増強し、その結果、完全活性化構造の存在比を高めることが示されました(図3)。研究チームは、この詳細な分子メカニズムとして、BMS-986122が膜貫通ヘリックス3に細胞膜側から結合すると、同じヘリックスに存在するR167が膜貫通ヘリックス5のY254に近づき、R167とY254が相互作用する割合が高まることによって膜貫通ヘリックス6が閉じにくくなることが、完全活性化構造の存在比を高める構造的要因であることを提唱しました。
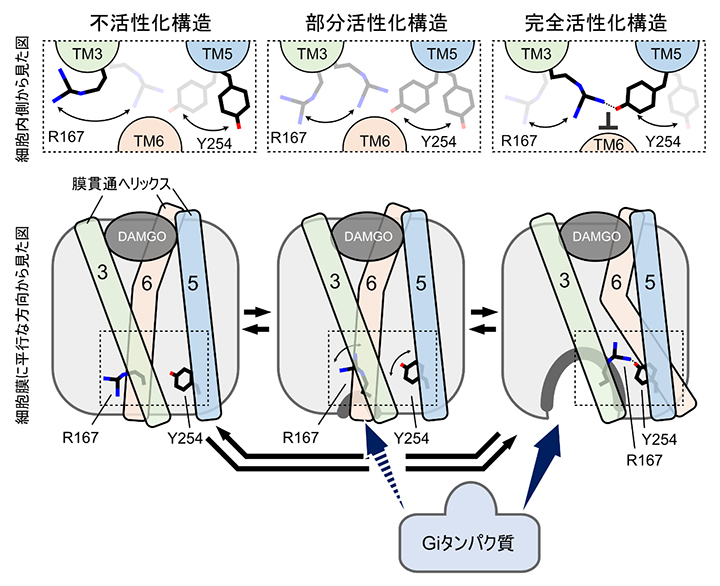
図3 MORの動的構造平衡とBMS-986122による完全活性化構造の安定化
MORは不活性、部分活性化、完全活性化の3構造間の動的構造平衡にある。BMS-986122の結合は図に示すような膜貫通ヘリックス3(TM3)に存在するR167と、膜貫通ヘリックス5(TM5)に存在するY254の相互作用を介して、膜貫通ヘリックス6(TM6)が開いた完全活性化構造を安定化することによってその存在比を増大させ、三量体Giタンパク質を介したMORのシグナル伝達活性を上昇させる。図中の破線枠内はTM3、TM5、TM6を細胞内側から見た図を示している。また、図下のGiタンパク質から出ている破線矢印と実線矢印は、MORへの結合のしやすさを表し、細胞内側が開いた完全活性化構造の方が、閉じている部分活性化構造よりGiタンパク質が結合しやすいことを示している。
今後の期待
これまでの解析では、アロステリック調節薬の結合がMOR分子内部に存在する膜貫通ヘリックス間の疎水性クラスターを介してMORの動的構造平衡を変調させることが観測されていました。しかし、この疎水性クラスターを構成するアミノ酸残基はGPCRの種によって大きく異なるため、この動作機構を他のGPCRに適用し新たなアロステリック調節薬を開発するための方針を具体的に提示するには至っていませんでした。
今回の溶液NMR法とクライオ電子顕微鏡法による解析から、アロステリック調節薬は、MORの膜貫通ヘリックス3に細胞膜側から結合することによって、膜貫通ヘリックス3上で分子内部を向いているR167が膜貫通ヘリックス5上のY254と相互作用しやすくなる結果、これらの残基の相互作用により膜貫通ヘリックス6が開いた完全活性化構造が安定化しその存在比が高まり、MORの活性が上昇することが分かりました。R167とY254はいずれもGPCR間に広く保存された残基であることから、この機構は他のGPCRにも広く適用できる可能性があります。今回得られた知見を応用し、アロステリック調節薬BMS-986122のようにGPCRの膜貫通ヘリックス3の細胞膜側表面に結合する化合物を設計することによって、GPCRの既存薬と同時に働いてその作用を増強する新規GPCR標的薬の創出が期待されます。
補足説明
1.Gタンパク質共役型受容体(GPCR)
細胞膜表面に発現し、細胞外からの刺激を受容して、細胞内のGタンパク質を活性化することで細胞応答を引き起こす膜タンパク質の総称。細胞膜をαヘリックスが7回貫通する構造を特徴とする。GPCRはG protein-coupled receptorの略。
2.μオピオイド受容体(MOR)
鎮痛作用に関連した代表的なGPCR。モルヒネなどのオピオイド鎮痛薬が結合することにより活性化して、細胞内側へシグナルを伝達し鎮痛作用をもたらす。MORはmu opioid receptorの略。
3.アロステリック調節薬
アロステリックモジュレーターとも呼ばれる。受容体上において、生理的リガンド(配位子)や医薬品が結合する部位から離れた領域に結合することで、その受容体のシグナル伝達活性を制御する化合物の総称。受容体に対して生理的リガンドや医薬品と同時に結合することで、協奏的に受容体に作用することを特徴とする。
4.溶液核磁気共鳴法(溶液NMR法)
溶液中の生体分子などを、強い磁場中に置くことで生じる原子核の共鳴現象を観測し、生体分子の構造や運動性を原子レベルで解析できる分光法。磁場の強さは慣習的に、その磁場における1H(プロトン)の共鳴周波数を用いてMHz(100万Hz)単位で表される。NMRはnuclear magnetic resonanceの略。
5.クライオ電子顕微鏡法、密度マップ
クライオ電子顕微鏡法は、タンパク質などの生体試料の構造を決定するため、試料溶液を急速凍結して分子をごく薄い氷の層に閉じ込めた状態で、液体窒素温度(-196℃)で電子線を当てて電子顕微鏡により分子の像を観察する手法。クライオ電子顕微鏡で撮影した多数の画像から、生物分子の立体像を再構築したものを密度マップといい、分子内部の密度の高い部分が濃く、密度の低い部分は薄く表示される。
6.結合ポケット
原子レベルで見たタンパク質の表面には凹凸があり、その中でも低分子が結合しやすいポケット状のくぼんだ空間を結合ポケットあるいは単にポケットと呼ぶ。
7.膜貫通ヘリックス
ヘリックスはタンパク質の代表的な二次構造で、3.6アミノ酸残基で1回転する右巻きらせん構造をとる。膜タンパク質の細胞膜に埋め込まれた部分のヘリックス領域を、膜貫通ヘリックスと呼ぶ。
8.動的構造平衡
タンパク質や核酸などの立体構造が一つではなく、複数の異なる構造間の交換状態にあり、見かけ上はそれぞれの構造比が一定の状態にあること。
9.細胞内シグナル伝達因子、Gタンパク質
分泌因子が受容体に結合した刺激は、細胞内タンパク質の連鎖的なリン酸化などを介して、最終的に遺伝子の発現制御につながる。細胞内でこの一連の反応に関わる因子を細胞内シグナル伝達因子と呼ぶ。Gタンパク質は受容体近傍で機能する代表的な細胞内シグナル伝達因子の一つで、グアニンヌクレオチド結合タンパク質の総称。グアノシン二リン酸(GDP)が結合している不活性型と、グアノシン三リン酸(GTP)が結合している活性型の間でタンパク質のコンフォメーションが変化し、分子スイッチとして働く。なお本研究で対象としたGタンパク質は、α、β、γの三つのサブユニットで構成され、下流のアデニル酸シクラーゼを抑制するシグナルを伝える三量体Giタンパク質。
10.4K 1GHz NMR装置
水素原子核の共鳴周波数が1GHz(10億Hz)である最新型の超高磁場NMR装置。NMR装置の感度や分解能は、磁場が高いほど向上する。従来の超高磁場NMR装置ではマグネットを2K(-271°C)まで冷却する必要があったが、この装置では冷却温度4K(-269°C)で1GHzを達成している。このため、装置の総重量は前世代機の3分の1(2,300kg)まで小型化され、漏えい磁場の指標となる5ガウスライン半径は2分の1(1.9m)に、冷却に用いるヘリウムの消費量は3分の1(80mL/hr)に抑えられている。
研究チーム
理化学研究所 生命機能科学研究センター
生体分子動的構造研究チーム
チームリーダー 嶋田 一夫(シマダ・イチオ)
(バイオ産業情報化コンソーシアム 特別顧問、広島大学 副学長)
上級研究員 今井 駿輔(イマイ・シュンスケ)
研修生(研究当時)金子 舜(カネコ・シュン)
研修生(研究当時)浅尾 信央(アサオ・ノブアキ)
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(シロウズ・ミカコ)
専任研究員 久野 玉雄(ヒサノ・タマオ)
専門技術員 加茂 友美(カモ・トモミ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業(RNA標的創薬技術開発)」による助成を受けて行われました。
原論文情報
Shun Kaneko, Shunsuke Imai, Tomomi Uchikubo-Kamo, Tamao Hisano, Nobuaki Asao, Mikako Shirouzu, and Ichio Shimada, “Structural and Dynamic Insights into the Activation of the μ-Opioid Receptor by an Allosteric Modulator”, Nature Communications, 10.1038/s41467-024-47792-6
発表者
理化学研究所
生命機能科学研究センター 生体分子動的構造研究チーム
チームリーダー 嶋田 一夫(シマダ・イチオ)
(バイオ産業情報化コンソーシアム 特別顧問)
上級研究員 今井 駿輔(イマイ・シュンスケ)
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(シロウズ・ミカコ)
報道担当
理化学研究所 広報室 報道担当
バイオ産業情報化コンソーシアム問い合わせ窓口