2024-05-21 理化学研究所
理化学研究所(理研)脳神経科学研究センター 神経幹細胞研究チームの影山 龍一郎 チームリーダーらの共同研究チームは、神経幹細胞は未分化であるにもかかわらず、遺伝子発現パターンが分化細胞状態にまで連続的に変化することを発見しました。
本研究成果は、神経幹細胞に特徴的な性質である多様な細胞を生み出す能力(多分化能)の分子基盤の理解に貢献すると期待されます。また、不連続な細胞分化過程において遺伝子発現は連続的に変化することが知られていますが、その不一致性の理解にもつながります。
今回、共同研究チームは、マウスの大脳形成期において神経幹細胞が細胞分裂を経て中間前駆細胞に分化する過程の遺伝子発現変化を調べました。神経幹細胞では転写因子[1]Hes1が発現し、中間前駆細胞ではHes1の発現はなくなり別の転写因子Tbr2が発現します。しかし、神経幹細胞の遺伝子発現パターンを詳しく調べたところ、Hes1が発現しTbr2は発現していない状態(Hes1+;Tbr2-)から、Hes1の発現がなくなりTbr2が発現する状態(Hes1-;Tbr2+)、すなわち中間前駆細胞の状態にまで連続的に変化していました。従って、神経幹細胞が中間前駆細胞に分化する過程は不連続ですが、遺伝子発現は神経幹細胞において中間前駆細胞の状態にまで連続的に変化することが分かりました。この結果から、神経幹細胞は今まで考えられていた以上にダイナミックで多様な遺伝子発現パターンを示すことが明らかになりました。
本研究は、科学雑誌『Developmental Cell』オンライン版(5月20日付:日本時間5月21日)に掲載されました。
背景
幹細胞は多様な細胞に分化しますが、一般に細胞分化は不連続に進むことが知られています。例えば、大脳形成過程では、神経幹細胞は細胞分裂を経て中間前駆細胞に分化します。前者は放射状線維と呼ばれる細長い突起を持ち多分化能を有するのに対して、後者は短い突起のみでニューロン分化能しか持っていません。従って、この2種類の細胞は形態的にも能力的にも異なり、またその中間状態を示す細胞は存在しません。このため、神経幹細胞から中間前駆細胞への分化は不連続といえます。
神経幹細胞は転写因子Hes1によって、中間前駆細胞は転写因子Tbr2によって維持されます。最近の単一細胞RNA配列解析[2]では、神経幹細胞が中間前駆細胞に分化する過程で、Hes1の発現量が徐々に減少し、逆にTbr2の発現量が徐々に増加すること、途中でHes1とTbr2との両方を低レベルで発現する細胞も存在することが明らかになりました。従って、神経幹細胞から中間前駆細胞への分化過程における遺伝子発現パターンは連続的に変化しています。このように不連続な細胞分化過程で遺伝子発現パターンは連続的に変化するという不一致性がなぜ見られるのかは、よく分かっていませんでした。この点を理解するために、神経幹細胞から中間前駆細胞への分化過程において中心的な役割を持つ遺伝子に注目し、その発現動態を解析しました。
研究手法と成果
神経幹細胞においてHes1の発現はNotchシグナル[3]によって増加しますが、Hes1はいろいろな遺伝子発現を抑制します。Hes1は自分自身の発現も抑制するので、このネガティブフィードバック[4]を介して自律的に2~3時間周期で発現の増減を繰り返します(発現量が振動します)(図1右上)。まず、神経幹細胞におけるHes1の発現パターンを詳細に解析したところ、非対称分裂[5]をする数時間前にすでにHes1の発現が抑制されていることが分かりました。次に、Notchシグナルの活性型であるNotch細胞内ドメイン(Notch intra-cellular domain:NICD)の量を調べたところ、これは非対称分裂前も特に低下していませんでした。従って、非対称分裂前の神経幹細胞ではNotchシグナルは活性化状態にあるにもかかわらず、Hes1の発現が抑制されていることが分かりました。
そこで、非対称分裂前の神経幹細胞でHes1の発現を抑制する因子について探ることにしました。大脳形成過程の神経幹細胞ではプロニューラル因子[6] Neurog2が発現しています。Neurog2は転写活性化作用を持つので、Neurog2によって発現が誘導される因子の中で、Hes1の発現を抑制するものがあるかどうか検討しました。その結果、いくつかの因子がHes1の発現を抑制できることが分かりましたが、中でも、Tbr2が最も強くHes1の発現を抑制したので、Tbr2に注目して解析を進めることにしました。
Notchシグナルによって神経幹細胞でHes1の発現は活性化されますが、これはNICDがDNA結合因子であるRBPjと複合体を形成し、Hes1プロモーターを活性化することによります(図1)。Tbr2の抑制メカニズムを調べたところ、RBPj結合配列依存的にHes1の発現を抑制すること、さらに、Tbr2はNICDとRBPjの複合体形成に拮抗することが分かりました。従って、Tbr2は神経幹細胞においてNICD-RBPj複合体形成に拮抗することによってHes1の発現を抑制することが明らかになりました。
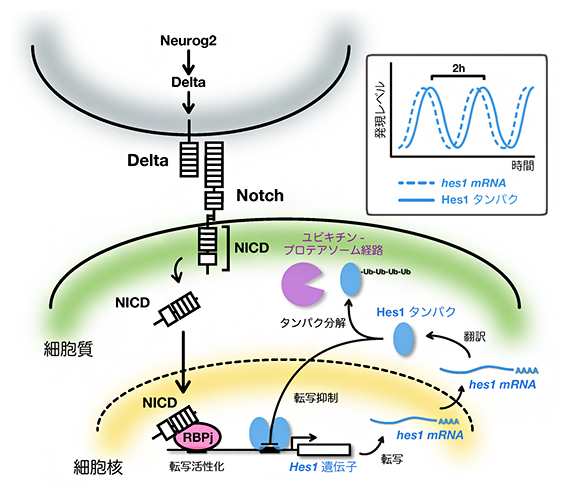
図1 NotchシグナルによるHes1誘導とネガティブフィードバックによるHes1振動
隣接細胞が発現するNotchリガンドDeltaによってNotchシグナルが活性化すると、Notchタンパク質は切断されて活性型フォームであるNICDが形成される。NICDは核内に移行し、DNA結合因子RBPjと複合体を形成してHes1の発現を誘導する。一方、Hes1タンパク質は自身の発現を抑制する。このネガティブフィードバックを介してHes1の発現は、自律的に2~3時間周期で振動する(右上枠内)。
次に、非対称分裂前後のHes1、Neurog2、Tbr2の発現パターンをライブイメージング技術で解析しました。神経幹細胞ではHes1の発現振動によって周期的に抑制されるために、Neurog2の発現も2~3時間周期で振動します(図2)。Tbr2タンパク質は安定なため、Neurog2の発現振動によって神経幹細胞内で徐々に蓄積しました。さらに、神経幹細胞内でTbr2がある一定量まで蓄積するとHes1の発現は抑制されました。神経幹細胞が非対称分裂した後、Tbr2タンパク質は両方の娘細胞にほぼ均等に分配されました。しかし、娘細胞の内、神経幹細胞ではやがてTbr2の発現は消え、Hes1の発現が復活しました。一方、もう一つの娘細胞である中間前駆細胞ではTbr2の発現は維持され、Hes1の発現は消えたままでした。従って、非対称分裂前の神経幹細胞ではNeurog2によるTbr2の誘導によってHes1の発現がなくなること、このTbr2が発現してHes1は発現しない状態が中間前駆細胞で継続することが明らかになりました。
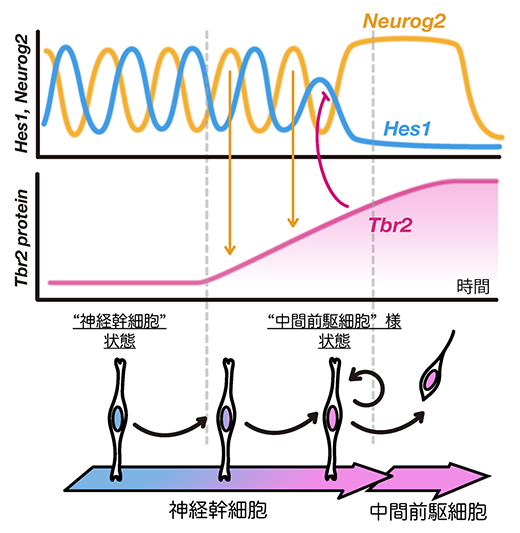
図2 Neurog2-Tbr2によるHes1抑制
神経幹細胞では、Hes1の発現振動によって周期的に抑制されるために、プロニューラル因子Neurog2の発現も振動する。Neurog2によってTbr2の発現が誘導されるが、Tbr2タンパク質は安定なため、徐々に蓄積する。Tbr2タンパク質はある一定量蓄積するとHes1の発現を抑制する。Tbr2+;Hes1-になった神経幹細胞は非対称分裂をし、娘細胞の一つは中間前駆細胞に分化する。もう一つの娘細胞は神経幹細胞にとどまるが、Tbr2+;Hes1-からTbr2-;Hes1+に戻る。
最後に、Nestin-CreERT2;Tbr2 floxマウス[7]にタモキシフェン[7]を投与することで神経幹細胞特異的にTbr2をノックアウト[8]しました。その結果、神経幹細胞でのHes1の発現が増加して非対称分裂の頻度が顕著に低下し、中間前駆細胞は減少しました。光遺伝学的手法[9]で野生型の神経幹細胞に青色光をパルス状に照射してNeurog2の発現を誘導すると、Tbr2の発現が誘導されてHes1の発現が抑制されましたが、Tbr2をノックアウトした神経幹細胞で同じようにNeurog2の発現を誘導してもHes1の発現は抑制されませんでした。従って、Neurog2-Tbr2によってHes1の発現が抑制されることによって神経幹細胞は非対称分裂を行い、中間前駆細胞を産生することが明らかになりました。
以上の結果から、神経幹細胞内でHes1+;Tbr2-という神経幹細胞に特徴的な遺伝子発現状態からHes1-;Tbr2+という中間前駆細胞に特徴的な遺伝子発現状態に連続的に変化すること、そして中間前駆細胞に特徴的な発現状態になった神経幹細胞は非対称分裂して中間前駆細胞を産生することが分かりました。このことから、神経幹細胞は典型的な未分化状態から分化状態まで多様な遺伝子発現パターンを連続的に示すことが明らかになり、これが多分化能の分子基盤であることが強く示唆されました。
今後の期待
神経幹細胞は、未分化状態から分化状態と同じ遺伝子発現パターンを持つことが分かり、今まで考えられていた以上にダイナミックな遺伝子発現動態を示すことが明らかになりました。大人の脳にも神経幹細胞は存在しますが、大部分は休眠状態で加齢とともにその状態から目覚めなくなります。休眠状態の神経幹細胞ではダイナミックな遺伝子発現動態が失われていることが知られています。
しかし、ダイナミックな発現動態を復活させると神経幹細胞は休眠状態から目覚めやすくなり、大人の脳でもニューロンを新たに産生できること(ニューロン新生)が分かっています。今後、遺伝子発現動態の操作技術が発展すれば、認知症においてもニューロン新生を活性化することで脳機能の回復が期待できます。今回の研究成果から、遺伝子発現動態の意義が明らかになりましたので、この発見を応用に向けて発展させていきたいと考えています。
補足説明
1.転写因子
遺伝子に作用してその発現を制御するタンパク質の総称。特に、発現量を増やす転写因子は転写活性化因子、発現量を減らす転写因子は転写抑制化因子と呼ばれる。
2.単一細胞RNA配列解析
単離した1細胞ごとに全遺伝子のRNA発現量の解析を行う手法のこと。細胞の多様性や不均一性を見るのに適している。
3.Notchシグナル
隣接細胞間の情報伝達機構で、隣接細胞がDeltaを発現していると、Notchシグナルが活性化する。その結果、Hes1の発現が誘導され、神経幹細胞が維持される。Notchシグナルが働かないと、神経幹細胞が枯渇するため、脳は十分に成長できない。
4.ネガティブフィードバック
自分自身の活性や発現量を抑制する作用のこと。Hes1は自分自身の遺伝子に作用して発現量を減らすので、NotchシグナルによってHes1の発現量が増えると自分自身の発現量を減らすように働く。Hes1の発現量が減るとネガティブフィードバックが解除されるので、またNotchシグナルによってHes1の発現量が増える。従って、Hes1の発現量はネガティブフィードバックによって自律的に振動する。
5.非対称分裂
非対称に細胞が分裂し、異なる2種類の娘細胞が形成される細胞分裂様式。神経幹細胞は非対称分裂することで、一般に1個の神経幹細胞と1個の中間前駆細胞に分かれる。
6.プロニューラル因子
神経幹細胞からニューロン分化を促進する転写因子の総称。
7.Nestin-CreERT2;Tbr2 floxマウス、タモキシフェン
このマウスでは、Nestin遺伝子のプロモーターから非活性型DNA組換え酵素CreERT2が神経幹細胞に発現する。さらに、Tbr2の遺伝子にflox配列が2カ所挿入されている。抗エストロゲン薬であるタモキシフェンを投与すると、CreERT2は活性型になり、2カ所のflox配列に挟まれたTbr2の遺伝子領域が除去される。その結果、神経幹細胞特異的にTbr2遺伝子はノックアウトされる。
8.ノックアウト
遺伝子配列を除去することで特定遺伝子の機能を欠損させる手法。
9.光遺伝学的手法
光照射によって活性が制御されるタンパク質をコードする遺伝子を細胞に導入することで、光によって細胞機能を制御する手法のこと。ここでは、青色光照射で遺伝子発現を誘導できるシステムを用いた。2時間ごとに青色光を照射することによってNeurog2を2時間周期でパルス状に発現誘導する(振動させる)ことが可能。
共同研究チーム
理化学研究所 脳神経科学研究センター 神経幹細胞研究チーム
チームリーダー 影山 龍一郎(カゲヤマ・リョウイチロウ)
研究パートタイマーⅠ 正木 大夢(マサキ・タイム)
大阪大学大学院 生命機能研究科
助教 下條 博美(シモジョウ・ヒロミ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業特別推進研究「短周期振動する遺伝子発現の生理学的意義について(研究代表者:影山龍一郎)」、同基盤研究(C)「細胞運命決定のタイミングを制御する分子タイマーの実体と時間制御機構(研究代表者:下條博美)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)「成体脳神経幹細胞の機能低下メカニズムの解明と再活性化に向けた技術開発(研究代表者:影山龍一郎)」による助成を受けて行われました。
原論文情報
Hiromi Shimojo, Taimu Masaki, Ryoichiro Kageyama, “The Neurog2-Tbr2 axis forms a continuous transition to the neurogenic gene expression state in neural stem cells”, Developmental Cell, 10.1016/j.devcel.2024.04.019
発表者
理化学研究所
脳神経科学研究センター 神経幹細胞研究チーム
チームリーダー 影山 龍一郎(カゲヤマ・リョウイチロウ)
報道担当
理化学研究所 広報室 報道担当