2020-07-10 千葉県こども病院,順天堂大学,埼玉医科大学,日本医療研究開発機構
千葉県こども病院遺伝診療センター・代謝科の研究グループは、順天堂大学、埼玉医科大学との共同研究により、新生児の重篤なミトコンドリア心筋症を呈する日本人症例のゲノム解析を行い、ATAD3遺伝子クラスターの重複が発症に関与することを同定しました。また、オーストラリア等との国際共同研究として大規模な解析を行い、16家系で同様の重複を見つけたことを報告しました。
発表のポイント
- 新生児の重篤なミトコンドリア心筋症*1患者から、ATAD3 (ATPase family, AAA domain-containing, member 3) 遺伝子クラスターにおける重複を同定し、Cell出版社のトランスレーショナルリサーチ雑誌Medに報告しました。
- ATAD3ファミリー遺伝子であるATAD3A、ATAD3B、ATAD3Cは1番染色体上に並んで存在しており、これらの遺伝子間の異常な相同組換え*2が重複を引き起こし、ミトコンドリア心筋症の原因となることを明らかにしました。
- ATAD3遺伝子の重複はATAD3A/Cの融合遺伝子を生じていました。これによって生み出されるATAD3A/C融合タンパク質がATAD3複合体形成の異常を誘導し、ミトコンドリア機能異常を引き起こしていることが示唆されました。
- 本邦でも4症例がATAD3遺伝子の重複を呈することを明らかにしましたが、海外の共同研究グループも同様の重複を発見し、計16家系、17患者で遺伝子異常がみつかりました。ミトコンドリア心筋症は近年症例数が増加していますが、ATAD3遺伝子の重複がこれほどまでに多くみつかったことから、潜在的に多くのミトコンドリア心筋症の患者において同様の遺伝子異常を持つ可能性が示唆されました。
概要
千葉県こども病院の村山圭・部長のグループは、順天堂大学・難病の診断と治療研究センターの岡﨑康司教授(センター長)、埼玉医科大学小児科/ゲノム医療科の大竹明教授らとともに、ミトコンドリア心筋症からゲノム解析研究を通じて、新たにATAD3遺伝子の重複を見出しました(図1)。先行研究において、著者らのグループは小脳異常を呈するミトコンドリア病症例からATAD3における欠失を発見し、2017年に英科学雑誌Brain誌に報告していました。このATAD3遺伝子の欠失は多くの場合、両親から遺伝して、父方と母方の両方の染色体上に遺伝子欠損を有するのに対し、今回同定されたATAD3遺伝子の重複は両親が遺伝子異常を持たず、患者本人のみがもつde novo遺伝子異常*3により生じることが明らかとなりました。同一の遺伝子ファミリーの異常ではありますが、欠失と重複では病型に大きな違いがあることから、疾患発症機構にも差異があると考えられました。ATAD3遺伝子領域のゲノム配列の複雑さゆえに、これまで疾患原因としては明らかになってきませんでしたが、この研究の中で示したように17患者と非常に多くの症例がATAD3遺伝子の重複を有していたことから、今後も同様の遺伝子異常を持つ症例が数多く見つかってくることが予想されます。遺伝子診断の向上のみならず、今回の発見が治療への足掛かりとなることも期待されます。
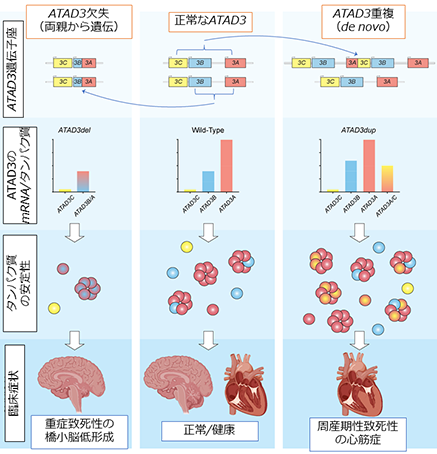
図1. ATAD3の遺伝子異常で生じるミトコンドリア病:ATAD3の欠失は両親から遺伝し、患者では2つの遺伝子座の欠失が起こり、ATAD3B/Aの融合遺伝子が合成されます。ATAD3B/Aのタンパク質は非常に不安定であり、致死性の橋小脳低形成につながります。ATAD3遺伝子の重複は両親から遺伝せず、de novo変異が片側の染色体上で生じます。ATAD3Bの1コピー増加、ATAD3A/C融合遺伝子が生じることで、タンパク質総量の増加が起こります。ATAD3A/C融合タンパク質はATAD3複合体の形成に異常を引き起こし、これが重篤な心筋症につながると考えられます。
本研究は、日本医療研究開発機構(AMED)「難治性疾患実用化研究事業」、厚生労働省、文部科学省、日本学術振興会などの支援によって行われたもので、研究成果は、日本時間2020年7月10日(金)0時(報道解禁日時:米国東部標準時2020年7月9日11時)にCell出版社のMedオンライン版に発表されます。
研究の背景
ミトコンドリア病は5000人に1人が発症するとされる難病として知られています。我々は、2015年度から日本医療研究開発機構 (AMED) による「ミトコンドリア病診療の質を高める、レジストリシステムの構築、診断基準・診療ガイドラインの策定および診断システムの整備を行う臨床研究」、2016年から「創薬を見据えた、ミトコンドリア病の新規病因遺伝子の発見とその病態解明」、2017年から「ミトコンドリア病診療マニュアルの改訂を見据えた、診療に直結させるミトコンドリア病・各臨床病型のエビデンス創出研究」、2020年から「多様なミトコンドリア病の遺伝子型/表現型/自然歴等をガイドラインに反映させていくエビデンス創出研究」および「長鎖・短鎖シーケンシング技術の統合による構造変異の検出と非翻訳領域情報を駆使した未診断症例の解決」を通して、日本におけるミトコンドリア病診療の基盤構築に寄与してきました。また、AMEDの臨床ゲノム情報統合データベース整備事業における研究開発課題として「希少・難治性疾患領域における臨床ゲノムデータストレージの整備に関する研究」および「真に個別患者の診療に役立ち領域横断的に高い拡張性を有する変異・多型情報データベースの創成」、「日本人小児ミトコンドリア病の固有VUSに対する網羅的な機能的アノテーション」に関する研究を行い、ミトコンドリア病のゲノムデータ登録にも携わってきました。特にミトコンドリア病の原因は多岐に渡っており、ゲノム解析により原因遺伝子を明らかにし、確定診断を行うことで、その後のレジストリや創薬につなげていくことが我々の大きな使命となっています。
ATAD3ファミリー遺伝子は1番染色体に位置し、ATAD3A、ATAD3B、ATAD3Cのクラスターを形成しています。これまでにATAD3Aの遺伝子異常あるいはATAD3AおよびATAD3B、ATAD3Cにまたがった欠失は中枢神経系の異常を呈するミトコンドリア病の発症に関与することが知られていました。ATAD3遺伝子クラスターでは、遺伝子間の配列の類似性が高いためゲノム解析は困難を極めていました。今回の研究では、全エクソーム解析および全ゲノム解析*4の手法を駆使して、複雑な遺伝子異常を読み解き、新たにATAD3遺伝子領域で重複が生じ、ミトコンドリア心筋症を発症することを明らかにしました。
ATAD3遺伝子の重複によるミトコンドリア心筋症の特徴
ATAD3遺伝子の重複によって生じるミトコンドリア心筋症は、周産期から発症する致死的心筋症、持続性高乳酸血症、角膜混濁または白内障、脳症を呈します。一方、ATAD3欠失では、中枢神経を中心とした小脳委縮等が特徴的な所見となり、心筋症は報告されていません。本邦の4症例を含め、計16家系、17患者で異常が見つかりました。日本以外では、オーストラリア、ニュージーランド、オランダで同様の症例が発見されました。多くの症例では、出生以前の胎児期から症状を呈しており、新生児早期に非常に重篤な症状を有することが分かりました。
ATAD3遺伝子の重複の同定
全ゲノム解析および全エクソーム解析で、ATAD3遺伝子クラスターにおけるATAD3遺伝子の重複が同定されました(図2)。結果として、この重複はATAD3Bが1コピー増えることと、ATAD3A/Cの融合遺伝子が生じることになります(図2A)。症例によってATAD3A/Cの融合遺伝子の形が若干異なりますが、多くはATAD3Aのエクソン11とATAD3Cのエクソン8で融合した遺伝子産物ができることが分かりました(図2B)。また、家族内の解析を行った結果、両親にはこの重複は観察されず、患者でde novo遺伝子異常として生じ、優性阻害効果を示すことが明らかになりました。
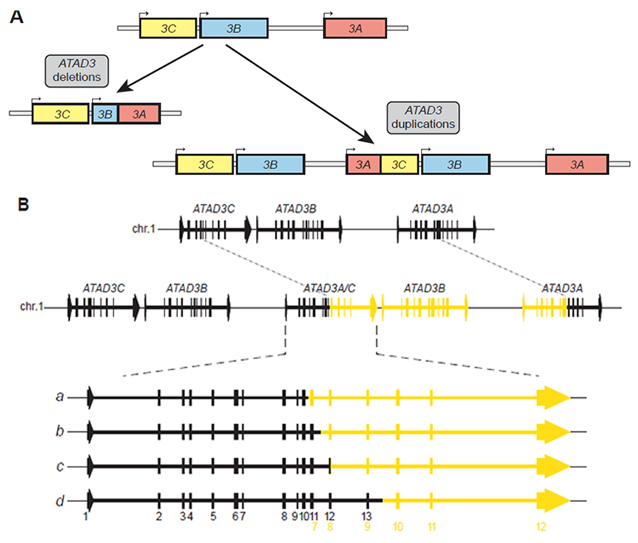
図2.ATAD3遺伝子の重複に伴う遺伝子構造の変化:(A)ATAD3の欠失ではATAD3B-ATAD3A間で組換えが起こることでATAD3BとATAD3Aの融合遺伝子が生成されます。一方、ATAD3遺伝子の重複では、ATAD3Cの一部とATAD3Bの全長、ATAD3Aの一部が新たに挿入され、結果としてATAD3Bの1コピー増加とATAD3AとATAD3Cの融合遺伝子が生成されます。(B)ATAD3A/C融合遺伝子が生成されますが、その構造変化には4パターンあることが明らかになりました。最も多かったのは、bのパターンで、ATAD3Aのエクソン1から11とATAD3Cのエクソン8-12をもつ融合遺伝子が生成されていました。
ATAD3A/C融合タンパク質のATAD3機能阻害
上述の通り、ATAD3遺伝子の重複はATAD3A/C融合タンパク質を生じることになります。ATAD3A/Cが実際に生体内で発現していることは、プロテオーム解析*5やウエスタンブロット*6などで確認されました。次に、ATAD3の複合体形成を確認しましたが、ATAD3遺伝子の重複を持つ症例では、正常検体に比べてATAD3複合体形成が変化していることが明らかとなりました(図3A)。また、同時にミトコンドリア呼吸鎖複合体*7形成にも異常をきたしており、ATAD3遺伝子の重複はATAD3複合体の異常を介して、ミトコンドリア機能異常を引き起こしていることが示唆されました(図3B)。
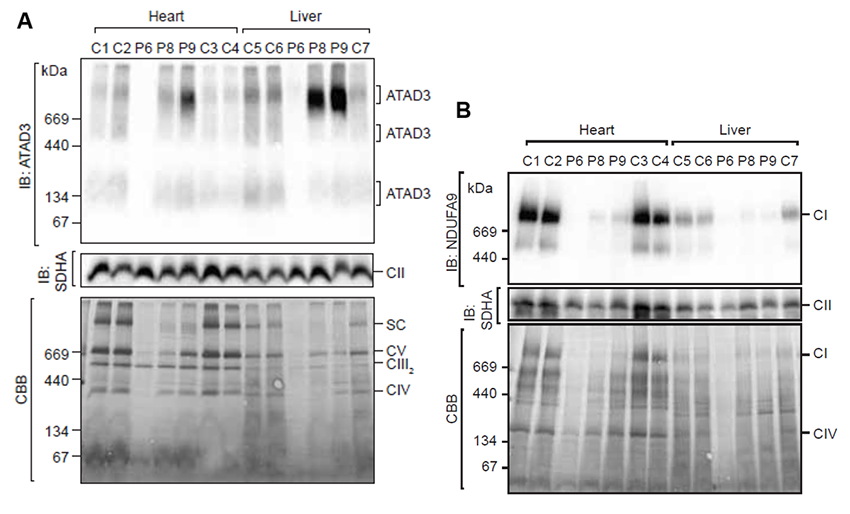 図3.ATAD3A/C融合タンパク質のATAD3複合体形成異常およびミトコンドリア呼吸鎖複合体障害:(A)分子量900kDaあたりに生じるATAD3複合体形成は患者(P8、P9)の筋肉や肝臓で増加しておりATAD3複合体の形成に大きな変化を与えていると考えられました。
図3.ATAD3A/C融合タンパク質のATAD3複合体形成異常およびミトコンドリア呼吸鎖複合体障害:(A)分子量900kDaあたりに生じるATAD3複合体形成は患者(P8、P9)の筋肉や肝臓で増加しておりATAD3複合体の形成に大きな変化を与えていると考えられました。
(B)ミトコンドリア呼吸鎖複合体は患者(P6、P8、P9)の筋肉や肝臓で形成不全を生じており、ATAD3A/C融合タンパク質が異常なATAD3複合体形成を起こすことで、ミトコンドリア機能障害を引き起こしたものと考えられました。SC:呼吸鎖超複合体、CI:呼吸鎖複合体I、CII:呼吸鎖複合体II、CIII2:呼吸鎖複合体III、CIV:呼吸鎖複合体IV
まとめ
今回の研究により、ATAD3遺伝子の重複がミトコンドリア心筋症の原因として、国内外合わせ患者17症例から同定されました。ATAD3遺伝子の重複は、ATAD3Bのコピー数増加とATAD3A/C融合遺伝子を生じ、特に融合遺伝子がミトコンドリア機能の阻害をもたらしていると考えられました。ATAD3遺伝子の異常は、点変異あるいは、大きな欠失、重複によっても起こり、様々な遺伝子の構造的異常や遺伝形式をとることが明らかになりました。症状においても、中枢神経の異常のみならず、今回の重複例では新たに心筋症を主症候とすることが分かり、症状の多様性も明らかとなりました。また、これまでATAD3領域の構造的複雑さから遺伝子異常の検出が難しかったという点で、遺伝子異常が見過ごされてきた可能性が示唆されています。我々の研究で遺伝子異常の詳細を明らかにしたことで、今後同様の遺伝子異常を持つ症例が新たに見つかる可能性が高く、遺伝子診断の精度向上にも貢献すると考えられます。また、ATAD3遺伝子の重複に関しては、ATAD3A/Cの異常な融合タンパク質が疾患発症に寄与している可能性が高いことから、このタンパク質の消去が創薬や治療法の鍵となると期待されます。さらなる病態発症メカニズムの解明が疾患克服に直結すると考えられることから、継続した研究への取り組みが重要になります。
- 掲載論文
- Fatal perinatal mitochondrial cardiac failure caused by recurrent de novo duplications in the ATAD3 locus
- 著者名
- Ann E. Frazier, Alison G. Compton, Yoshihito Kishita, Daniella H. Hock, AnneMarie E. Welch, Sumudu S.C. Amarasekera, Rocio Rius, Luke E. Formosa, Atsuko Imai-Okazaki, David Francis, Min Wang, Nicole J. Lake, Simone Tregoning, Jafar S. Jabbari, Alexis Lucattini, Kazuhiro R. Nitta, Akira Ohtake, Kei Murayama, David J. Amor, George McGillivray, Flora Y. Wong, Marjo S. van der Knaap, R. Jeroen Vermeulen, Esko J. Wiltshire, Janice M. Fletcher, Barry Lewis, Gareth Baynam, Carolyn Ellaway, Shanti Balasubramaniam, Kaustuv Bhattacharya, Mary-Louise Freckmann, Susan Arbuckle, Michael Rodriguez, Ryan J. Taft, Simon Sadedin, Mark J. Cowley, André E. Minoche, Sarah E. Calvo, Vamsi K. Mootha, Michael T. Ryan, Yasushi Okazaki, David A. Stroud, Cas Simons, John Christodoulou, David R. Thorburn
- 雑誌名
- Med
用語解説
- *1 ミトコンドリア心筋症
- ミトコンドリア病とは、ミトコンドリアの働きが低下することが原因で起こる病気の総称です。出生 5,000人に 1人の割合で発症し、さまざまな臓器・組織でさまざまな症状を呈し、何歳でも、さまざまな遺伝形式によって発病します。ミトコンドリア心筋症はそのうち心筋異常を主症候とするサブタイプに分類され、我々の予後調査では早期に心筋症を呈するミトコンドリア病は非常に予後不良で、重症化を招くことが明らかとなっています。
- *2 相同組換え
- 生物のゲノムには相同配列という類似性をもつ配列が点在しています。特に、ファミリー遺伝子は進化上、同一遺伝子が重複することで増えてきた過程があるため、相同配列を多く持っています。このようなことから、遺伝子の相同配列において異常な組換えが起こり、遺伝子の欠失や重複などにつながります。
- *3 de novo遺伝子異常
- de novoとは直訳で“新生の”という意味を持ち、新たに生成された遺伝子異常となります。親はこれらの遺伝子異常を持たず,子で新しく発生した遺伝子異常を指します。DNA複製過程でエラーが生じ、点変異、挿入、重複、欠失、染色体レベルの構造変化まで,さまざまな異常が起こります。
- *4 全エクソーム解析、全ゲノム解析
- 全エクソーム解析(Whole-exome sequencing; WES)は、ゲノムのなかでタンパク質をコードするエクソン領域を選択的に配列解読する手法です。対象となるのはヒトゲノムのうち2%未満の領域となります。エクソンは、極めて重要な領域なため、ここに多くの疾患原因となる変異が存在しています。それに対して、全ゲノム解析(Whole-genome sequencing; WGS)は、ゲノムのすべてを網羅して配列解読する手法です。すべてのゲノム領域をカバーするため、WESよりも得られる情報は多くなります。
- *5 プロテオーム解析
- タンパク質を網羅的に調べる手法で、タンパク質の増加減少を明らかにすることができます。プロテオーム(Proteome)はタンパク質Protein と「全体」を意味する -omeに由来した言葉です。
- *6 ウエスタンブロット
- 特定のタンパク質に結合する抗体を用いて、タンパク質を検出する方法です。この方法で、生体試料中のタンパク質の存在量を観察することができます。
- *7 ミトコンドリア呼吸鎖複合体
- ミトコンドリアでは電子伝達と酸化的リン酸化の反応を介して、生命のエネルギー源であるATPを合成していますが、ミトコンドリア呼吸鎖複合体のI~Vまでがその合成に関わります。複合体I~IVは、酸化還元反応を利用し、ミトコンドリア内膜を介してプロトン(H+)を輸送します。複合体Ⅴは逆向きのプロトンの流れを利用してATPを作り出します。
お問い合わせ先
本件に関するお問い合わせ先
千葉県こども病院
事務局医事経営課
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
ゲノム・データ基盤事業部医療技術研究開発課
難治性疾患実用化研究事業担当