2021-04-27 理化学研究所,日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センター脳画像解析開発ユニットのヘンリック・スキッベユニットリーダー、脳発達分子メカニズム研究チームの下郡智美チームリーダーらの共同研究グループ※は、「コモンマーモセット[1]」(マーモセット)というサルの脳内に発現する発達障害を含む精神・神経疾患に関わる遺伝子を掲載した遺伝子発現データベースを公開しました(Marmoset Gene Atlas )。
本研究成果は、ヒトでの精神・神経疾患の原因となる脳領域の特定や神経回路の機能異常の原因究明につながると期待できます。
小型のマーモセットは従来の大型サルと比較して、成長が早く繁殖効率も良いことから、近年、新たな脳神経科学のモデル動物として注目されています。
今回、共同研究グループは、マーモセット脳内の精神・神経疾患に関わる遺伝子を中心に2,000個以上の遺伝子発現パターンをデータベースとして公開しました。また、網羅的な遺伝子発現解析の結果、精神・神経疾患に関わる遺伝子がクラスターを作って特定の脳領域や神経細胞に発現していることが明らかになりました。そしてマーモセット、マウス、ヒトの脳の発現パターンを比較したところ、マーモセットとヒトでは共通する発現が多く発見されました。さらに、ヒト脳のデータと直接比較できるように、三次元で立体的にマーモセット脳の遺伝子発現を可視化する技術「大脳皮質遺伝子発現プロジェクションマッピング」を開発しました。
本研究は、科学雑誌『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』オンライン版に掲載されます。
- ※共同研究グループ
- 理化学研究所 脳神経研究センター
- 脳発達分子メカニズム研究チーム
- 研究員(研究当時) 喜多 善亮(きた よしあき)
- テクニカルスタッフII 西部 弘純(にしべ ひろずみ)
- テクニカルスタッフII 王 燕(オウ エン)
- 客員研究員(研究当時) 端川 勉(はしかわ つとむ)
- テクニカルスタッフII 菊池 里美(きくち さとみ)
- テクニカルスタッフI 禹 麻美(う まみ)
- テクニカルスタッフII 吉田 彩(よしだ あや)
- テクニカルスタッフII 吉田 千尋(よしだ ちひろ)
- チームリーダー 下郡 智美(しもごおり ともみ)
- 脳画像解析開発ユニット
- ユニットリーダー ヘンリック・スキッべ(Henrik Skibbe)
- 京都大学大学院 情報学研究科 システム科学専攻 システム情報論講座
- 研究員 川瀬 貴士(かわせ たかし)
- 教授 石井 信(いしい しん)
- 研究支援
- 本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明(革新脳)」の「マーモセット遺伝子発現アトラスの開発(領域代表者:下郡智美)」、米国国立保健医療科学院(NIPH)U01による支援を受けて行われました。
背景
霊長類の脳がどのように形成され、機能しているのかを明らかにすることは、ヒトの高次脳機能の理解や精神・神経疾患の発症メカニズムの解明、精神・神経疾患の治療法の開発などにつながります。そのためには、まず脳の「どこに」「いつ」「どのような」遺伝子が発現するのかという遺伝子発現様式の情報が必要です。これまで、脳発生メカニズムを解明するためにモデル動物として最も多く使われてきたのは、げっ歯類のマウスです。しかし、系統発生的にげっ歯類と霊長類はかけ離れており、生理学的、解剖学的、組織学的にも差が大きいため、研究結果を直接ヒトに当てはめることは困難でした。
また、ヒトに近いとされる大型のマカクサル(カニクイザル、アカゲザル、ニホンザルなど)を用いた実験では、大きな脳切片を扱うことが難しく、脳をいくつかに分割して染色する必要があることから、一度に多数の遺伝子の発現を脳の広い領域で調べることが困難です。しかも、複数の個体の脳を比較するには、経済的、時間的、人的な制約があるため現実的ではありません。
そこで近年では、このような大型サルと比較して、成長が早く繁殖効率の良い小型のサルである「コモンマーモセット」(マーモセット)が新たなモデル動物として注目されています。マーモセットを用いて、脳の広範な領域における複数の遺伝子発現様式、特に精神・神経疾患に関わると考えられる遺伝子を中心に調べることができれば、ヒトの精神・神経疾患の発症メカニズムなどを理解する手掛かりになります。
研究手法と成果
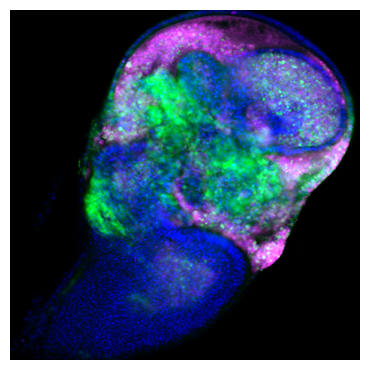
共同研究グループはまず、マーモセットの脳を大まかな機能領域に分けて、発現する遺伝子を網羅的に次世代シークエンサー[2]を用いて解析し、個々の脳領域に存在している遺伝子を絞り込みました。次にその中から、転写因子[3]、酵素活性を持つ因子、神経伝達物質[4]などに関わる機能的に重要な遺伝子群、および発達障害を含む精神・神経疾患(自閉症スペクトラム障害、注意欠陥・多動性障害、統合失調症、双極性障害、てんかん、アルツハイマー病など)に関わるとされる遺伝子群を中心に、in situ ハイブリダイゼーション法[5]という染色法を用いて遺伝子発現様式を調べ、さまざまな遺伝子発現パターンを明らかにすることに成功しました(図1)。
図1 コモンマーモセット脳内でのさまざまな遺伝子発現の様子2,000個以上の遺伝子の発現パターンをデータベースとして公開した。その中のいくつかのイメージサンプル。
そして、解析した全てのデータを遺伝子発現データベースとしてウェブ上で公開しました(Marmoset Gene Atlas )。このデータベースには、2,000個を超える遺伝子の発現パターンが収められており、遺伝子名から遺伝子発現を検索できるだけでなく、選択した脳領域からも遺伝子を検索できます。さらに、精神・神経疾患に関わる遺伝子が疾患ごとにどの脳領域に発現しているのかをリストアップする機能も備わっており、脳神経科学の基礎研究から臨床研究まで広範な研究者が利用できる仕組みになっています。
網羅的な遺伝子発現解析の結果、精神・神経疾患に関わる遺伝子がクラスターを作って特定の脳領域や神経細胞に発現していることが明らかになりました。
また、マーモセットとマウスにおいて特定の脳領域に発現している遺伝子を比較したところ、マーモセットの大脳皮質の第一次視覚野[6]では、酵素活性を持つ遺伝子がマウスよりも多く発現していることが分かりました。マーモセットとマウスでは、大脳皮質第一次視覚野は進化的に保存された領域であるものの、視覚機能には大きな差があります。そのため、視覚野という同じ脳領域を持つ二つの種の間でも、神経細胞の遺伝子発現の進化が異なり、マーモセットではより複雑な神経回路の形成と神経細胞の機能が生み出されたと考えられます。また、マーモセットとヒトの視覚野を比較したところ、多くの遺伝子が類似の発現をしていたことから、マーモセットがヒトのモデル動物として利用できる可能性が高いことが分かりました。
同様に、高次脳機能や情動をつかさどる大脳基底核[7]においても、マーモセットとマウスの遺伝子発現の違いを調べた結果、マーモセットにはマウスよりも多くの細胞種が存在することが分かりました。このことは、霊長類の大脳基底核は、マウスなどのげっ歯類に比べてより多様な細胞種と神経回路から成り立っている可能性を示しています。
さらに、これらのリソースをヒトの核磁気共鳴画像(MRI)[8]データなどと直接比較できるようにするために、三次元で遺伝子発現を可視化する技術「大脳皮質遺伝子発現プロジェクションマッピング」を開発しました(図2)。これを用いると、試料切片上で二次元のデータとして得られる遺伝子発現パターンを三次元化できるため、脳のさまざまな角度から複数の遺伝子の発現パターンを同時に可視化できます。この機能により、ヒト脳で得られるデータとマーモセットの遺伝子発現を直接比較することが可能です。
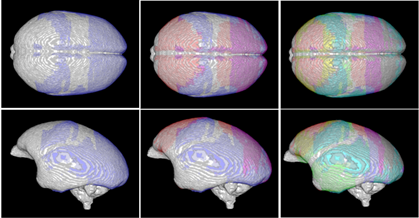
図2 コモンマーモセットの「大脳皮質遺伝子発現プロジェクションマッピング」大脳皮質の遺伝子発現を立体化し、三つの遺伝子発現(青、ピンク、緑で色分け)を重ね合わせることにより新たな脳領域の同定を行うことができる。上段はマーモセットの脳を上から見た図で、左が前、右が後ろである。下段は左脳(左が前、右が後ろ)を示す。
今後の期待
マーモセット脳内におけるさまざまな遺伝子発現を明らかにし、データベースとして公開した本成果は、多くの研究者が利用できるため、さまざまな研究を推進するものと期待できます。
さらに、多くの精神・神経疾患に関わる遺伝子の発現パターンを掲載していることから、それぞれの病態につながる脳領域の同定や、マウスモデルでは明らかにできなかった遺伝子の脳機能への関与を明らかしていくと考えられます。
論文情報
- タイトル
- Cellular-resolution gene expression profiling in the neonatal marmoset brain reveals dynamic species- and region-specific differences
- 著者名
- Yoshiaki Kita, Hirozumi Nishibe, Yan Wang, Tsutomu Hashikawa, Satomi S Kikuchi, Mami U, Aya C Yoshida, Chihiro Yoshida1, Takashi Kawase, Shin Ishii, Henrik Skibbe, and Tomomi Shimogori
- 雑誌
- Proceedings of the National Academy of Sciences of the United States of America(PNAS)
- DOI
- 10.1073/pnas.2020125118
補足説明
- [1] コモンマーモセット
- 南米原産の小型のサル。1度の出産で2~3匹を出産し、雄雌の両方が子育てをする社会性に優れた霊長類である。成体でも体重300~500g程度で、1年半から2年で性的に成熟し繁殖が可能となる。アカゲザル、カニクイザル、ニホンザルなどのマカクサルは繁殖力が低く、室内繁殖が極めて難しく、飼育スペースも大きいことからサンプルの確保が難しい。一方、マーモセットは小型で取り扱いが比較的容易であり、飼育環境を整えやすい。霊長類の中では非常に優れた繁殖効率を持つ。こられの利点から、品質が安定した個体を計画的に繁殖できるため、霊長類の実験動物として計画的なサンプルの確保が可能である。
- [2] 次世代シークエンサー
- サンガー法を利用した蛍光キャピラリーシーケンサーである「第一世代シーケンサー」と対比させて使われている用語。多数のDNA断片を同時並行で解析し、大量の配列を読み取ることができるDNA配列解析装置。
- [3] 転写因子
- 遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子の発現を制御する領域(エンハンサー、プロモーター、サイレンサーなど)に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。
- [4] 神経伝達物質
- シナプス(神経細胞間などに形成される神経活動に関わる接合部位)で情報伝達を介在する物質。セロトニンやドーパミンは代表的な神経伝達物質。
- [5] in situハイブリダイゼーション法
- 特定の遺伝子が体の中のどの細胞で発現しているかを、特定の標識プローブ(同定したい遺伝子と相対的な配列を持つ、短い遺伝子を試験管内で合成時に検出可能なラベルを付けたもの)を用いてmRNAの分布を検出することで、直接細胞や組織中での発現様式を観察できる方法。
- [6] 第一次視覚野
- 研究された全ての哺乳類の脳において、後頭葉に位置し、静止、または運動する対象に関する視覚情報の処理に特化している部分。
- [7] 大脳基底核
- 大脳皮質と視床、脳幹を結び付けている神経核の集まり。運動調節、認知行動、行動の動機づけや情動に関わる。
- [8] 核磁気共鳴画像(MRI)
- 磁力中における水素原子の核スピンの共鳴現象により、人体などの断面撮像を行う装置。脳や血管などの画像診断に広く使われ、磁力を高くすることにより、より高分解能の診断が可能となる。MRIはMagnetic Resonance Imagingの略。
発表者・機関窓口
発表者
理化学研究所 脳神経科学研究センター
脳発達分子メカニズム研究チーム
チームリーダー 下郡 智美(しもごおり ともみ)
脳画像解析開発ユニット
ユニットリーダー ヘンリック・スキッべ (Henrik Skibbe)
機関窓口
理化学研究所 広報室 報道担当
事業に関するお問い合わせ先
日本医療研究開発機構(AMED)疾患基礎研究事業部疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト