2023-08-29 理化学研究所,摂南大学
理化学研究所(理研)開拓研究本部 眞貝細胞記憶研究室の島津 忠広 専任研究員、眞貝 洋一 主任研究員、摂南大学 農学部 応用生物科学科の芳本 玲 講師らの共同研究グループは、CARNMT1(カルノシンメチル基転移酵素1)[1]がタンパク質のヒスチジン残基(His)をpiメチル化(イミダゾール環のN1位置でのメチル化)する酵素であり、哺乳類の胚発生において必須であることを発見しました。
本研究成果は、タンパク質のHisメチル化修飾が果たす生命機能の全容解明に向けた一歩であり、疾患治療や創薬の基礎につながるものと期待されます。
タンパク質のHisメチル化は、イミダゾール環のN1またはN3の位置のいずれかで起こることが知られており、島津専任研究員らは2021年、piメチル化する酵素として初めてMETTL9[2]を報告しました。
今回、共同研究グループは、真核生物に共通した「第2のpiメチル化酵素」としてCARNMT1を同定しました。Carnmt1遺伝子をノックアウトしたマウスは胎生期に死亡したことから、この酵素がマウスの胚発生に不可欠であることが示されました。さらに、CARNMT1はRNA結合タンパク質[3]に見られるC3H型ジンクフィンガーモチーフ[4]のHisをpiメチル化すること、このpiメチル化修飾はRNA結合タンパク質のRNA結合能を変化させ、mRNAの選択的スプライシング[5]やmRNA分解に関わることが明らかになりました。このようなRNA代謝[6]調節は、哺乳類の胚発生に必須な仕組みの一つである可能性があります。
本研究は、科学雑誌『Genes & Development』オンライン版(8月23日付)に掲載されました。
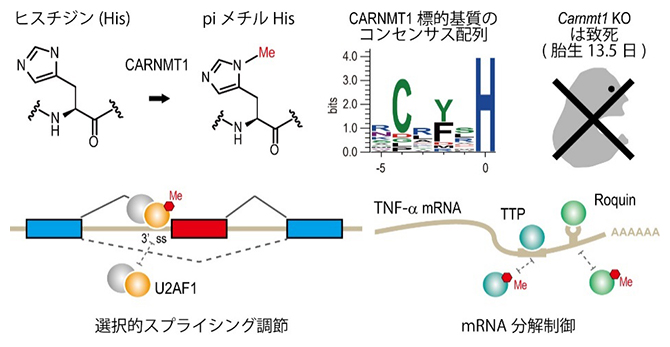
CARNMT1によるタンパク質のヒスチジン残基(His)のpiメチル化修飾
背景
タンパク質の翻訳後修飾[7]は可逆的な分子調節機構として、原核生物から真核生物に至るまで、広く起こることが知られています。ヒトをはじめとした真核生物では、特にヒストンタンパク質のアセチル化やメチル化がエピゲノム[8]制御の中心的な役割を果たすことから、注目を集めています。
タンパク質のヒスチジン残基(His)のメチル化修飾には、イミダゾール環のN1の位置で起こる「piメチル化」と、N3の位置で起こる「tauメチル化」の二つがありますが、その詳細は今なお明らかになっていません。Hisのメチル化が最初に発見されたのは50年以上前で、筋肉の収縮時に働くアクチンやミオシンと呼ばれるタンパク質にtauメチル化されたHisが含まれていることが示されました。しかしそれ以降、tauメチル化を触媒する酵素は不明でした。2018年になり、酵素SETD3がアクチンのHisのtauメチル化に関与し、Hisのtauメチル化がアクチン機能と筋肉収縮性の調節に重要な役割を果たすことが示されました注1、2)。
その発見とほぼ同時期に、島津専任研究員らは、酵素METTL9がさまざまなタンパク質に存在するHisの繰り返し配列(HxH配列)中のHisをpiメチル化すること注3)や、酵素METTL18が哺乳類でリボソームタンパク質RPL3をtauメチル化し、翻訳調節に関わること注4)を発見しました。
注1)Wilkinson,A.W. et al. SETD3 is an actin histidine methyltransferase that prevents primary dystocia. Nature 565, 372-376 (2019).
注2)Kwiatkowski,S. et al. SETD3 protein is the actin-specific histidine N-methyltransferase. Elife. 7, e37921 (2018).
注3)2021年2月9日プレスリリース「ヒスチジン残基をpiメチル化する酵素を発見」
注4)2022年6月21日プレスリリース「リボソームタンパク質に起きる翻訳後修飾の機能」
研究手法と成果
共同研究グループは、これまでタンパク質のメチル化修飾酵素であることがゲノム解析から推定された遺伝子の中で、特にHisのメチル化酵素に着目して解析してきました。そして今回、「第4のHisメチル化酵素(piメチル化酵素としては2番目)」として、CARNMT1(カルノシンメチル基転移酵素1)を同定しました(図1A)。
CARNMT1は、2015年にアミノ酸のβ-アラニンとヒスチジンが結合したカルノシンというジペプチドのHisをpiメチル化する酵素として報告されていました。この酵素がタンパク質のHisもpiメチル化するか調べたところ、CARNMT1遺伝子をノックアウト(KO)したヒト細胞では、タンパク質Hisのpiメチル化の量が半分程度に減少すること、METTL9遺伝子とCARNMT1遺伝子をダブルノックアウトしたヒト細胞では、piメチル化が検出されないことが分かりました(図1B)。このことは、CARNMT1がMETTL9とともに、タンパク質Hisのpiメチル化を担う中心酵素であることを示しています。
さらに、Carnmt1遺伝子をノックアウトしたマウスは胎児期(胎生13.5日前後)に死亡したことから、CARNMT1はマウスの胚発生において必須の役割を担っていることが分かりました(図1C)。さらに、CARNMT1によってpiメチル化される標的基質を探索した結果、RNA結合タンパク質に多く見られるC3H型ジンクフィンガーモチーフ(C3H-ZF、CxxxH)を持つタンパク質が多数見つかりました(図1D)。
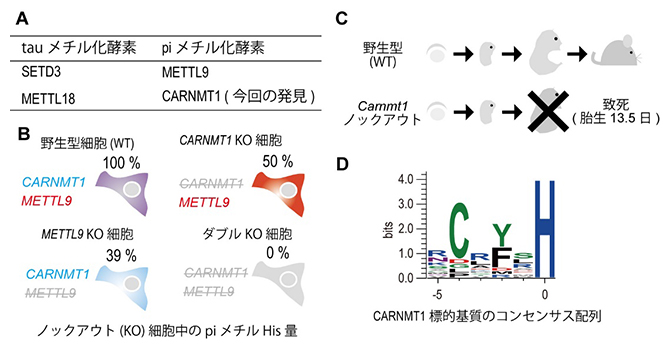
図1 タンパク質Hisのpiメチル化酵素として、CARNMT1を同定
A.タンパク質Hisメチル化酵素の種類。CARNMT1がMETTL9に次ぐ、第2のpiメチル化酵素であることを発見。
B.ノックアウト(KO)ヒト細胞に含まれるタンパク質His piメチル化の割合。野生型に比べて、CARNMT1 KO細胞では50%、METTL9 KO細胞では39%に低下し、両方の遺伝子をKOした細胞は検出限界以下(0%)になった。
C.Carnmt1遺伝子のKOマウスでは胎児期に死亡したことから、CARNMT1がマウスの胚発生に必須の遺伝子であることが分かった。
D.CARNMT1によってメチル化修飾を受けやすい共通配列(コンセンサス配列)はCxxxHであり、これはC3H型ジンクフィンガーモチーフ(C3H-ZF)と同一であった。
次に、CARNMT1によってHisのpiメチル化を受けるC3H型ジンクフィンガーモチーフを持つタンパク質のうち、スプライシング[5]因子であるU2AF1[9]と、TNF-α[10]のmRNAの分解に関わるTristetraprolin(TTP)[11]およびRoquin[12]について解析しました。その結果、U2AF1の37番目のHis(His37)のpiメチル化がなくなると、mRNA前駆体の3’スプライス部位(イントロン[5]の3’末端で、エクソン[5]との境界)への結合が抑制され、エクソンスキップ[13]が起こることが判明しました(図2A)。これは、mRNAの選択的スプライシングがCARNMT1によって調節されていることを示しています。
一方、Roquin(His438)やTTP(His120/His158)はpiメチル化によってTNF-αのmRNAとの結合が阻害され、TNF-αのmRNAの分解が抑制されることが分かりました(図2B)。このようなRNA代謝の調節は、哺乳類の胚発生に必須な仕組みの一つである可能性があります。
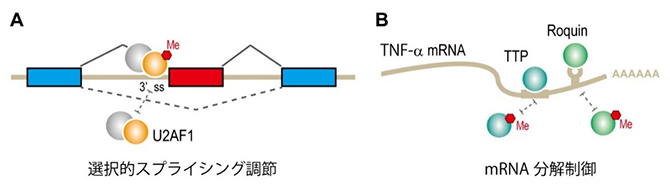
図2 CARNMT1によるHisのpiメチル化の働き
A.U2AF1は、mRNA前駆体の3’スプライスサイト(3’ss)を認識して結合するタンパク質である。U2AF1の37番目のHis(His37)はほぼ100%の割合でpiメチル化を受けているが、CARNMT1がなくなるとそのpiメチル化はほぼ完全に消失する。ある種のmRNA前駆体の3’ss結合が弱まることで、選択的スプライシングのパターンが変化した。
B.TTPおよびRoquinは、TNF-αのmRNAの3′-UTR(非翻訳領域)に結合して分解を促進する。TTPやRoquinがCARNMT1によりpiメチル化されると、mRNAとの結合が弱まり、mRNAの分解が抑制された。
今後の期待
今回、CARNMT1がタンパク質のHisのpiメチル化を担う第2のメチル化酵素であり、マウスの胚発生において必須の働きをすることが初めて明らかになりました。本研究は、従来の分子生物学では知られていなかった「Hisのpiメチル化による生命機能制御」という新しい役割を示したものです。
今後は、RNA結合タンパク質のHisの翻訳後修飾がどのようなメカニズムでマウスの胎児期に決定的に重要であるのか、あるいは成体においてHisのpiメチル化がどういった生理機能を果たしているのかを明らかにすることで、哺乳類の胚発生の仕組みやその破綻による疾患の理解、さらには創薬研究へと応用展開することが期待されます。
補足説明
1.CARNMT1(カルノシンメチル基転移酵素1)
β-アラニンとヒスチジンから成るジペプチドのカルノシンをpiメチル化する酵素として2015年に報告された。7βストランド型のメチル化酵素ドメインを持ち、ヒトから酵母まで真核生物に広く保存されている。
2.METTL9
初めて同定されたタンパク質のヒスチジン残基piメチル化酵素。7βストランド型のメチル化酵素ドメインを持ち、ヒトからショウジョウバエ、線虫に至るまで多くの真核生物に存在し、さまざまなタンパク質の繰り返しヒスチジン配列(HxH配列)中のヒスチジン残基をpiメチル化する。
3.RNA結合タンパク質
細胞内の一本鎖または二本鎖RNAに結合するタンパク質で、RNAの働きを制御する。RNA結合タンパク質には、RNA認識モチーフやRNA結合ドメイン(ジンクフィンガーモチーフなど)など、さまざまな構造モチーフが含まれる。
4.C3H型ジンクフィンガーモチーフ
ジンクフィンガーモチーフは、DNAやRNAに結合する性質を持つタンパク質の部分構造の一つであり、C3H型、C2H2型などの複数のタイプが存在する。このうち、C3H型ジンクフィンガーモチーフは特にRNAに結合する性質を持つ。
5.選択的スプライシング、スプライシング、イントロン、エクソン
スプライシングは、DNAから転写されたmRNA前駆体に含まれるタンパク質の配列情報を持たない領域(イントロン)を取り除き、持つ領域(エクソン)を連結する反応のこと。一つのmRNA前駆体から特定のエクソンを取捨選択することで、多種の成熟mRNAができるスプライシングを選択的スプライシングという。
6.RNA代謝
RNAの転写開始、5’キャッピング、転写伸長、スプライシング、3’末端プロセシング、転写終結およびその後の輸送、翻訳、分解に至るまで、すなわちRNAの合成から分解までの全ての過程のことを指す。
7.翻訳後修飾
タンパク質が生合成された後(翻訳後)に、タンパク質へ付加されるさまざまな修飾のこと。リン酸化、アセチル化、メチル化、糖鎖付加などが知られている。
8.エピゲノム
生物のDNAやヒストンタンパク質に起こる化学修飾で、DNAのメチル化やヒストンのアセチル化、メチル化、リン酸化などがある。これらの修飾状態は細胞複製後も維持され、世代を超えて生物の子孫に受け継がれることもある。
9.U2AF1
mRNA前駆体のイントロン(タンパク質をコードしていない領域)とエクソン(タンパク質をコードしている領域)の境界(3’スプライス部位)を特異的に認識して、mRNA前駆体に結合するタンパク質。
10.TNF-α
サイトカインの一種で、当初はがんに対して出血性の壊死を生じさせるサイトカインとして発見された。現在では、炎症や免疫、細胞の生死に関わる因子として注目されている。
11.Tristetraprolin(TTP)
mRNAの3’UTR(3’非翻訳領域)に結合し、TNF-αなどの炎症性サイトカインのmRNAを分解する。
12.Roquin
TTPと同様に、mRNAの3’UTR(3’非翻訳領域)に結合し(ただしRoquinはステムループ構造を認識する)、TNF-αなどの炎症性サイトカインのmRNAを分解する。
13.エクソンスキップ
RNAスプライシングの一種であり、mRNA前駆体から特定のエクソン(タンパク質をコードしている領域)が飛ばされて成熟mRNAができる現象のこと。
共同研究チームグループ
理化学研究所
開拓研究本部
眞貝細胞記憶研究室
専任研究員 島津 忠広(シマヅ・タダヒロ)
テクニカルスタッフⅠ(研究当時)事柴 薫(コトシバ・カオル)
主任研究員 眞貝 洋一(シンカイ・ヨウイチ)
袖岡有機合成化学研究室
専任研究員 五月女 宜裕(ソウトメ・ヨシヒロ)
テクニカルスタッフⅠ 赤壁 麻依(アカカベ・マイ)
主任研究員 袖岡 幹子(ソデオカ・ミキコ)
環境資源科学研究センター 技術基盤部門 生命分子解析ユニット
専任技師 鈴木 健裕(スズキ・タケヒロ)
ユニットリーダー 堂前 直(ドウマエ・ナオシ)
バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 的場 章悟(マトバ・ショウゴ)
テクニカルスタッフⅡ 廣瀬 美智子(ヒロセ・ミチコ)
室長 小倉 淳郎(オグラ・アツオ)
摂南大学 農学部 応用生物科学科
講師 芳本 玲(ヨシモト・レイ)
研究支援
本研究は、理研横断プロジェクト「エピゲノム操作(研究代表者:眞貝洋一)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「タンパク質ヒスチジンメチル化の理解(研究代表者:島津忠広、20K06497)」「未知の核外輸送機構を短い環状RNAから解明する(研究代表者:芳本玲、22K05565)」、同基盤研究(B)「タンパク質メチル化関連因子の化学的複合制御(研究代表者:五月女宜裕、22H02214)」、同学術変革領域研究(B)「neo-PTMsの階層間シナジー(研究代表者:五月女宜裕、22H05019)、「neo-PTMsの生命機能解析(研究代表者:島津忠広、22H05020)、武田科学振興財団「ビジョナリーリサーチ助成(スタート)(研究代表者:島津忠広)」による助成を受けて行われました。
原論文情報
Tadahiro Shimazu, Rei Yoshimoto, Kaoru Kotoshiba, Takehiro Suzuki, Shogo Matoba, Michiko Hirose, Mai Akakabe, Yoshihiro Sohtome, Mikiko Sodeoka, Atsuo Ogura, Naoshi Dohmae, Yoichi Shinkai, “Histidine N1-position-specific methyltransferase CARNMT1 targets C3H Zinc finger proteins and modulates RNA metabolism”, Genes & Development, 10.1101/gad.350755.123
発表者
理化学研究所
開拓研究本部 眞貝細胞記憶研究室
専任研究員 島津 忠広(シマヅ・タダヒロ)
主任研究員 眞貝 洋一(シンカイ・ヨウイチ)
摂南大学 農学部 応用生物科学科
講師 芳本 玲(ヨシモト・レイ)
報道担当
理化学研究所 広報室 報道担当


