新しい抗老化方法論の開発に期待
2019-06-14 神戸医療産業都市推進機構,日本医療研究開発機構
ポイント
- 血液循環中にあるNAD合成系酵素eNAMPT(※1)が、マウスとヒトで加齢に伴い減少すること、またマウスでは血液中のeNAMPT量が個々の個体の余命と強い正の相関を示すことを明らかにしました。
- 遺伝学的に血液循環中のeNAMPT量を保持したマウス(ANKIマウス)を作製したところ、老齢になって様々な臓器・組織のNAD量が高く保たれ、多彩な抗老化形質を示すことを明らかにしました。
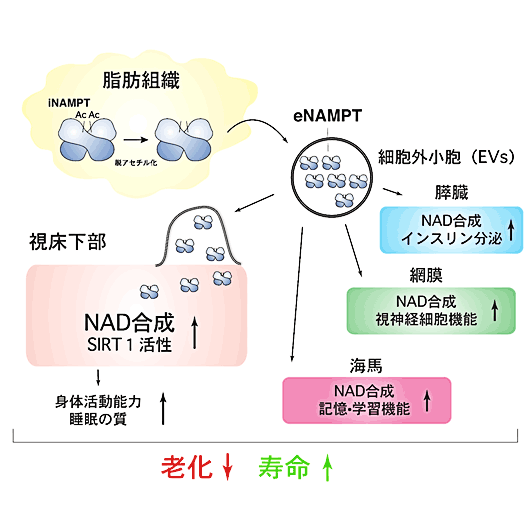
- eNAMPTは細胞外小胞(※2)に内包された形で血液中を巡り、標的臓器・組織で細胞質に送り込まれて、NAD合成を賦活化することを示しました。
- 若齢個体から精製したeNAMPT内包EVは、老齢個体に投与することで、その身体的機能を活性化させ、寿命を延長させることができることを明らかにしました。
今井眞一郎博士(ワシントン大学医学部(米国ミズーリ州セントルイス)発生生物学部門・医学部門(兼任)教授、および神戸医療産業都市推進機構、先端医療研究センター客員上席研究員)の研究グループは、国立研究開発法人国立長寿医療研究センター、中枢性老化・睡眠制御研究プロジェクトチームのプロジェクトリーダーである佐藤亜希子博士との共同研究により、血液循環中に存在するNAD合成系酵素eNAMPTが、哺乳類における老化?寿命の制御に重要な役割を果たしていることを明らかにしました。両博士は、日本医療研究開発機構(AMED)の『老化メカニズムの解明・制御プロジェクト』に参画し、共同研究の部分は当プロジェクトの支援のもとに行われたもので、その研究成果は、国際科学誌Cell Metabolism(セル・メタボリズム)に、2019年6月13日午前11時(米国東部時間)、6月14日午前1時(日本時間)にオンライン版で発表されます。
概要
1.背景
生命活動にとって必須であるNAD(ニコチナミド・アデニン・ジヌクレオチド)と呼ばれる物質が、全身のさまざまな臓器・組織において、加齢とともに低下してしまうことが、最近の老化・寿命研究によって明らかにされています。このNADの低下が、臓器や組織の機能低下、ひいては老化関連疾患の病因を引き起こしていることもわかってきています(Yoshino et al., Cell Metab., 2018; Imai & Guarente, npjAMD, 2016)。NAD低下の原因は、NAD合成の低下とNAD消費の増大のいずれか、あるいはその組み合わせによることが明らかになってきています。哺乳類において、NAD合成の主要な経路は、NAMPT(nicotinamide phosphoribosyltransferase:ニコチナミド・ホスホリボシルトランスフェラーゼ)と呼ばれる酵素によって制御されるもので、ビタミンB3の一種であるnicotinamide(ニコチナミド)を出発物質とします。NAMPTはニコチナミドを、NMN(nicotinamide mononucleotide:ニコチナミド・モノヌクレオチド)という物質に変換し(Revollo et al., JBC, 2004)、NMNはさらに別の酵素によってNADに変換されます。すなわち、NAMPTはNAD合成の中間体物質であるNMNを作り出すことによってNADの産生の制御を行う重要な酵素であり、NAD合成を促進することによって、NAD依存性タンパク脱アセチル化酵素であり哺乳類サーチュインの主要な一員であるSIRT1の活性を増大させることが知られています(Revollo et al., JBC, 2004)。また、NMNには非常に顕著な抗老化作用があることが明らかになっています(Mills et al., Cell Metab., 2016)。興味深いことに、このNAMPTという酵素には、二つの独立した型があります。一つは細胞内型(※3)、もう一つは細胞外型(※3)で、それぞれiNAMPT、eNAMPTと呼ばれています(Revollo et al., Cell Metab., 2007)。iNAMPTは白色・褐色脂肪組織の中でアセチル化(※4)されていますが、特に53番目のリジン残基がNAD依存性タンパク脱アセチル化酵素であるSIRT1によって脱アセチル化(※4)されると、eNAMPTとして脂肪組織から分泌されるようになることがわかっていました(Yoon et al., Cell Metab., 2015)。しかしながら、NAD合成系酵素としての機能が明らかなiNAMPTに比べて、血液中を循環しているeNAMPTについては、哺乳類の老化・寿命制御にどのような役割を果たしているのか、現在まで不明のままでした。
2.研究手法・成果
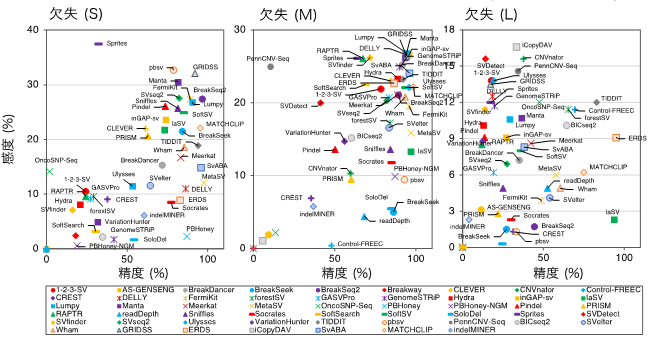
私達は、まず血液中を循環しているeNAMPTの加齢による変化を、マウスとヒトにおいて調べました。マウスでは、6ヶ月齢から18ヶ月齢で、オスで33%、メスで74%、血液中のeNAMPT量が減少してしまうことが明らかになりました。このeNAMPT量の減少はヒトにおいても認められ、eNAMPTの減少が哺乳類の老化過程に共通の現象である可能性が示唆されました。そこで、老齢マウスをランダムに選んで、ある一定の時点で血液中のeNAMPT量を測定し、その時点から個々の個体の余命がどのくらいあるかを調べたところ、血液中のeNAMPT量と余命の間に強い正の相関があることが明らかになりました。つまり、eNAMPT量を測定することにより、老齢マウスのそれぞれの個体の余命がどのくらいあるのかを予測することができる、ということがわかりました。これらの結果から、血液循環中のeNAMPTが、老化・寿命の制御に重要な役割を果たしている可能性が強く示唆されました。
そこで、脂肪組織でNAMPTを特異的に発現させて、血液循環中のeNAMPT量が老化しても保たれるようなマウス、ANKI(adipose tissue-specific Nampt knock-in)マウスを作製し、その老化形質を詳しく解析しました。ANKIマウスは24ヶ月齢の時点で、同じ月齢の対照群に比べて、血液中のeNAMPT量が3.3~3.6倍高く保たれていました。老齢ANKIマウスでは、メスでは視床下部、海馬、膵臓、網膜、といった組織において、オスでは膵臓、網膜において、対照群よりも高いレベルのNADが保たれていることがわかりました。それと共に、老齢ANKIマウスは対照群に比べて、1)観覧車を回す身体活動能力が12ケ月程若いレベルに保たれている、2)睡眠の質が保たれている、3)身体活動能力、睡眠の質の制御に重要な、視床下部内のSIRT1標的遺伝子の発現が高い、4)糖刺激によるインスリン分泌能が高く、膵臓のランゲルハンス氏島の数が多い、5)桿体、錐体共に網膜の視神経細胞の機能が高い、6)海馬依存性の記憶・学習能力が高い、といった多彩な抗老化作用を示すことが明らかになりました。これらの結果から、血液循環中のeNAMPT量を保つことによって、さまざまな臓器・組織のNADおよび機能を保つ、特に視床下部、海馬、膵臓、網膜のNADと機能を保つことができることがわかりました。さらに特にメスのANKIマウスは、健康寿命とも呼ばれる中間寿命(※3)が対照群に比べて13.4%延びました。しかしながら、最大寿命は対照群と同じでした。オスのANKIマウスは寿命の延長を全く示しませんでした。以上の結果より、性差があるものの、若い頃のeNAMPT量を保つことが、老化を遅らせ、健康寿命を延伸させることに非常に重要であることが強く示唆されました。
それでは、eNAMPTはどのようにして、遠隔の臓器・組織に働きかけているのでしょうか?興味深いことに、eNAMPTはマウスでもヒトでも、裸のタンパク質として血液中を巡っているのではなく、細胞外小胞(extracellular vesicles; EVs)に封入された形で循環していることが明らかになりました。EV中に封入されたeNAMPTは、EVが遠隔臓器・組織の標的細胞に到達して細胞膜に融合すると、細胞質の中に送り込まれて、直ちにNAD合成を開始します。EV中のeNAMPTの量は、加齢によって著減してしまいますが、老齢ANKIマウスでは対照群に比べて高く保たれていることが明らかになりました。EV中に含まれているタンパク質について、6ヶ月齢と24ヶ月齢、また老齢ANKIマウスと対照群のマウスでプロテオミクス解析によって比較してみると、変化を示すタンパク質はわずか2~3%であり、その何れもがNAD合成には無関係のタンパク質であることがわかりました。さらに、培養脂肪細胞であるOP9細胞を用いて、培養上清中に分泌されるeNAMPTを含むEVを調べてみると、顕著なNMN/NAD合成能を示すことが明らかとなり、またこの能力は、NAMPTをノックダウンした細胞から得たEVでは消失することがわかりました。すなわち、EVに内包されているeNAMPTそのものが、NMN/NAD合成を担っていることが示されました。eNAMPTは細胞質の中に正しく送り込まれるためには、EVの中に内包されていることが必要で、NAMPTのタンパク質を裸のまま添加しても細胞質には送り込まれないこともわかりました。eNAMPTを内包するEVは、若齢個体から精製したものの方が老齢個体から精製したものよりも高いNAD合成能を示し、また老齢ANKIマウスから精製したものの方が対照群のマウスから精製したものよりも高いNAD合成能を示します。以上の結果から、eNAMPTはEVに内包される形で分泌され、血液中を循環しており、標的細胞に送り込まれることによってNMN/NAD合成を賦活化することが明らかとなりました。
これらの結果を基に、若齢個体からeNAMPT内包EVを精製し、老齢個体に投与したらどのようなことが起こるかについて検討しました。驚くべきことに、4~6ヶ月齢のマウスから精製したeNAMPT内包EVを、20ヶ月齢のマウスに投与すると、夜間(活動期)に観覧車を回す身体活動能力が顕著に上昇するとともに、日中(休息期)の活動はより低くなることがわかりました。これは、eNAMPT内包EVの投与によってより深く眠るようになったためではないか、と推測されました。さらにこの効果は、OP9細胞の培養上清から精製したEVでも認められ、NAMPTをノックダウンした細胞の培養上清から精製したEVでは消失しました。すなわち、EV中に内包されているeNAMPTがこの効果に重要であることが示されました。次に、若齢個体から精製したeNAMPT内包EVを、26ヶ月齢の時点から老齢個体に継続的に投与すると、驚くべきことに、中間寿命(※5)が10.2%、さらに最大寿命が15.8%も延長することが明らかになりました。eNAMPT内包EVを投与された老齢マウスは、対照群のマウスに比べ毛並みも良く、活動レベルも対照群と比べると顕著に高い状態に保たれていました。以上の結果から、EVに内包されているeNAMPTを投与することが、加齢による臓器・組織の機能低下を防ぎ、寿命を延長させうる効果的な抗老化方法論となることが示唆されました。
3.波及効果
eNAMPTを内包しているEVを分泌している主要な組織は、脂肪組織です。今回の研究結果は、脂肪組織がeNAMPTを内包するEVを分泌することにより、全身性にNAD合成能を保ち、ひいては老化・寿命の制御に重要な役割を果たしていることを明らかにしました。私たちのこれまでの研究から、視床下部の特定の神経細胞群が、いわば高次の「老化のコントロール・センター」として、哺乳類における老化・寿命の制御に重要な機能を果たしていることがわかっていました(Satoh et al., Cell Metab., 2013)。今回の研究結果から、脂肪組織がその「老化のコントロール・センター」に対して、さらには他の臓器に対しても、eNAMPT内包EVの分泌を通して「モジュレーター」としての役割を果たしていることが証明されました。これは哺乳類における老化・寿命制御のメカニズムを明らかにする上で非常に重要な結果であると同時に、責任著者である今井が2016年に提唱した、哺乳類における老化・寿命の全身性統括的制御系「NAD World 2.0」の概念をさらに証明、深化させる成果と言えます(Imai, npjSBA, 2016)。老齢ANKIマウスでは、その一生の最後において脂肪組織の萎縮が見られ、おそらくそのために中間寿命(健康寿命)の延伸は認められても最大寿命の延伸は認められなかったのだろうと推察されます。しかし、eNAMPT内包EVを継続投与することで老齢の段階からでも健康状態を改善し、寿命を延長させることができることが示されたことから、eNAMPT内包EVを投与することによって健康長寿を実現させることができるという可能性が強く示唆されました。現時点では、血液中を循環しているeNAMPT内包EVが、どのようにして特定臓器・組織で認識されるのか、というメカニズムについては不明のままです。このメカニズムを明らかにすることで、今後、人工的に作製したeNAMPT内包EVを、抗老化方法論の手段として使用することができるようになる、と期待されます。
4.今後の予定
上記で述べたように、eNAMPT内包EVがどのようなメカニズムで、特定の臓器や組織で認識されるのか、というメカニズムを明らかにしていきます。またeNAMPT内包EVを人工的に作製する技術を確立していくことを目指します。
論文タイトルと著者
- タイトル:
- Extracellular vesicle-contained eNAMPT delays aging and extends lifespan in mice (細胞外小胞に内包されるeNAMPTが、マウスにおいて老化を遅延させ寿命を延長させる)
- 著者:
- Mitsukuni Yoshida,1,6 Akiko Satoh,7 Jonathan B. Lin,2,6 Kathryn F. Mills,1 Yo Sasaki,3Nicholas Rensing,4 Michael Wong,4 Rajendra S. Apte,1,2,5 and Shin-ichiro Imai1,5,8,9
1発生生物学部門
2眼科学/ビジュアルサイエンス部門
3遺伝学部門
4神経学部門
5医学部門
6MD-PhD プログラム
ワシントン大学医学部(ミズーリ州セントルイス)
7国立研究開発法人国立長寿医療研究センター 中枢性老化・睡眠制御研究プロジェクトチーム
8公益財団法人神戸医療産業都市推進機構 先端医療研究センター 老化機構研究部
9責任著者
- 掲載誌:
- Cell Metabolism
用語解説
- ※1 eNAMPT
- 哺乳類において、NAD(ニコチナミド・アデニン・ジヌクレオチド)の主要合成経路を司る律速段階の酵素、nicotinamide phosphoribosyltransferaseの細胞外型。
- ※2 細胞外小胞
- 細胞から分泌される脂質二重膜から形成される小胞を指す広義の用語。英語ではextracellular vesicles (EVs)と呼ばれる。EVの一種にエクソソーム(exosome)があるが、EVおよびエクソソームの定義、研究法についてはMISEV2018のガイドラインに従うことが求められている。様々なタンパク質、マイクロRNAを内包し、近距離あるいは遠距離の細胞・組織のコミュニケーションに重要な役割を果たしていることが、近年明らかにされている。
- ※3 NAMPTの細胞内型・細胞外型
- NAMPTには細胞内/組織内に局在するものと、血液中や脳脊髄液中など細胞外に局在するのものがあり、それぞれ「細胞内型(intracellular NAMPT; iNAMPT)」、「細胞外型(extracellular NAMPT; eNAMPT)」と呼ばれている(Revollo et al., Cell Metab., 2007)。eNAMPTは、pre-B-cell enhancing factor (PBEF)、visfatinという名称で呼ばれることもあるが、これらの名称の基となった結果が再現されていない、あるいは撤回されたため、最近ではeNAMPTという名称が定着しつつある。細胞内型と細胞外型は同一のタンパク質であるが、修飾状態が異なっており、特にeNAMPTは脱アセチル化を受けていることが明らかとなっている(Yoon et al., Cell Metab., 2015)。その他の修飾もあると考えられているが、その修飾の実体については未だ明らかになっていない。
- ※4 アセチル化・脱アセチル化
- 「アセチル化」はタンパク質の化学的修飾の一種であり、リジン残基あるいはアスパラギン酸残基のアミノ基(-NH3)の水素原子を、アセチル基(-COCH3)で置き換える反応である。逆に、アセチル基を除去する反応は、「脱アセチル化」と呼ばれる。アセチル化・脱アセチル化のそれぞれの反応を媒介する、アセチル基転移酵素(アセチルトランスフェラーゼ)、脱アセチル化酵素(デアセチラーゼ)が多数存在する。サーチュインがNAD依存性のタンパク脱アセチル化酵素であり、その活性が老化・寿命の制御に重要であることが2000年に初めて明らかとなり、現在のサーチュインの生物学の基礎を築いた(Imai et al., Nature, 2000)。
- ※5 中間寿命
- ある個体群の半数が死亡するまでの期間。中間寿命の変化は個体の健康状態をよく反映するため、健康寿命(healthspan)と同義のように使われることも多い。
発表者・機関窓口
発表者
今井 眞一郎
神戸医療産業都市推進機構 先端医療研究センター
老化機構研究部 客員上席研究員
Shin-ichiro Imai, M.D., Ph.D. Professor
- 研究領域
- 老化・寿命生物学、統合生理学、代謝科学、神経生物学
共同研究者
佐藤 亜希子 Akiko Satoh, Ph.D.
プロジェクトリーダー
国立研究開発法人 国立長寿医療研究センター
中枢性老化・睡眠制御研究プロジェクトチーム
- 研究領域
- 老化・寿命生物学、睡眠生理学、代謝科学
機関窓口
公益財団法人神戸医療産業都市推進機構
クラスター推進センター 都市運営・広報課
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
基盤研究事業部 研究企画課