2020-01-10 量子科学技術研究開発機構
発表のポイント
- ヒト臍帯血から増殖させた赤芽球1)から樹立したiPS細胞2)では、点突然変異3)数が1/5から1/10に減少
- ゲノム初期化4)では、初期の細胞周期にブレーキがかからず、DNA修復機構が働きにくくなり変異が蓄積することを解明
- ゲノム初期化細胞にみられるゲノム変異発生の分子機構の一端を解明
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子医学・医療部門 放射線医学総合研究所 放射線障害治療研究部の荒木良子幹細胞研究グループリーダー、法喜ゆう子研究員、菅智技術員および安倍真澄部長らの研究チームは、山梨大学発生工学研究センター若山照彦教授、Lunenfeld-Tanenbaum Research Institute, Mount Sinai Hospital Andras Nagy教授らと共同で、ゲノム変異の少ないヒトiPS細胞の樹立法を発見しました。
iPS細胞のゲノムには、全体で数百から1,000カ所もの点突然変異(タンパク質をコードする遺伝子領域にも複数の変異)が見つかることが知られています。これらは移植の際の免疫原性、そして造腫瘍性の原因となりうるため、取り扱いは慎重に行われています。このような状況から、変異が生じる原因の理解と、変異の少ないiPS細胞株の樹立が可能であるか否かを明らかにすることは、基礎研究においても再生医療においても重要な課題です。
今回、研究チームは、ヒト臍帯血から増殖させた赤芽球を親体細胞に用いることにより、従来の1/5から1/10ほど変異の少ないiPS細胞が樹立できることを発見しました。さらに、一般的に用いられる皮膚の線維芽細胞を用いた場合に変異が生じる原因として、iPS細胞樹立(ゲノム初期化)の初期過程で、DNA損傷時に細胞周期のブレーキがかからず、DNA修復機構が働きにくい状態であること、さらにその分子機構の一部を明らかにしました。これらはiPS細胞を用いた再生医療研究への貢献が期待される成果です。
この成果は、「Nature Communications」にて2020年1月10日(金)19:00にオンライン掲載予定です。なお、本研究の一部は、JSPS科研費(25290068, 17H03615, 17K20053 and 16H06153)、武田科学振興財団、上原生命科学財団、三菱財団自然科学研究の助成を受けました。
研究開発の背景と目的
iPS細胞を目的の細胞に分化させ、病気の原因の解明や創薬、そして再生医療に利用する研究が進められています。一方で、iPS細胞樹立過程の主要イベント、つまり、体細胞のゲノムを初期化してiPS細胞(人工多能性幹細胞)をつくる過程の分子機構は未だ十分解明されていないため、議論が続いている課題があることも実情です。その一つが、iPS細胞ゲノムに存在する点突然変異の存在です。これらは移植の際の免疫原性、そして造腫瘍性の原因となりうるため、取り扱いは慎重に行われています。
これまで様々な細胞種やiPS細胞化の手法を変えて点突然変異の解析が行われましたが、いずれもひとつのiPS細胞株のゲノムあたり300~1,000カ所(遺伝子のタンパク質コード領域あたりにすると平均6カ所)の変異が検出されることが報告されています(参考文献1―5)。これは実に驚きの結果でした。ゲノム初期化に代表される細胞系譜の転換は、エピゲノム5)の大規模な再編成であり、ゲノムDNAの塩基配列に変化無く起こるはずと考えられていたためです。
このような状況から、変異が生じる原因の理解と、変異の少ないiPS細胞株の樹立が可能であるか否かを明らかにすることを目的に研究を行いました。
研究の手法と成果
研究チームは、過去に、マウスiPS細胞のゲノムに変異が発生する時期の研究を行い、親体細胞や、親体細胞のゲノムを初期化する前の培養中に生じた変異とは別に、ゲノム初期化の極初期過程で点突然変異が多数発生することを示しました(図1)(2014年1月3日プレスリリース)。
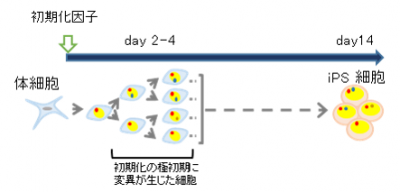
図1 iPS細胞樹立中にも変異が生じる
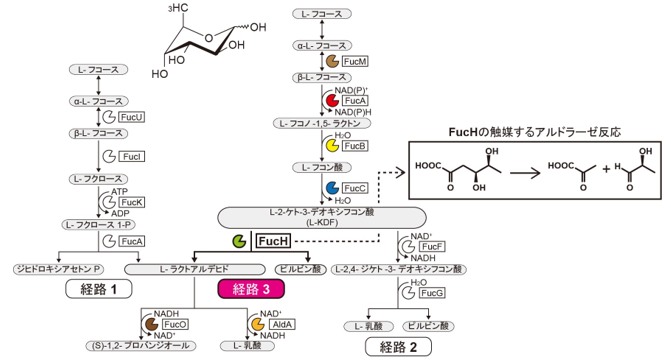
ゲノム初期化の極初期に発生する点突然変異のパターンから、ゲノム初期化時の活性酸素種(ROS)発生によるDNA損傷が変異を生じる原因であると推定しました。そして変異が少ないiPS細胞を樹立するため、1)ROS発生を抑える、またはROSによるDNA損傷修復能を上げる操作を行う、あるいは、2)ROS発生の少ない親体細胞の探索により、iPS細胞を樹立するという2つの試みを行いました。その結果、1)においては、顕著な変異数の低減化は見られなかったものの、点突然変異のパターンを変えることが可能であることが示唆され、一方で2)においては、顕著に変異の数を低減化できるという結果が得られました。
ROSはミトコンドリア系で作られるエネルギーを主体として活動する細胞に多く含まれるため、解糖系で作られるエネルギーを主体として活動し、恒常的にROSの生産が抑えられた細胞が、親体細胞に適している可能性があると考えました。
低侵襲性に入手できる細胞の中で、ROSが比較的抑えられた細胞として、ヒト臍帯血から増殖させた赤芽球を選びました。赤芽球に相当する細胞のエネルギー生産経路を調べたところ、解糖系からミトコンドリアのクエン酸回路(TCA回路)へと進むために必要となるピルビン酸脱水素酵素が不活化されており、赤芽球の活動エネルギーの主体は解糖系であることが確認できました。
そこで赤芽球を親細胞として、Oct4、Sox2、Klf4、c-Myc、Lin28の5つの遺伝子(初期化因子)を組み込んだエピゾーマルベクター6)を導入してiPS細胞を樹立しました。樹立したiPS細胞は、未分化状態を示すタンパク質が発現しており、さらに、分化誘導実験から、多分化能を有することが確認されました。
次に、樹立したiPS細胞の全ゲノムシーケンシングを行ったところ、驚くべきことに、点突然変異の数は、それまで報告されていた数の5分の1から10分の1と少ないことが明らかになりました(図2)。また、この結果は独立した4名のドナーから得られた全14個のiPS細胞株全てで矛盾無く確認されました。更に、半分の7個のiPS細胞株でアミノ酸が変化するような遺伝子の点突然変異は検出されませんでした。
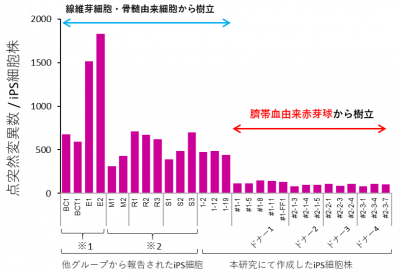
図2 ヒトiPS細胞における点突然変異の数
線維芽細胞・骨髄由来細胞から樹立された他のグループのiPS細胞に関しては、全ゲノムシーケンスデータを公共データベースから取得した※1、※2。それらのiPS細胞と、本研究で作成したヒト臍帯血由来赤芽球を親細胞とするiPS細胞に対して、同じ情報解析を行った。
※1 参考文献2
※2 参考文献4
さらに研究チームは、iPS細胞樹立(ゲノム初期化)時のDNA修復能についても明らかにすることを試みました。通常、DNAに変異が起きるとその変異は修復され、修復できないほど損傷がひどい場合、その細胞は死にます(アポトーシス)。また、損傷を修復している間は細胞周期チェックポイント7)と呼ばれるメカニズムによって細胞周期が停止し、変異が一気に蓄積することはありません。ところが、iPS細胞で観察される変異の存在は、これらの細胞周期チェックポイント機能が一過性に欠損していることを強く示唆していました。
そこで、iPS細胞樹立(ゲノム初期化)時のDNA修復機構を解析するため、マウスおよびヒト線維芽細胞に初期化因子を導入後、6日後(マウス)または7日後(ヒト)までの各日にX線を用いてDNA損傷を引き起こし、それぞれについてiPS細胞コロニー数を調べました。通常の線維芽細胞は、X線により半数以上の細胞が死滅するため、最終的に形成されるiPS細胞コロニー数もそれに伴い減少することが予測されますが、驚くべきことに、初期化因子を導入後、2日目と3日目にX線を照射したマウス線維芽細胞において、照射していない場合と同程度の数のiPS細胞コロニーが形成されました(図3A)。ヒトでは、初期化因子を導入後、3日目に放射線を照射した線維芽細胞において、他の日に照射した場合よりも多くのコロニーが形成されました(図3B)。このことは、この時期にDNA損傷に対する細胞周期チェックポイント機能が低下していることを示唆します。
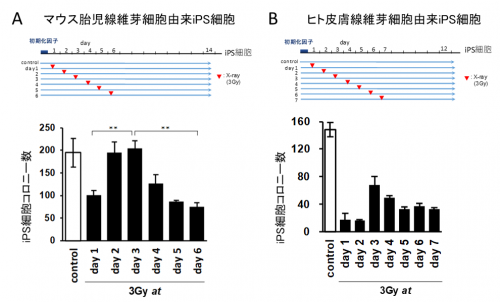
図3 iPS細胞樹立過程にDNA損傷を誘導した場合のiPS細胞コロニー数変化
A)マウス胎児線維芽細胞にレトロウイルスベクターを用いて初期化因子を導入し、1日後、2日後、3日後、4日後、5日後、6日後にX線(3Gy)を照射し、DNA損傷を誘導した。2日後と3日後に照射した場合は、他の日に照射した場合に比べ、コロニー数が多く、この時期は、X線で細胞が死ににくいことを示している。コントロールはX線照射無し。
B)ヒト皮膚線維芽細胞にセンダイウイルスベクターを用いて初期化因子を導入し、1日後、2日後、3日後、4日後、5日後、6日後、7日後にX線(3Gy)を照射し、DNA損傷を誘導した。3日後に照射した場合は、他の日に照射した場合に比べ、コロニー数が多く、この時期は、X線で細胞が死ににくいことを示している。コントロールはX線照射無し。
DNA損傷に対する細胞周期チェックポイント機能の低下の分子機構を調べるため、タンパク質の解析を行いました。通常のDNA損傷応答では、Rbタンパク質の働きにより、G1期(DNA合成準備期)からS期(DNA合成期)へと進む細胞周期が停止します。ところが、初期化因子導入後3日目にX線照射した線維芽細胞では、p53タンパク質による抑制制御が及ばないほど、細胞周期を進行させるCyclinD1タンパク質が過剰に発現しており、このCyclinD1がRbをリン酸化して不活性化することにより、細胞周期の停止が不十分になることが明らかになりました(図4)。
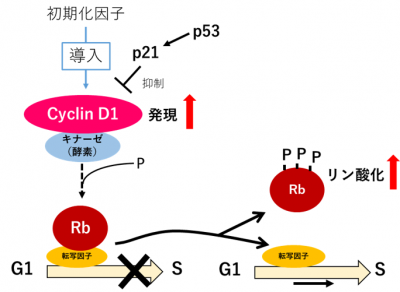
図4 ゲノム初期化の極初期の細胞周期
初期化因子が導入されるとCyclinD1が過剰に発現しRbがリン酸化する。DNA損傷によりp53から細胞周期停止のシグナルが流れても、G1期からS期への細胞周期の進行が起こり、細胞周期を停止するに至らない。
この状態は、癌に似ており、DNA修復とアポトーシスは起こらず変異の蓄積が起こることになります。変異のパターンを詳細に観察すると、マウスiPS細胞や体細胞核移植ES細胞(ntES細胞)8)の変異パターン(変異シグネチャー)は、ヒト食道腺癌で良くみられるものと似ていることを発見しました。一方で、ゲノム初期化を介さずに樹立された多能性幹細胞であるES細胞においては、ヒト食道癌でみられる変異シグネチャーは観察されませんでした。これらの結果は、ゲノム初期化と発癌が共通の過程を経ている可能性を示しています。
今後の展開
ヒト臍帯血由来赤芽球を用いた今回の成果により、ゲノムに変異の少ない再生医療用iPS細胞の樹立効率が大幅に改善される可能性があります。
今後の研究の取り組みとしては、患者本人からのiPS細胞樹立を想定し、末梢血や骨髄から得た赤芽球を用いても、同様のiPS細胞の樹立が可能かを解析する必要があります。その一方で、なぜ、臍帯血由来赤芽球を親体細胞に用いることでiPS細胞のゲノム変異が減少したのか、その分子メカニズムを明らかにすることが重要です。その結果、皮膚細胞など、赤芽球以外の細胞からも変異の少ないiPS細胞の樹立が可能となるかもしれません。加えて、多様な細胞への分化能等、更なる検証も続ける必要があります。
参考文献
1. Gore A, et al. Somatic coding mutations in human induced pluripotent stem cells. Nature 471, 63-67 (2011).
2. Cheng L, et al. Low incidence of DNA sequence variation in human induced pluripotent stem cells generated by nonintegrating plasmid expression. Cell Stem Cell 10, 337-344 (2012).
3. Sugiura M, et al. Induced pluripotent stem cell generation-associated point mutations arise during the initial stages of the conversion of these cells. Stem Cell Rep. 2, 52-63 (2014).
4. Bhutani K, et al. Whole-genome mutational burden analysis of three pluripotency induction methods. Nat. Commun. 7, 10536 (2016).
5. Rouhani FJ, et al. Mutational History of a Human Cell Lineage from Somatic to Induced Pluripotent Stem Cells. PLoS Genet 12, e1005932 (2016).
用語解説
1)赤芽球
赤芽球は、一般的には赤血球になる前の分化段階の細胞です。本研究でiPS細胞の材料とした細胞は、臍帯血からエリスロポエチン等増殖因子を加えて培養し増やした細胞群であり、厳密には、赤芽球を含む様々な分化ステージの集団となります。
2)iPS細胞(人工多能性幹細胞)
皮膚等の既に分化した細胞に数種類の遺伝子を導入することなどによって分化多能性(様々な細胞に分化する能力)を誘導した細胞のこと。なお、幹細胞とは、自分自身を増やす自己複製能力と、ほかの細胞に分化(成長)する能力を持つ、ほかの細胞の元となる特別な細胞。iPS細胞は、再生医療への応用や薬剤開発等への利用が期待されています。
3)点突然変異
1塩基が他の塩基に置換するような変異。
4) ゲノム初期化
体細胞のゲノムの状態が、受精卵などの初期胚の状態まで戻ることをゲノム初期化と呼んでいます。ゲノムのメチル化やヒストンの修飾等、エピゲノムと呼ばれる状態が再編成されることにより、体細胞の性質から初期胚の性質を獲得できると考えられています。
5) エピゲノム
ゲノムにおけるDNAメチル化やヒストン修飾等を意味します。DNA塩基配列の変化を起こさずゲノムの状態を変え、遺伝子発現などの制御に関わります。
6) エピゾーマルベクター
レトロウイルス等を用いた遺伝子導入とは異なり、導入遺伝子が染色体に挿入されないタイプのベクター。レトロウイルスベクターに比べ遺伝子導入効率は低いが、最終的に外来遺伝子が細胞に残らないというメリットがあります。本研究では、Chouらのグループが作製したエピゾーマルベクターを用いました。
7) 細胞周期チェックポイント
細胞は、細胞分裂を経てまた新たな1個の細胞ができます。そのような過程を細胞周期と呼びます。ゲノムの異常を感知し、細胞周期の進行を進めるか、停止するか判断する機構がチェックポイントです。
8) 体細胞核移植ES細胞(ntES細胞)
体細胞の核を取り出し、未授精卵の核と入れ替える手法である、クローン技術により作製したES細胞。本研究では、iPS細胞法とは異なるゲノム初期化法として実験に用いました。
9)変異シグネチャー
様々な癌ゲノムを解析して得られた変異のパターン。変異の原因の推定等に用いられます。
論文について
雑誌名:Nature Communications
論文タイトル:
Genetic aberrations in iPSCs are introduced by a transient G1-S cell cycle checkpoint deficiency
著者:
Ryoko Araki, Yuko Hoki, Tomo Suga, Chizuka Obara, Misato Sunayama,
Kaori Imadome, Mayumi Fujita, Satoshi Kamimura, Miki Nakamura, Sayaka
Wakayama, Andras Nagy, Teruhiko Wakayama, and Masumi Abe
Doi: 10.1038/s41467-019-13830-x