2024-06-19 東京大学
岩間 愛加(生物科学専攻 修士課程)
赤坂 浩明(生物科学専攻 博士課程)
佐野 文哉(生物科学専攻 博士課程)
大島 秀教(生物科学専攻 修士課程)
志甫谷 渉(生物科学専攻 助教)
濡木 理(生物科学専攻 教授)
木瀬 亮次(東北大学 特任助教)
井上 飛鳥(東北大学 教授)
発表のポイント
- 代謝や食欲調節に関わるペプチドホルモン「QRFP」が結合した、QRFP受容体GPR103とGqタンパク質三量体との複合体構造の構造解析に成功しました。
- QRFPの結合様式と受容体活性化機構を明らかにし、細胞外領域がホルモンの認識に重要であることを示しました。
- 本研究は、GPR103を標的とした代謝や食欲調節の治療薬の設計への道を拓くものです。
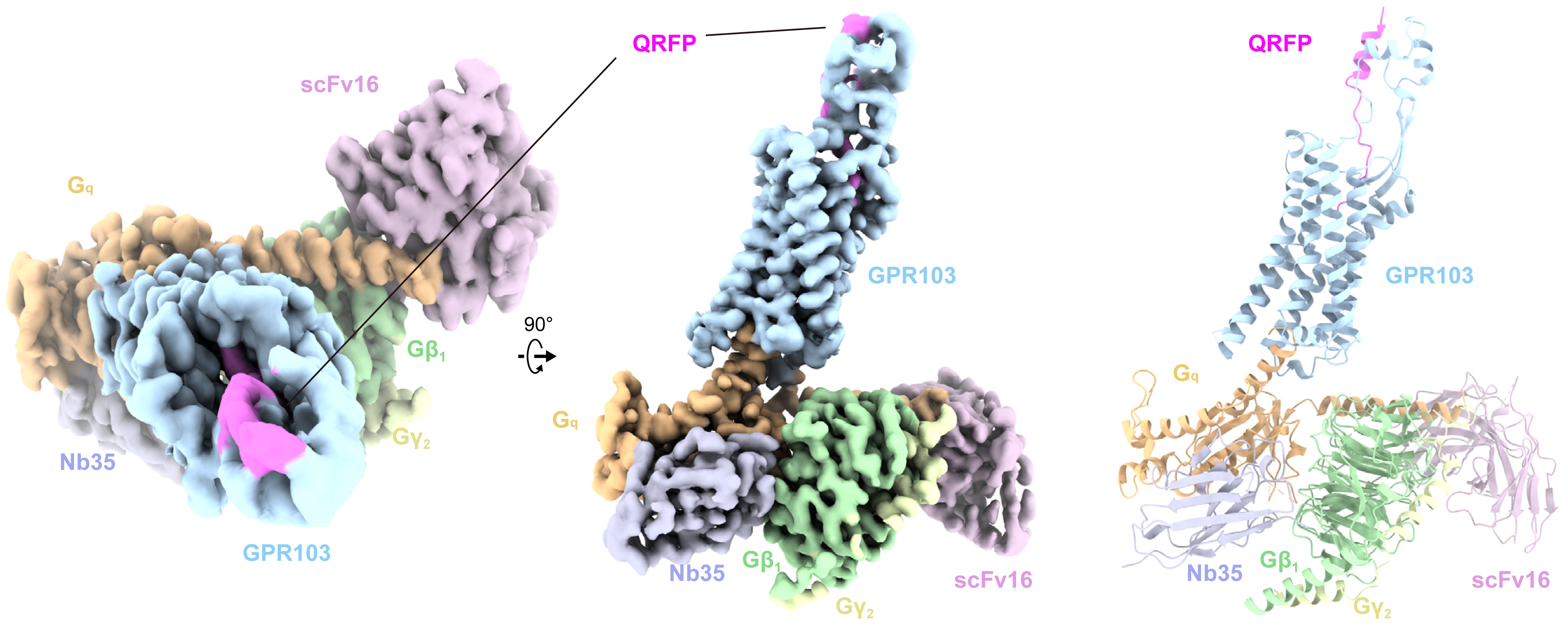
GPR103-Gq複合体の全体構造
発表概要
今回、東京大学大学院理学系研究科の濡木理教授らのグループは、東北大学大学院薬学研究科の井上飛鳥教授との共同研究のもと、内在性ペプチドQRFPによって活性化したQRFP受容体(GPR103)と三量体Gタンパク質Gq (注1)とのシグナル伝達複合体の立体構造をクライオ電子顕微鏡(cryo-EM)(注2)による単粒子解析(注3)によって決定しました。
QRFPはペプチドホルモン(注4)であり、受容体であるGPR103を活性化することで、エネルギー代謝や食欲の制御に重要な役割を果たします。しかし、どのようにQRFPがGPR103を活性化するのか、その詳細なメカニズムは不明でした。
今回、決定した構造を基に、QRFPの結合様式と受容体の活性化メカニズムを明らかにしました。QRFPはGPR103の膜貫通領域から細胞外領域にわたる独特の結合様式とダイナミクスを持ち、高い親和性で受容体と結合できることがわかりました。この研究成果から、QRFP-GPR103システムを標的としたより効果的で安全な治療薬の設計が可能となり、代謝および食欲障害の治療薬開発への貢献が期待されます。
発表内容
研究の背景
神経ペプチドは、さまざまな生理プロセスを調整するシグナルとして働きます。その中で、C末端にアルギニン-フェニルアラニン-NH2(RFアミド)モチーフを持つペプチドは、RFアミドペプチドと呼ばれ、さまざまな生物学的機能において重要な役割を果たしています。RFアミドファミリーに属する神経ペプチドは、各々特定のGタンパク質共役型受容体(GPCR) (注5)と相互作用し、生理的応答の調節を開始します。
RFアミドペプチドの一種であるQRFPは、摂食行動の調節からエネルギー恒常性(注6)の制御まで、さまざまな生理機能に関与しています。QRFPはGPCRであるGPR103を選択的に活性化することによって、こうした作用を発揮します。そのため、GPR103を標的とした薬剤は代謝障害や食欲調節に関連する疾患の治療薬の標的として注目されています。しかしながら、RFアミドを認識するGPCRはGPR103含めて5種類あり、選択的な薬剤の開発が困難でした。そこで、GPR103の構造が明らかになれば、構造情報に基づいた薬剤の開発が可能になると考えました。
研究の内容と成果
本研究では、クライオ電子顕微鏡を用いた単粒子解析法によって、QRFPが結合したGPR103とGqタンパク質三量体との複合体の立体構造を3.2 Åの分解能で決定しました(図1)。QRFPのC末端ヘプタペプチド(GGFSFRF-NH2)(注7)は、膜貫通領域(TMD)内に垂直にフィットし、TMDおよび細胞外ループ(ECL2)との広範な相互作用ネットワークを形成しています。この相互作用は、QRFPのC末端アミドの認識に重要な役割を果たしており、特にE203ECL2およびE2976.59といった酸性アミノ酸残基とのイオン間相互作用(注8)が重要であることがわかりました(図1)。
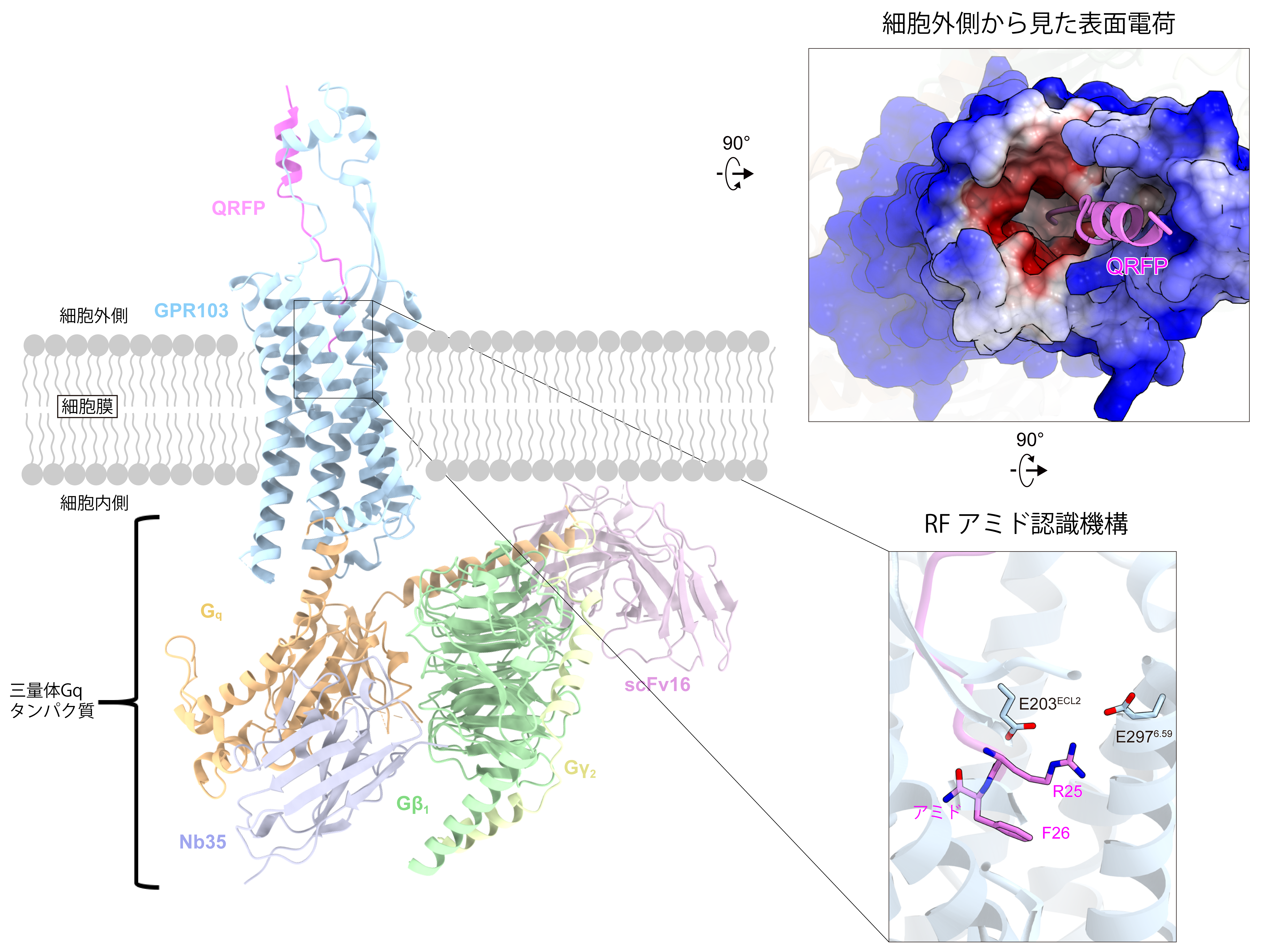
図1:GPR103の構造およびRFアミド認識機構
QRFPのC末端のRFアミドを認識しているアミノ酸残基は、他のRFアミド受容体の間で保存されており、共通した結合様式であることがわかりました(図2)。一方、近縁のペプチド受容体には、RYアミドペプチドを認識するNPY受容体が存在しています。内在性ペプチドであるNPYが結合したNPY受容体Y1と構造を比較すると、RYアミド受容体では、C末端のチロシンの水酸基が受容体内で水素結合を形成するのに対し、RFアミド受容体では、フェニルアラニンとの疎水性相互作用が重要であることがわかりました(図2)。RFアミドとRYアミドの認識メカニズムの違いが明確になり、ペプチドホルモンの受容体選択性への理解が深まりました。
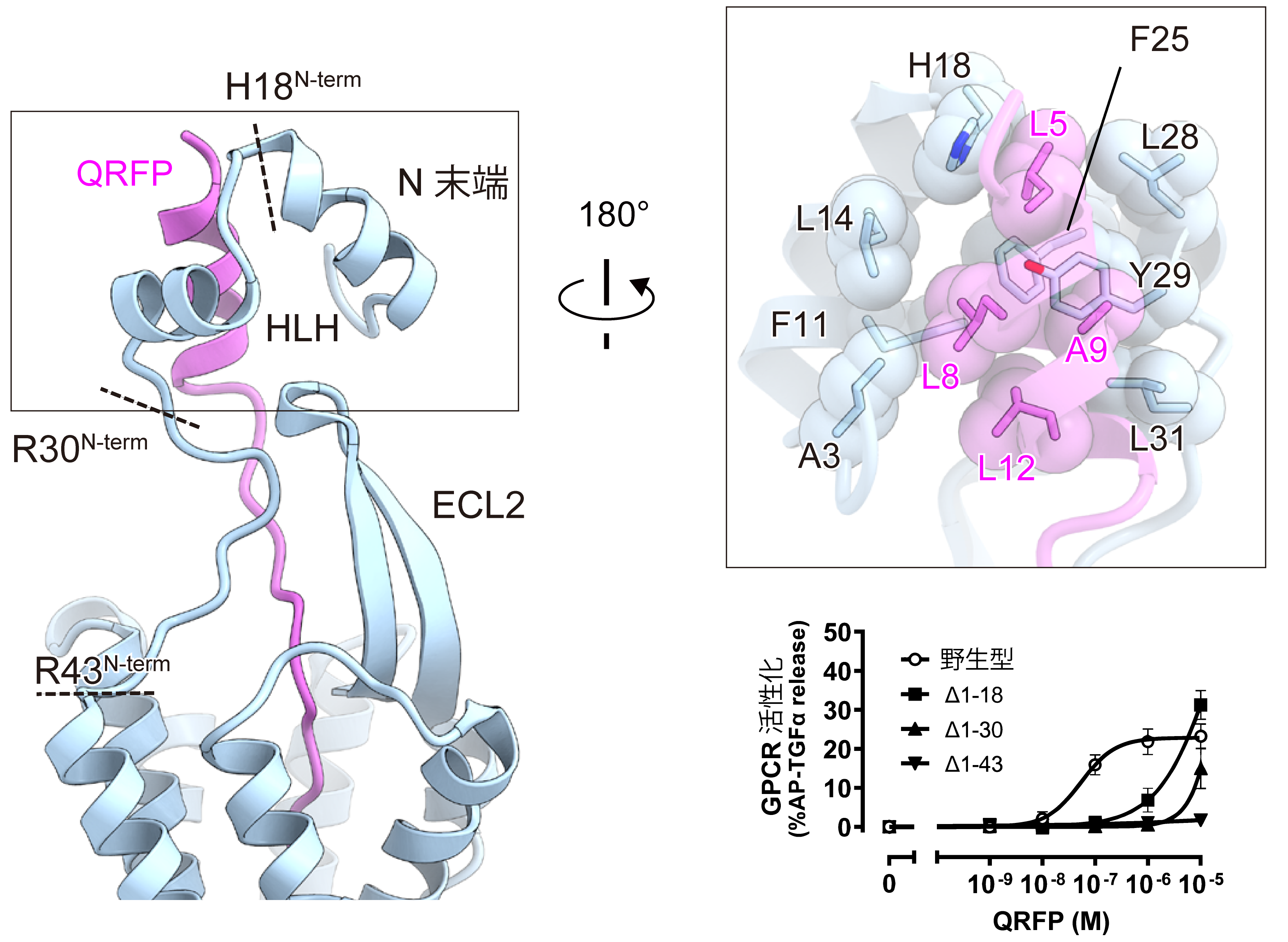
図2:RFアミド受容体とRYアミド受容体の重ね合わせ(左)と認識メカニズムの違い(右))
また、QRFPのN末端部分は、細胞外領域にある構造によって挟み込まれる形で認識されていました(図3)。この細胞外領域を欠失させた変異体は、QRFPの活性が大きく低下しました。細胞外領域の動きを解析した結果、QRFPのC末端を基点に、受容体の細胞外半分全体が振り子のように動いていました(図4)。このGPR103特異的な細胞外領域の構造とダイナミクスが、QRFPを高い親和性で受容するのに重要であることがわかりました。
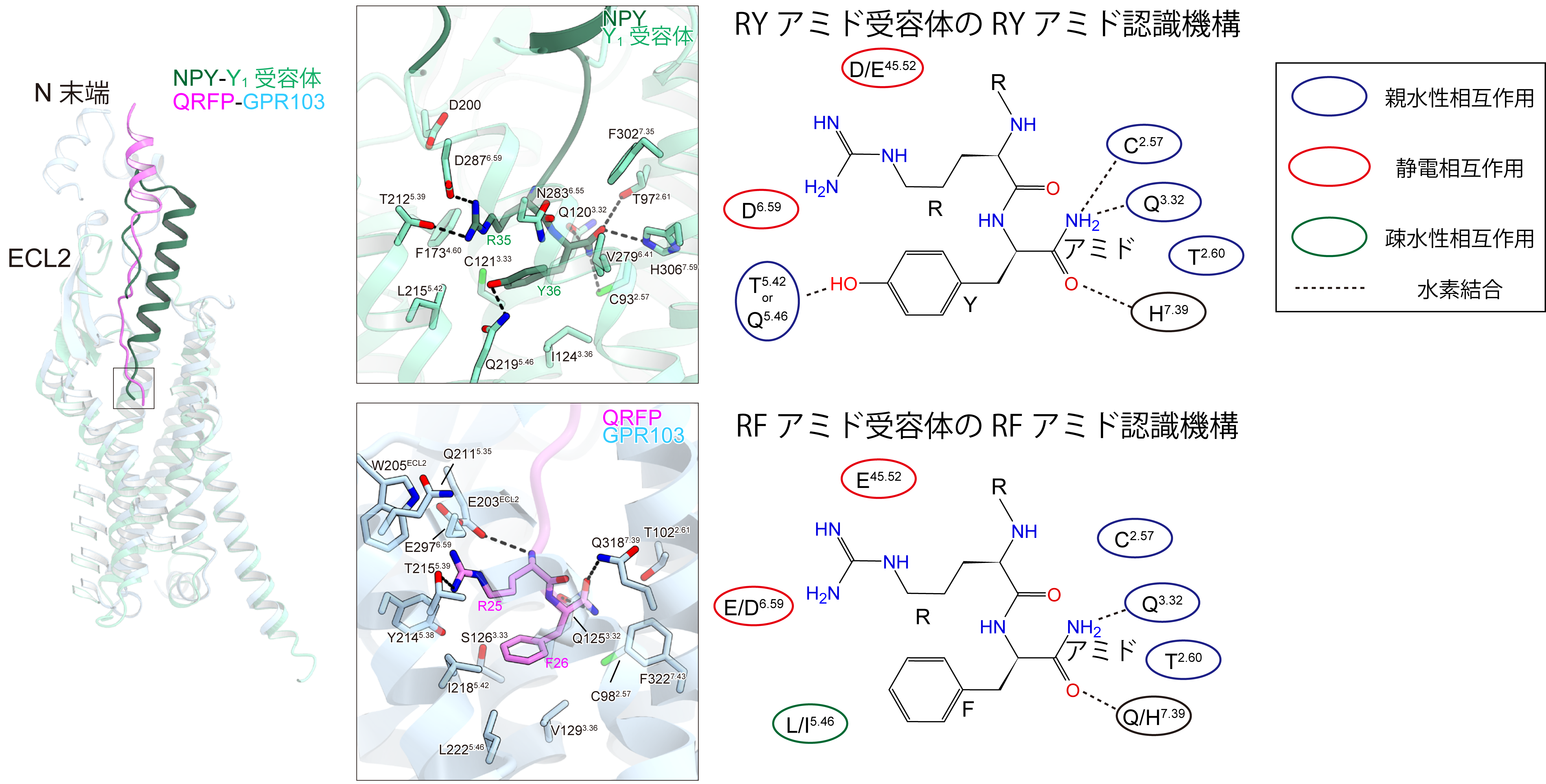
図3:細胞外領域の相互作用と変異体実験
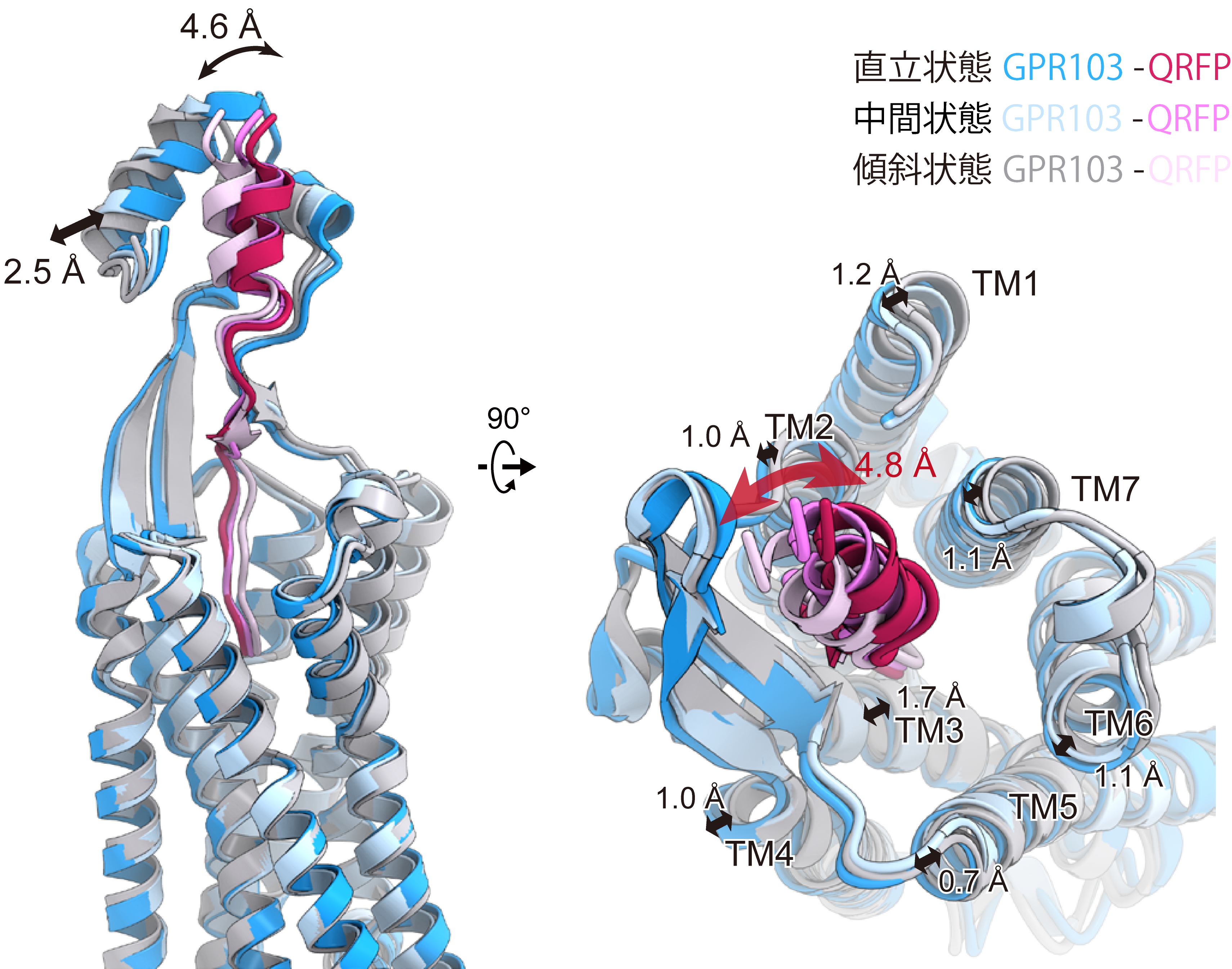
図4:細胞外領域のダイナミクス
本研究の成果は、代謝および食欲調節に関連する疾患の治療薬開発に向けた新たな手がかりを提供するものです。QRFP-GPR103の結合メカニズムの理解が深まることで、より効果的で安全な作動薬の設計が可能となり、創薬研究への貢献が期待されます。この研究は、GPCRリガンド相互作用の理解を深化させるとともに、将来的な治療法の開発に向けた基盤を提供します。
論文情報
- 雑誌名
Nature Communications論文タイトル
Structure and dynamics of the pyroglutamylated RF-amide QRFP receptor GPR103著者
Aika Iwama, Ryoji Kise, Hiroaki Akasaka, Fumiya K. Sano, Hidetaka S. Oshima, Asuka Inoue*, Wataru Shihoya*, Osamu Nureki *
(* : 責任著者)
研究助成
本研究は、日本学術振興会における科学研究費助成事業の基盤S「生体環境でのGPCRの構造ダイナミクス」(課題番号:21H05037 研究代表者:濡木 理)や基盤B「クライオ電子顕微鏡法を用いたGPCR創薬研究」(課題番号:22H02751 研究代表者:志甫谷 渉)、基盤A「G12/13シグナルを標的としたデザイナーGPCRの開発と疾患治療戦略」(課題番号:21H04791 研究代表者:井上 飛鳥)の一環で行われました。また、本研究は、AMED「創薬等ライフサイエンス研究支援基盤事業」および「革新的先端研究開発支援事業インキュベートタイプ」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
用語解説
注1 三量体Gタンパク質Gq
Gタンパク質は、細胞内情報伝達に関わるGTP結合タンパク質であり、Gα、Gβ、Gγサブユニットの三量体により構成されている。活性化されたGタンパク質共役受容体と結合したGタンパク質三量体では、GDP-GTP交換反応が起き、GαとGβ-Gγの二つに解離する。解離したサブユニットが下流のシグナル伝達因子と結合し活性化することで、細胞にさまざまなシグナル応答が生じる。Gαサブユニットは大きくGs、Gi、Gq/11、G12/13の4種類に分別され、特にGqは、下流で細胞内カルシウム濃度を上昇させることで様々なシグナルを伝える。
注2 クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質や核酸をはじめとする生体高分子の像を多数撮影することで立体構造の決定を行う、単粒子解析法に用いられる。
注3 単粒子解析
多数の均一な粒子を観察、撮影し、画像処理によって粒子の詳細な構造を得る手法。単一の撮影像よりも分解能を向上させることができるほか、様々な方向を向いた粒子を撮影することで、3次元立体構造を把握することが可能となる。
注4 ペプチドホルモン
血流へ分泌され、内分泌機能を持っているペプチド類の総称。ペプチドホルモンは血液を通し体の細胞のすべてに拡散、それらの標的細胞の表面で固有の受容体と相互作用することで生理機能を発揮する。
注5 Gタンパク質共役受容体(GPCR)
GPCRは細胞膜に発現する膜タンパク質で、膜を貫通する7本のαヘリックスで構成されている。膜受容体タンパク質のなかで最大のファミリーを形成し、細胞外領域で特定のリガンドが結合することで活性化し、細胞内の三量体Gタンパク質を活性化することでシグナルを伝達する。体内で多様な生理作用の調節に重要な役割を果たすことから、既承認薬の30%以上がGPCRを標的にした薬剤になっている。
注6 エネルギー恒常性
体の中の変化や外部環境の変化に影響されずに、生体のエネルギー状態が一定に保たれる性質 のこと。
注7 ヘプタペプチド
7つのアミノ酸が連なったペプチド。
注8 イオン間相互作用
正電荷を持つ陽イオン)と負電荷を持つ陰イオンの間の静電引力による化学結合。例えばアルギニンやリシンといった正電荷を持つアミノ酸は、アスパラギン酸やグルタミン酸といった負電荷をもつアミノ酸とイオン間相互作用を形成する。