2024-06-27 東京大学
発表のポイント
- 植物を用いた研究から、真核生物に広く保存されたヒストン修飾であるH3K9メチル化が、これまでの常識に反して転写の抑制のみならず促進する機能を持つことを明らかにしました。
- H3K9メチル化はこれまで考えられていたように単に転写の抑制を誘導するだけではなく、他のヒストン修飾と関わり合いながら転写を柔軟に制御する役割があることが示唆されます。
- 同様の仕組みが、他の生物にも存在する可能性が考えられ、人間や動物の発生や生理などにも重要な役割を果たすヒストン修飾の機能解明への一助となることが期待されます。
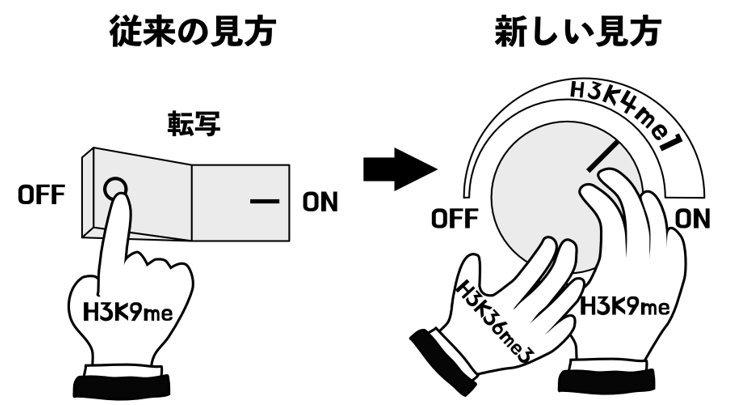
H3K9メチル化の機能に関する従来の見方と本研究で提唱する新しい見方
発表概要
東京大学大学院理学系研究科の稲垣宗一准教授らによる研究グループは、植物のシロイヌナズナ(注1)を用いた研究から、真核生物に広く保存されたヒストン修飾(注2)であるH3K9メチル化が、従来の定説である転写抑制機能に加えて、真逆の機能、つまり転写促進機能を持つことを明らかにしました。このH3K9メチル化が持つ「二刀流」の機能は転写抑制に働くタンパク質「LDL2」と、LDL2の機能を阻害することによって転写を促進するタンパク質「ASHH3」によって実現されることがわかりました(図1)。この結果はゲノム中のどこが「活性化」され、どこが「不活性化」されるかを決める仕組みを説明する新しい仮説を提唱するものです。本研究の成果は、エピジェネティクス研究の初期に発見され長い間転写の抑制修飾として信じられてきたH3K9メチル化の機能について一石を投じるものであり、同様の仕組みが他の生物でも見つかる可能性が考えられます。
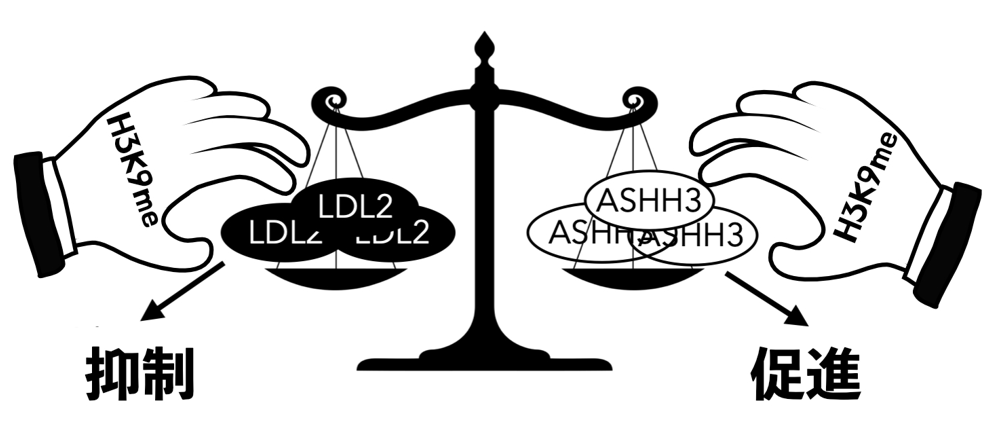
図1:H3K9メチル化は転写の抑制と促進の両方を制御する
H3K9メチル化はH3K4脱メチル化酵素(注3)であるLDL2の機能を介して転写を抑制するとともに、H3K36メチル化酵素(注3)であるASHH3の機能を介してLDL2の機能を阻害し、転写の抑制を抑制する(つまり転写を促進する)。つまり、LDL2とASHH3の機能のバランスで転写の強さが決定される。
発表内容
研究の背景
今から25年ほど前に、遺伝子の転写を抑制するヒストン修飾としてマウス、ショウジョウバエ、分裂酵母、シロイヌナズナなどで発見されたヒストンH3タンパク質の9番目のリジンのメチル化(H3K9meと省略)は、その後もその役割や制御の仕組みが世界的に活発に研究されてきました。H3K9meをヒストンに導入するH3K9メチル化酵素は広く真核生物に保存され、不必要な遺伝子の転写を抑制する機能を持つことが明らかになってきました。これらのことから、H3K9meは「転写抑制マーク」として広く知られ、このモデルを元に多くの研究がされてきました。しかしながら、H3K9meそのものの機能、つまり、H3K9meがどのようにして転写抑制を制御しているのか、その詳細な仕組みは明らかになっていませんでした。
私たちはこれまで植物のシロイヌナズナの遺伝学を用いた研究からH3K9meの機能を調べてきました。H3K9meが本来働く場所(転写が抑制されるべきトランスポゾン配列(注4))から本来働くべきでない場所(転写されるべき遺伝子配列)に広がってしまうibm1変異体を用いることで、H3K9meが転写を抑制する仕組みを詳細に調べてきました。その結果、H3K9meはLDL2というタンパク質の働きによって、別のヒストン修飾であるH3の4番目のリジンのモノメチル化(H3K4me1)を除くことによって転写を抑制していることを明らかにしました(図2A)。H3K4me1には転写を促進する働きがあるため(関連プレスリリース①,②)、H3K4me1が除かれて減少すると転写が抑制されるということです。今回の研究では、H3K9meがH3K4me1を除き転写を抑制するというこの経路をさらに詳細に調べることで、驚くべきことに、H3K9meは自身で誘導するこの経路にブレーキをかけるような働きを持つことを明らかにしました。
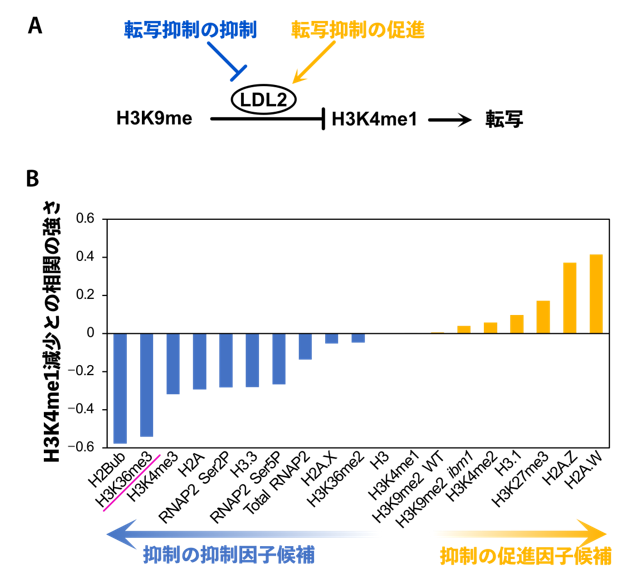
図2:H3K9meによる転写抑制に関わる因子の探索
(A)黒い部分はこれまでに明らかになっていたH3K9meによる転写抑制の仕組み。今回探索した、青色で示す転写抑制を抑制する因子と黄色で示す転写抑制を促進する因子は、LDL2の機能の調節によってH3K4me1の量を介して転写の強さを調節していると想定される。通常の矢印は「促進・誘導」の意味を表し、T字の印は「抑制・阻害」の意味を表す。(B)抑制の調節因子の探索。横軸にはさまざまなヒストン修飾などが並んでおり、その中で、ibm1変異体でH3K9meが蓄積する遺伝子のうちH3K4me1が減少する程度(転写抑制の程度)と相関するものを探索した。今回はH3K4me1減少と強い負の相関を示したH3K36me3(赤下線)を、H3K9meによる転写抑制を働かせなくする「抑制の抑制因子候補」としてさらに解析した。
研究の内容
本研究ではまず、ibm1変異体でH3K9meが蓄積する遺伝子の中にはH3K4me1が減少する遺伝子と減少しない遺伝子があることに気づきました。つまり、H3K9meによって転写が抑えられる遺伝子と抑えられない遺伝子があるということです。そこでこの遺伝子間の違いが何によって決まっているかを明らかにするために、抑えられる遺伝子と抑えられない遺伝子にみられる特徴を探索しました。その結果、H3K9meによってH3K4me1が減少せずに転写が抑えられない遺伝子の特徴として、さらに別のヒストン修飾であるH3の36番目のリジンのトリメチル化(H3K36me3)の量が多いということが見つかりました(図2B)。H3K36me3も真核生物に広く保存されており、転写の活性化と関連していると考えられています。このことから、H3K36me3には、H3K9meによる転写抑制を働かせなくする機能があるのではないかと仮説を立て、それを検証しました。
その検証のために、まず、ibm1変異体におけるH3K36me3のゲノム全体でのパターンを、ChIP-seq(注5)という方法で解析しました。その結果、驚くべきことに、ibm1変異体でH3K9meが蓄積する遺伝子の一部でH3K36me3の量も増えていることがわかりました。遺伝子抑制マークとして知られるH3K9meが遺伝子活性化マークのH3K36me3を呼び込むという本結果は、これまでのエピジェネティクス研究分野の常識からは全く予想外でした。そこで、この新奇の経路のメカニズムを探るために、H3K36me3を導入するメチル化酵素を探索することにしました。その結果、これまで機能がほとんどわかっていなかったASHH3というタンパク質が、ibm1変異体においてH3K9meが蓄積した遺伝子にH3K36me3を導入していることが明らかになりました(図3A)。ibm1変異体とashh3変異体の二重変異体ではH3K36me3を導入できないため、H3K9meによる転写抑制がより顕著に働き重要な遺伝子が発現できなくなることで、植物が正常に発生できないことがわかりました(図3B)。
これらの結果から、H3K9meは、LDL2によってH3K4me1を除き転写を抑制するという経路と、ASHH3によってH3K36me3を導入し、LDL2によるH3K4me1除去を阻害することで転写抑制を抑制する経路という、真逆の2つの機能を持つ経路を駆動していることが明らかになりました(図3A)。さらにこのメカニズムは、本来H3K9meによって抑制されているトランスポゾン配列においても働いていることも明らかになりました。 。

図3:ASHH3はH3K36me3の導入を通して、H3K9meによる転写抑制を阻害する
(A)本研究で見出したH3K9meによる転写抑制制御の仕組み。H3K9meは、LDL2の働きを介してH3K4me1を除去し転写を抑制する仕組みと、ASHH3の働きを介してH3K36me3を導入し、転写の抑制を阻害する仕組みの両方を併せ持つ(図1も参照)。(B)ibm1変異体は転写の抑制が過剰に働くことでやや発生異常が見られるが、ibm1 ashh3二重変異体ではさらに抑制が進むため、顕著な発生異常が引き起こされる。
今後の展望
本研究成果は、これまで謎であったH3K9meが転写を抑制するメカニズムの詳細を明らかにしました。H3K9meが転写の抑制を促進するだけではなくブレーキ機能も内蔵しているという今回の発見は、これまでのエピジェネティクス研究の常識を大きく覆すものであり、ヒトや動物など他の生物種での同様のメカニズムの探索など、関連する研究分野への波及効果が期待されます。また、ヒストン修飾による転写制御に新たなレイヤーの知見が加わることで、環境に応答した柔軟な遺伝子発現制御の理解につながり、植物の高い環境適応能力の理解やその活用が期待されます。
〇関連情報:
「プレスリリース名①ゲノム上に密に並んだ遺伝子の転写を調整する仕組み」(2021/03/02)
「プレスリリース名②「記録」のメチル化と「解読」のメチル化:ヒストン修飾の分布を決める2つの仕組み」(2022/08/11)
論文情報
- 雑誌名
Science Advances論文タイトル
H3K9 methylation regulates heterochromatin silencing through incoherent feedforward loops著者
Kannosuke Yabe, Asuka Kamio, Satoyo Oya, Tetsuji Kakutani, Mami Hirayama, Yuriko Tanaka, Soichi Inagaki*
(*:責任著者)DOI番号
10.1126/sciadv.adn4149
研究助成
本研究は、日本学術振興会科学研究費助成事業(課題番号:JP20H05913, JP22H02299,JP21H04977)、科学技術振興機構「さきがけ(課題番号:JPMJPR17Q1)」などの支援により実施されました。
用語解説
注1 シロイヌナズナ
代表的な実験植物。シロイヌナズナはゲノムサイズが小さく、世代時間が短く、遺伝子組換え等も容易で、また、真核生物に存在するヒストン修飾のほとんどを持つため、ヒストン修飾制御の研究に適している。
注2 ヒストン修飾
ヒストンはゲノム中でDNAが巻き付いているタンパク質複合体で、その翻訳後修飾(メチル化、アセチル化、リン酸化など)は局所的なDNAの高次構造などに変化をもたらす。エピジェネティックな遺伝子制御に関わる修飾である。
注3 ヒストンメチル化酵素・脱メチル化酵素
ヒストンの特定のアミノ酸にメチル化を導入する酵素をメチル化酵素、逆に、メチル化をヒストンから除去する酵素を脱メチル化酵素と呼ぶ。代表的なメチル化酵素にSETドメインタンパク質があり、代表的な脱メチル化酵素にLSD1とJUMONJI型タンパク質がある。ASHH3はSETドメインタンパク質、LDL2はLSD1型タンパク質、IBM1はJUMONJI型タンパク質である。ヒストンメチル化酵素はWriter(鉛筆)に、脱メチル化酵素はEraser(消しゴム)に例えられる。
注4 トランスポゾン
ゲノム中を「飛び回る」ことができるDNA配列。重要な遺伝子に飛び込み、破壊する可能性があるので、生物はトランスポゾンの飛ぶ活性を厳密に制御する必要がある。トランスポゾンを飛ばなくする仕組みとして、DNAのメチル化やヒストンメチル化などがある。
注5 ChIP-seq
Chromatin Immunoprecipitation sequencing(クロマチン免疫沈降シーケンス)の略称。注目するタンパク質やその修飾が存在しているゲノム上の位置を特定する手法。注目するタンパク質と特異的に結合するような抗体をクロマチンと混合後に回収することで、そのタンパク質に結合しているDNAを得ることができる。回収したDNAの配列をシーケンサーで決定してゲノム配列と比較することで、存在領域を決定する。